麻醉高风险高龄退变性腰椎管狭窄症患者经皮脊柱内镜下椎管减压术治疗效果研究
高尚聚,李文毅,张隆,魏景超,曹参
本文创新点:
(1)随着人口老龄化的加剧,人均寿命的延长,高龄腰椎管狭窄症发病率越来越高,本研究为术前麻醉评估为高风险的高龄腰椎管狭窄症患者提供了一种安全、有效的治疗方式。
(2)因为压迫部位不同腰椎管狭窄症的临床表现有较大差异,本研究病例资料涵盖了腰椎管狭窄症中各种类型的临床表现。
随着人口老龄化越来越严重,老年髋部骨折、脊柱骨质疏松性骨折、脊柱退变性疾病等发病率越来越高,骨科医生常需要面对除原发病以外的许多合并症,尤其是对手术创伤和麻醉风险的评估使老年骨科疾病的治疗选择变得越来越有挑战性[1-2]。腰椎管狭窄症是与年龄高度相关的老年退变性疾病,病程长,保守治疗效果不佳,严重影响患者的日常生活。许多具有手术指征的患者因为手术创伤和麻醉风险又无法完成较大的手术。随着脊柱内镜技术及器械的不断发展,脊柱内镜的应用范围也不断扩大,目前大部分类型的腰椎间盘突出症可以应用脊柱内镜治疗,并取得了满意疗效[3]。腰椎管狭窄症患者脊柱内镜下椎管减压术目前也得到了迅速发展,并取得了满意疗效。对于术前麻醉评估高风险的老年患者无法耐受全身麻醉(简称全麻)或椎管内麻醉下的开放手术,这时局部麻醉(简称局麻)下经皮脊柱内镜下椎管减压术就成为一种很好的替代手术方案。笔者回顾性总结了术前存在麻醉高风险的18例高龄退变性腰椎管狭窄症患者接受局麻下经皮脊柱内镜下椎管减压术的疗效,现报道如下。
1 资料与方法
1.1 纳入与排除标准 纳入标准:(1)年龄≥75岁;(2)下肢间歇性跛行或下肢放射痛;(3)CT、MRI表现与临床症状相符;(4)经系统保守治疗3个月以上无效,或下肢放射痛剧烈,虽然病程较短,但无法耐受保守治疗;(5)临床资料完整,随访时间≥1年;(6)术前练习能耐受40 min以上的俯卧位。排除标准:(1)退变性滑脱或不稳定;(2)合并重症肺炎、症状性心力衰竭、新发脑梗死、心肌梗死等不稳定的内科疾病;(3)有脊柱肿瘤、感染等;(4)有精神异常及凝血功能障碍。
1.2 一般资料 选取2016年12月—2017年4月河北省人民医院骨科收治的高龄退变性腰椎管狭窄症接受经皮脊柱内镜下椎管减压术治疗的患者18例,其中男11例,女7例;年龄75~86岁,平均(79.1±6.4)岁。术前麻醉风险评估均为美国麻醉医师协会(ASA)[4]分级标准 P3 及以上,其中 ASA P3 16 例,ASA P4 2 例;均合并2种及以上内科疾病;合并慢性阻塞性肺疾病13例,冠心病12例,高血压12例,心律失常8例,慢性心力衰竭5例,糖尿病4例,肺间质纤维化3例;手术节段为 L3~4间隙 3 例,L4~5间隙 10 例,L5~S1间隙4例,另外1例患者为L4~5、L5~S1双节段手术;单侧下肢症状11例,双侧下肢症状7例;术前临床表现均有典型的间歇性跛行伴或不伴有坐骨神经痛,伴或不伴憋胀、麻木感、下肢肌力及皮肤感觉异常;所有患者膀胱直肠功能正常(见表1)。术前除常规检查外根据患者合并内科疾病情况行血气分析、肺功能、心脏彩超等检查,并请心内科、麻醉科会诊评估是否可耐受手术及局麻,给予相应治疗。
1.3 治疗方法 采用德国SPINENDOS经皮脊柱内镜系统、美国Elliquence低温等离子射频消融系统及天津希冀脊柱内镜动力系统进行手术。术前在病房指导患者适应俯卧位,并进一步评估患者是否可以耐受手术。局麻,手术过程中给予心电、血压、呼吸、血氧饱和度监测,并给予浓度为4 μg/ml右美托咪定,以3~8 ml/h速度持续微量泵泵入,手术全程有麻醉师进行麻醉管理。术前需根据临床表现及影像学表现确定责任节段,必要时术前采用选择性神经根阻滞术(SNRB)以明确责任节段[5-7]。
1.3.1 手术方法 椎间孔入路:建立液路并连接心电、血压、血氧饱和度监测后取俯卧位并悬空腹部。C型臂X光机定位穿刺路径,取头倾15°左右,以1%利多卡因行皮肤及皮下组织麻醉,穿刺针进入椎间孔后以0.5%利多卡因行椎管内麻醉。逐级软组织扩张后置入环踞保护套管,以环踞行椎间孔扩大成形(见图1a),然后置入工作通道,进入镜下操作。进入镜下后首先寻找背侧的关节突及尾端的椎弓根上缘,作为骨性解剖标记,行椎间孔周围软组织预止血后,根据椎间孔成形的部位及大小,利用椎板咬骨钳行椎间孔二次成形(见图1b),扩大工作通道的活动度,便于行行走神经探查。镜下探查范围要自上位椎体下缘-盘黄间隙-下位椎体后上缘甚至下位椎弓根上缘。对于外侧及背侧肥厚的黄韧带、突出的髓核、增厚的纤维环及神经根腹侧的后纵韧带要做到彻底的切除减压,如有椎体后缘的骨赘增生利用高速磨钻进行磨平(见图1c)。减压结束的标志为行走神经根的起始部、盘黄间隙部及下位椎体后上缘部均可以随水压自由搏动(见图1d、e、f),若为双下肢症状或对侧有影像学的椎管狭窄,应该同时行椎间盘对侧部分的减压。
椎板间入路:建立液路并连接心电、血压、血氧饱和度监测后取俯卧位并悬空腹部。C型臂X光机定位椎板间隙的外缘,以1%利多卡因行皮肤及皮下组织浸润麻醉,穿刺针首先穿入上关节突背侧部分,行椎板及关节突表面浸润麻醉后,向内倾斜针尖,自黄韧带刺入硬膜外间隙,有落空感后停止进针,回抽无液体后以0.5%利多卡因12 ml行硬膜外注射(见图2a),此时可复制患者术前的下肢放射痛。置入工作通道,利用黄韧带逐层切开技术打开椎管(见图2b)。利用椎板咬骨钳或高速磨钻向外侧磨除部分下关节突,进一步扩大椎管,直至暴露行走神经根的外缘,以双极射频止血分离神经根后,旋转工作通道,自神经根外侧进入椎管,探查腹侧椎间盘并减压,若患者为双侧症状则行单侧入路双侧减压,沿棘突根部做对侧椎板的磨除(见图2c),做到对侧硬膜囊及神经根的背侧减压。减压完成的标志为神经根空间充裕,搏动良好(见图2d)。
1.3.2 术后处理 术后当天绝对卧床,避免椎管内血肿,密切观察双下肢肌力、皮肤感觉及二便情况;术后第1天复查MRI(见图1g、图1h、图2e、图2f)后佩戴腰围下床活动,每次下地时间不宜过长,一般为15 min以内,术后6周避免久站及久坐。术后3个月恢复正常生活及活动。
1.4 观察指标 手术时间、住院时间;术后第1天复查MRI评价减压情况,术前、术后6周、6个月、1年分别评价患者腰和下肢痛的视觉模拟评分(VAS)[8];腰椎功能评价采用Oswestry功能障碍指数(ODI)[9]。采用门诊随访方式对患者进行随访,随访时间为术后6周、6个月、1年,随访截止时间为2019年2月。
1.5 统计学方法 采用SPSS 18.0统计软件对数据进行整理。计量资料以(±s)表示,多时间点比较采用单因素方差分析,时间点间两两比较采用Bonferroni(B)。以P<0.05为差异有统计学意义。
2 结果
2.1 术后一般情况 患者共随访14~25个月,平均19个月。除1例术前症状为单侧间歇性跛行、责任节段为L4~5的患者术中完成盘黄间隙减压后因颈痛烦躁中止手术外,其余患者均顺利完成手术(1例患者行L4~5、L5~S1双节段手术外其余均为单节段手术)。手术时间30~81 min,平均(49.5±17.0)min;住院时间 5~14 d,平均(7.9±1.2)d;患者术后下肢痛及间歇性跛行均明显缓解。1例患者因术中无法忍受的颈痛而中止手术,但术后效果良好,间歇性跛行症状改善明显;1例患者术后夜间出现心力衰竭加重,转心血管内科治疗后好转;1例L5~S1节段患者术后出现拇趾背伸肌力减弱及L5神经根支配区感觉减退,2个月后恢复。1例患者术后1周出现患侧臀部及大腿后方放射性疼痛,复查MRI排除椎间盘突出复发,口服非甾体抗炎药2周无效,后行椎间孔及盘内复方倍他米松7 mg+1%利多卡因2 ml封闭治疗后明显缓解。无术后感染及椎管内血肿、腰椎不稳定等并发症。
2.2 VAS、ODI比较 术后6个月、1年腰VAS低于术后6周,差异有统计学意义(P<0.01);术后6周、6个月、1年下肢VAS、ODI低于术前;术后1年ODI低于术后6周,差异有统计学意义(P<0.001,见表2)。
表1 患者术前临床特点(±s)Table 1 Clinical characteristics of patients before operation
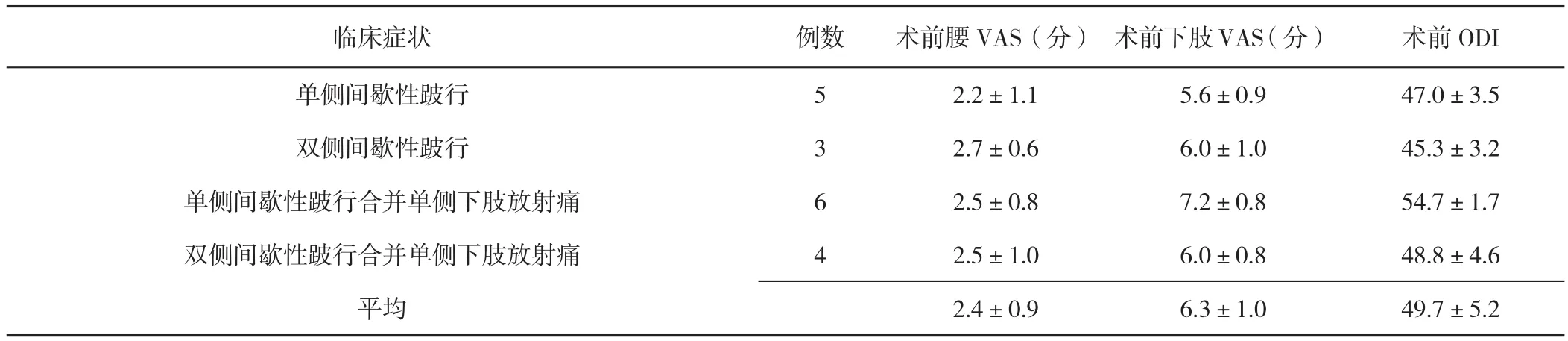
表1 患者术前临床特点(±s)Table 1 Clinical characteristics of patients before operation
注:VAS=视觉模拟评分,ODI=Oswestry功能障碍指数
临床症状 例数 术前腰VAS(分) 术前下肢VAS(分) 术前ODI单侧间歇性跛行 5 2.2±1.1 5.6±0.9 47.0±3.5双侧间歇性跛行 3 2.7±0.6 6.0±1.0 45.3±3.2单侧间歇性跛行合并单侧下肢放射痛 6 2.5±0.8 7.2±0.8 54.7±1.7双侧间歇性跛行合并单侧下肢放射痛 4 2.5±1.0 6.0±0.8 48.8±4.6平均 2.4±0.9 6.3±1.0 49.7±5.2
表2 不同时间点腰VAS、下肢VAS和ODI比较(±s,n=18)Table 2 ODI and VAS score of the low back pain and leg pain of the patients assessed before surgery,and at 6 weeks,6 months and 1 year after the surgery
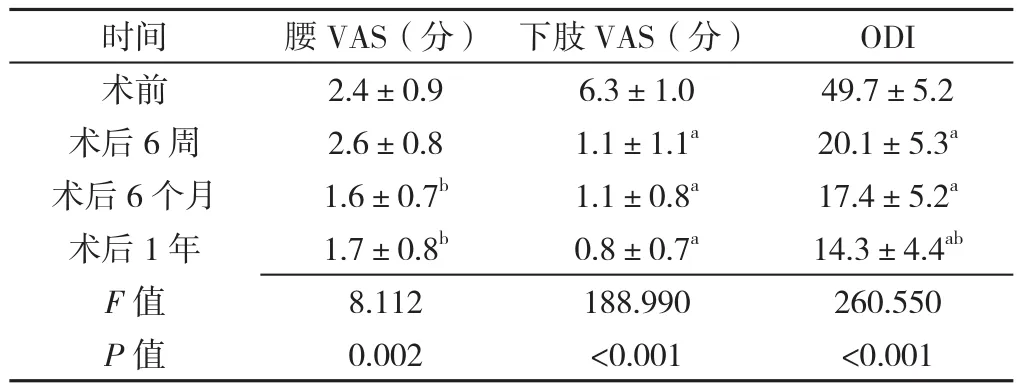
表2 不同时间点腰VAS、下肢VAS和ODI比较(±s,n=18)Table 2 ODI and VAS score of the low back pain and leg pain of the patients assessed before surgery,and at 6 weeks,6 months and 1 year after the surgery
注:与术前比较,aP<0.001;与术后6周比较,bP<0.05
时间 腰VAS(分) 下肢VAS(分) ODI术前 2.4±0.9 6.3±1.0 49.7±5.2术后6周 2.6±0.8 1.1±1.1a 20.1±5.3a术后6个月 1.6±0.7b 1.1±0.8a 17.4±5.2a术后1年 1.7±0.8b 0.8±0.7a 14.3±4.4ab F值 8.112 188.990 260.550 P 值 0.002 <0.001 <0.001
3 讨论
老年退变性腰椎管狭窄症是在椎间盘退变的基础上,出现小关节增生内聚、黄韧带肥厚等,神经根在周围狭窄部位长期受到挤压刺激产生症状[10]。因致病因素较多且复杂,术前应个体化分析,做到精准减压并完成神经根的全程探查[11]。经皮脊柱内镜技术最早于1997年由美国Anthony Yeung教授报道并应用于腰椎间盘突出症的治疗。随着该技术的不断成熟,经皮脊柱内镜的椎管内操作范围逐渐增大,使其对腰椎管狭窄症的治疗成为一种可能。而对于腰椎管狭窄症的治疗,需要根据不同的临床症状确定手术减压的区域和范围。一般合并下肢放射性疼痛患者因为椎管狭窄合并软性椎间盘突出,单纯间歇性跛行患者致病因素为神经根压迫导致的慢性缺血。个体化的减压对手术疗效至关重要。许多患者间歇性跛行病程很长,但不会接受手术治疗,疼痛是高龄腰椎管狭窄症患者的首要就诊原因[12]。这时手术的目的就以缓解疼痛作为最低要求,软性的椎间盘突出为疼痛的主要致病因素,因此类患者手术耐受性差,故应首先行椎间盘切除术,在此基础上进一步行神经周围减压。因经皮脊柱内镜无法做到与开放手术相媲美的全椎管的探查和减压,本研究旨在根据患者的临床特点和影像学特点,利用脊柱内镜技术靶向减压,去除导致症状的致病因素,达到临床缓解症状的目的,为无法耐受全麻下开放手术的患者提供一种安全、有效的治疗选择。
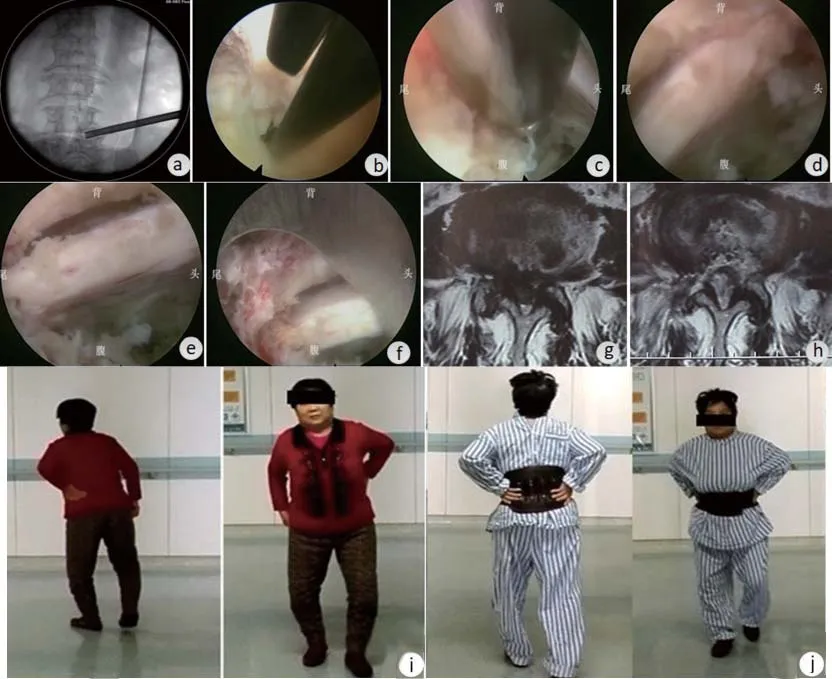
图1 椎间孔入路脊柱内镜下椎管减压术Figure 1 Percutaneous endoscopic spinal decompression via a transforaminal approach
全麻对人体的呼吸系统及循环系统影响较大,尤其对于合并多种内科疾病的老年患者,抗打击能力弱,除手术本身的创伤外,能否耐受麻醉对其也是一种很大的挑战,而局麻对机体全身系统影响小,可以有效降低麻醉风险[12]。局麻优点很多,包括安全性高、术后没有全麻的呕吐、恶心等不适,住院时间缩短、术后无须导尿等[13]。同时经皮脊柱内镜手术通过穿刺针进入硬膜外腔后局部注射麻醉药物,可起到类似硬膜外麻醉的效果,可以做到阻滞感觉但不影响下肢运动,同时对手术刺激有反应,是一种安全而有效的麻醉方式。
腰椎管狭窄症的手术方法很多,有疼痛科介入手术、椎板开窗手术、经关节突植骨融合内固定手术(TLIF)及椎板减压植骨融合内固定手术(PLIF)等,疼痛介入手术及麻醉创伤小,治疗效果较差。开放手术需全身或硬膜外麻醉,且手术创伤偏大,对于合并多种基础疾病的患者是一种极大的挑战[14],尤其对于麻醉风险评估ASA P3以上的老年患者,并发症发生率明显增高。MACHADO等[15]指出对于80岁以上接受手术的腰椎管狭窄症患者,其并发症发生率接近4%,30 d内死亡率达1%,且融合手术并发症及30 d内死亡率明显高于单纯减压手术。局麻+基础麻醉下的脊柱内镜下椎管减压术是一种局麻下的微创手术,可以做到在最小的手术和麻醉创伤的代价下很好地缓解疼痛并提高生活质量,同时围术期对血流动力学干扰小,并发症发生率较开放手术明显降低[16-19]。术前充分评估患者心肺功能、血栓风险等,并请麻醉科协助评估麻醉及手术风险;术前在病房要练习俯卧位,评估患者俯卧时的状态并使患者适应术中体位,对于术前责任节段的判定也非常重要;对于神经根定位不清,影像学显示多节段椎管狭窄的患者,采取神经根阻滞以明确责任间隙,药物选择0.5%利多卡因2 ml,C型臂X光机透视下进行手术,以症状缓解70%以上为阳性标准[18]。封闭完成后即刻下地行走,判断阻滞试验效果;若临床判断与神经根阻滞结果不符,需间隔至少12 h后行其他节段神经根阻滞,有时两节段阻滞后均有不同程度缓解,判定责任节段为双节段时,手术分期进行。本研究中2例患者为经神经根阻滞术判定为L4~5、L5~S1两节段均为责任节段,1例分期行2节段手术,另1例患者行L4~5节段手术后症状部分缓解,患者对疗效满意,拒绝行二期L5~S1节段手术。
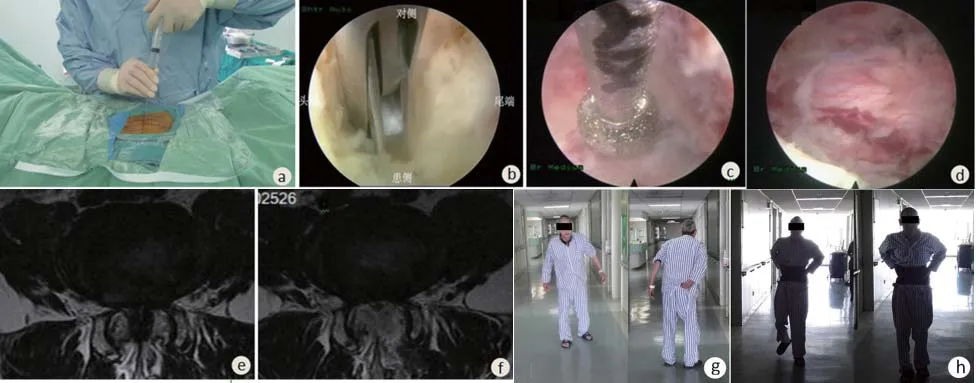
图2 椎板间入路脊柱内镜下椎管减压术Figure 2 Percutaneous endoscopic spinal decompression via a translaminar approach
本研究结果显示,术后6个月、1年腰VAS低于术后6周,术后6周、6个月、1年下肢VAS、ODI低于术前,术后1年ODI低于术后6周;提示经皮脊柱内镜对腰椎管狭窄症合并椎间盘突出的患者疗效最为确切,与既往的研究结果一致[20-22]。AHN等[19]报道45例接受经皮脊柱内镜治疗的患者,术前表现为间歇性跛行合并下肢放射痛,术后下肢疼痛缓解明显;原因可能为此类患者的致病因素为腰椎管退变、狭窄的基础上合并急性腰椎间盘突出,经皮脊柱内镜对椎间盘突出治疗经过了长期发展和临床验证,疗效确切[23]。术前ODI明显高于术后6周、6个月、1年,表明经皮脊柱内镜对腰椎管狭窄症的治疗有效,与相关报道结果相同[24]。这是因为经皮脊柱内镜下椎管减压术对黄韧带、骨赘等神经致压因素可做到很好的去除。本研究中患者腰痛症状的缓解较既往报道的文献较差[24-25],甚至部分患者腰痛症状会加重,考虑与术中为达到满意的减压效果,对关节突、后纵韧带等维持稳定性的结构造成了一定的破坏有关。由于老年患者腰痛原因多为小关节退变或者不稳所致,行椎管减压时需去除部分骨质,经椎间孔入路时需常规行椎间孔成形术,切除部分上关节突,容易引起本来已稳定的关节突关节的对合关系出现变化,造成腰痛症状加重。但是行椎管减压时切除了突出的椎间盘、增厚的纤维环及后纵韧带,对椎间盘源性腰痛起到缓解作用。本研究中1例患者术中因无法忍受颈痛而中止手术,但临床效果无影响。术中颈痛的发生可能与持续的硬膜外液体高灌注压有关[26],一般不会造成术后功能障碍。对于术后疼痛缓解不明显或疼痛加重的患者在除外椎间盘突出复发或其他有明确神经根受压的因素及感染后,可行经椎间孔神经根封闭术,此类情况一般与术后椎管内无菌性炎症刺激神经根有关,本研究中1例患者经硬膜外注射类固醇类激素和局麻药物后下肢疼痛明显缓解,3个月后症状消失;1例L5~S1行经椎间孔入路患者术后出现L5神经根受损表现,考虑因L5~S1椎间孔狭窄,操作时挤压出口神经根所致,因术中探查对神经根无器质性损伤,术后2个月恢复正常。
对于术中操作的要点,因老年人脊柱退变、侧弯、骨赘增生等原因造成穿刺及建立工作通道较困难,术前需在三维CT上精确设计穿刺路径。老年退变性腰椎管狭窄,经过长期的适应及再平衡,腰痛症状并不严重,所以椎间孔成形时在能够充分减压的基础上,尽量减小关节突的切除,避免脊柱的失衡,造成术后腰痛症状加重。严重腰椎管狭窄症患者,神经根及硬膜囊受压明显,镜下减压应自孔外开始,避免直接将工作通道置入椎管二次增压,造成医源性神经损伤;减压时对于各种致压因素应充分去除,患侧神经根腹侧的后纵韧带和纤维环也要彻底切除,增生的椎体后缘也要一并切除,对于盘内减压要尽可能多地去除松散的髓核,尤其是要多角度、多方向、大范围的切除,降低复发率。为避免椎间隙塌陷激发椎间孔狭窄压迫出口神经根,关节突尖及椎间孔韧带也要一并切除。
综上所述,脊柱内镜下椎管减压术是治疗高风险老年退行性腰椎管狭窄症的微创、安全、有效的方法,为无法耐受全麻下开放手术的患者提供了一种很好的替代手术方案。本研究是观察性临床回顾性研究,缺乏对照组。需要进一步进行前瞻、随机、对照研究及长期随访来证实该手术的疗效及安全性。
作者贡献:高尚聚进行研究设计与实施、资料收集整理、撰写论文并对文章负责;张隆、魏景超、曹参进行研究实施、评估、资料收集;李文毅进行质量控制及审校。
本文无利益冲突。

