培养条件对奇异变形杆菌生物膜生长的影响
张晓婷,邓一秒,董冬丽,杜文琪,吴希阳,唐书泽
(暨南大学理工学院食品科学与工程系,广东广州 510632)
奇异变形杆菌(Proteusmirabilis,P.mirabilis)属于肠杆菌科,变形杆菌属,是一类无荚膜、无芽孢、兼性厌氧性革兰氏阴性细菌。变形杆菌为条件致病菌,包含8类菌种,人类52.0%~76.9%的变形杆菌病由P.mirabilis引发[1]。P.mirabilis是尿路系统最常见病原菌,大部分泌尿道感染(Urinary tract infection,UTI)是由于胃肠道P.mirabilis繁殖引起的,另一些是由于人与人之间的传播[2]。P.mirabilis在健康人肠道带菌率为1.3%~10.4%[3],其广泛分布于自然界、动物粪便、人和动物肠道中,易污染动物性食物,特别是熟肉以及内脏的熟制品,引发细菌性食物中毒。常见主要发病类型有感染型急性胃肠炎、毒素型急性胃肠炎、过敏型组胺中毒三种[4],占食源性细菌性疾病比重较大,并呈逐年上升趋势。根据我国公布的细菌性食物中毒病原谱,P.mirabilis中毒仅次于副溶血弧菌、沙门氏菌和金黄色葡萄球菌,成为引起食物中毒的第四大主要病原菌[5]。越来越多的研究表明,单纯由浮游菌引起的细菌中毒并不常见,据美国国家健康研究所和疾控中心报道,世界上65%的微生物疾病都与细菌生物膜相关[6]。
生物膜由浮游菌粘附在固体介质表面,被细菌群体自身分泌的胞外多聚物(Extracellular polymeric substances,EPS)和表面蛋白质等基质包裹。生物膜的形态结构、生物学特性、致病性以及对环境因子的敏感性都与浮游菌存在显著差异[7-8]。生物膜的耐药性是浮游菌的1000多倍,由于菌群中的特殊亚群——持留菌的存在,成熟后的生物膜由于外部流体剪切力增强和内部因素如内源性酶降解、EPS或表面结合蛋白的释放[9],浮游菌可再次进入生物膜循环,成为新的污染源[10]。生物膜中含有的持留菌对环境如干燥、紫外线、杀菌剂、消毒剂等具有更强的抗逆能力,因而更难被杀灭,增加食品安全隐患和消费者健康风险[11]。
近年来,有关P.mirabilis的研究主要集中在由浮游菌导致的食物中毒的毒力因子及其致病机制[12]。生物膜的研究主要集中于医疗,尤其是UTI中生物膜防控和耐药性研究报道较多,有关食品生产加工过程中环境因素对生物膜形成的影响,尤其是细菌粘附材料对生物膜形成的影响少有报道。本文通过建立P.mirabilis生物膜体外模型,研究不同培养条件对P.mirabilis生物膜形成的影响,以期为食品生产加工过中可能出现的变形杆菌污染提供防控技术支撑,降低食品安全风险。
1 材料与方法
1.1 材料与仪器
奇异变形杆菌CMCC49005 广州市疾病预防控制中心;LB肉汤培养基、LB琼脂培养基 广东环凯微生物科技有限公司;结晶紫 Sigma;体积分数10%甲醇、33%冰乙酸 天津市科密欧化学试剂有限公司;硼酸、蔗糖、葡萄糖、麦芽糖 天津市大茂化学试剂厂;低聚果糖 源叶生物;氢氧化钠、盐酸、氯化钠 广州化学试剂厂;pH=7.4无菌磷酸盐缓冲溶液(Phosphate buffer solutions,PBS) 博士德生物工程有限公司。
多功能酶标仪(Infiniti M200pro,Switzerland) 帝肯贸易有限公司;6/96孔细胞培养板(Costar) 上海田源生物技术有限公司;盖玻片(玻璃材质,20 mm×20 mm) 广州健阳生物技术有限公司;2.5 L密封培养罐、三菱原装MGC 2.5 L CO2产气袋 广州美其实验设备科技有限公司;硅胶片(食品级,20 mm×20 mm) 上海杰炎橡塑五金经营部;聚丙烯(PP,20 mm×20 mm) 深圳市同兴泰五金材料有限公司;实木片(20 mm×20 mm) 德清美伦装饰材料有限公司;智能数字超声仪器(KQ-350D) 东莞市科桥超声波设备有限公司;涡旋振荡仪(QL-901) 海门其林贝尔仪器制造公司;离心机(QL-901) 科大创新股份有限公司;恒温培养箱(YCE-2000) 上海实验仪器厂有限公司;扫描电子显微镜(LSM700) 德国Zeiss。
1.2 实验方法
1.2.1 菌悬液制备 准确挑取单菌落进行传代培养,后取单菌落接种于5 mL LB肉汤中,37 ℃、160 r/min震荡培养14 h至生长稳定期,1075×g离心10 min后弃上清,5 mL PBS冲洗2次,最后悬浮于5 mL PBS中,调整其最终OD600=0.5(约108CFU/mL)用于后续实验,剩余菌悬液置于4 ℃冰箱中储存备用。
1.2.2P.mirabilis生物膜形成与测定 采用结晶紫染色法定量生物膜:在96孔细胞培养板中加入190 μL LB肉汤,再接种10 μL菌悬液混匀,以200 μL LB肉汤作为无菌对照,37 ℃培养24 h后,吸管缓慢吸出孔中培养物,每孔用250 μL无菌PBS清洗3次以除去所有浮游菌。自然风干后每孔加入200 μL 10%甲醇固定15 min后吸出甲醇,自然风干后每孔加入200 μL 0.1%结晶紫溶液,染色10 min后吸出结晶紫染色液,用无菌PBS把多余的染料冲洗3~5次至溶液呈无色,完全风干后,每孔加入160 μL 33%冰乙酸溶液[13],振荡器振摇5 min以溶解结晶紫并测定培养孔中溶液的OD570值,每组设置3个平行,试验重复3次,结果为实验组平均值与对照值之差。
1.2.3 初始菌浓度对P.mirabilis生物膜成膜的影响 配置初始浓度108、107、106、105、104、103、102、101CFU/mL的菌悬液,在96孔细胞培养板中加入190 μL的LB肉汤(pH=7.0±0.2;葡萄糖质量分数0.10%;NaCl质量分数0.50%),再接种10 μL不同浓度的菌悬液混匀,以200 μL LB肉汤作为无菌对照,在37 ℃,有氧状态下培养24 h,按照1.2.2的方法测定OD570值,每组设置3个平行,试验重复3次,结果为实验组平均值与对照值之差。
1.2.4 培养环境对P.mirabilis生物膜成膜的影响
1.2.4.1 培养温度和时间对P.mirabilis生物膜成膜的影响 在96孔板中加入10 μL 1.2.1制备的菌悬液后加入190 μL LB肉汤(pH=7.0±0.2;葡萄糖质量分数0.10%;NaCl质量分数0.50%),以200 μL LB肉汤作为无菌对照,在4、13、25、37、42 ℃,有氧状态下培养4、8、12、24、36、48、60 h。按照1.2.2的方法测定OD570值,每组设置3个平行,试验重复3次,结果为实验组平均值与对照值之差。
1.2.4.2 气体环境和时间对P.mirabilis生物膜成膜的影响 在96孔板中加入10 μL 1.2.1制备的菌悬液后加入190 μL LB肉汤(pH=7.0±0.2;葡萄糖质量分数0.10%;NaCl质量分数0.50%),将CO2产气袋置于密封培养灌内制造无氧环境,将96孔板分别置于有氧和无氧状态下,37 ℃下培养4、8、12、24、36、48、60 h。按照1.2.2的方法测定OD570值,每组设置3个平行,试验重复3次,结果为实验组平均值与对照值之差。
1.2.5 培养基对P.mirabilis生物膜成膜的影响
1.2.5.1 pH对P.mirabilis生物膜成膜的影响 用体积分数为10% HCl和质量分数为10% NaOH调节配置pH3.0、5.0、6.0、6.5、7.0、7.5、8.0、9.0、11.0的LB肉汤(葡萄糖质量分数0.10%;NaCl质量分数0.50%),121 ℃高压灭菌15 min,在96孔板中加入10 μL 1.2.1制备的菌悬液后加入190 μL不同pH的LB肉汤,以200 μL LB肉汤作为无菌对照,在37 ℃,有氧状态下培养24 h,按照1.2.2的方法测定OD570值,每组设置3个平行,试验重复3次,结果为实验组平均值与对照值之差。
1.2.5.2 NaCl含量对P.mirabilis生物膜成膜的影响 向LB肉汤中添加NaCl至质量分数为0.50、0.75、1.0、1.5、2.0、3.0、5.0、7.0、10.0%,121 ℃高压灭菌15 min,在96孔板中加入10 μL 1.2.1制备的菌悬液后加入190 μL不同盐浓度的LB肉汤(pH=7.0±0.2;葡萄糖质量分数0.10%),以200 μL LB肉汤作为无菌对照,在37 ℃,有氧状态下培养24 h,按照1.2.2的方法测定OD570值,每组设置3个平行,试验重复3次,结果为实验组平均值与对照值之差。
1.2.5.3 碳源种类和浓度对P.mirabilis生物膜成膜的影响 向LB肉汤中添加葡萄糖、蔗糖、麦芽糖、低聚果糖至质量分数为0.2%、0.5%、1.0%、2.0%、5.0%,121 ℃高压灭菌15 min,在96孔板中加入10 μL 1.2.1制备的菌悬液后加入190 μL LB肉汤(pH=7.0±0.2;NaCl质量分数0.50%),以200 μL LB肉汤作为无菌对照,在37 ℃,有氧状态下培养24 h,按照1.2.2的方法测定OD值,每组设置3个平行,试验重复3次,结果为实验组平均值与对照值之差。
2016年笔者采用培训结束时,安排现场提问的环节,获得比较好的反响。并且大概了解了本科学历以上的员工基本都使用过类似的数据库检索和下载文章,大专学历的员工相对不太熟悉,而这部分员工大部分是临床护理人员,平时工作比较繁忙,因此,大专学历的员工是笔者重要的服务对象,可以在授课之前先了解这部分员工的数量。
1.2.5.4 培养基用量对P.mirabilis生物膜成膜的影响 配置用量减半、正常和双倍的LB肉汤培养基,121 ℃高压灭菌15 min,在96孔板中加入10 μL 1.2.1制备的菌悬液后加入190 μL LB肉汤,以200 μL正常浓度LB肉汤作为无菌对照,在37 ℃,有氧状态下培养24 h,按照1.2.2的方法测定OD值,每组设置3个平行,试验重复3次,结果为实验组平均值与对照值之差。
1.2.6 接触材料对生物膜成膜的影响
1.2.6.1 接触材料前处理 将盖玻片、6孔板、96孔板在75%的乙醇中浸泡24 h后在超净工作台中晾干,紫外杀菌30 min。硅胶、PP、木片首先在40 kHz超声下处理30 min,然后在甲醇中浸泡30 min,121 ℃高压灭菌15 min,在超净工作台中晾干,紫外杀菌30 min[14]。
1.2.6.2 载体表面P.mirabilis生物膜内活菌计数 将前处理后的4种不同载体置于6孔板中,每孔加入200 μL菌悬液,再加入5 mL LB肉汤,对照组只加5 mL LB肉汤,在37 ℃,有氧状态下培养24、48、72 h。将长有生物膜的薄片经无菌PBS漂洗5次,将薄片放入装有10 mL含有玻璃珠的无菌PBS中,40 kHz超声10 min后1200 r/min涡旋振荡2 min至生物膜完全洗脱,取100 μL菌液进行10倍系列梯度稀释,选取3个合适梯度菌液置于平板中,注入约15 mL添加0.1%硼酸的LB琼脂培养基[15],37 ℃恒温培养箱内培养24 h后进行活菌计数,每个稀释梯度设置3个平行,试验重复3次,结果为实验组平均值与对照值之差。
1.2.6.3 扫描电镜观察P.mirabilis生物膜结构 将前处理后的4种不同载体置于6孔板中,每孔加入200 μL菌悬液,再加入5 mL LB肉汤,在37 ℃,有氧状态下培养24 h。经过24 h培养后将长有生物膜的薄片置于新的6孔板中,用无菌PBS冲洗除去浮游菌,2.5%的戊二醛固定样品4 h,PBS冲洗后依次用30%、50%、70%、80%、100%乙醇梯度对样品进行脱水,每个梯度15 min,进行CO2临界点干燥,喷金,置于扫描电镜(Scanning electron microscope,SEM)下进行观察、拍照[16]。
1.3 数据处理
实验重复三次,并采用SPSS 21.0软件对数据进行统计学分析,结果用平均值±标准差表示,方差分析采用ANOVA分析各实验组间、组内的显著性差异,P<0.05 表明有显著性差异;采用Origin 9.1软件作图。
2 结果与分析
2.1 初始菌浓度对P. mirabilis生物膜成膜的影响

图1 初始菌浓度对奇异变形杆菌生物膜形成的影响Fig.1 Effects of initial bacterial concentrationon biofilm formation of P. mirabilis注:不同小写字母表示具有显著性差异(P<0.05),图4~图5同。
2.2 培养温度和气体环境对P. mirabilis生物膜成膜的影响
2.2.1 培养温度和时间对P.mirabilis生物膜成膜的影响 不同培养温度和时间,P.mirabilis生物膜形成量表现出较大的变化,温度不仅可以影响细菌的生理状态,还可以影响生物膜成分的物理性质[10]。图2显示,在25~37 ℃范围内,生物膜的形成条件适宜,37 ℃生物膜形成量最高,4 h完成初粘附,4~8 h即可完成粘附,8~24 h形成成熟、稳定的生物膜,之后生物膜脱落,P.mirabilis进入下一个生长周期。喻华英等[18]通过研究大肠杆菌生物膜生长曲线指出,由于营养物质有限,代谢物质累积,浮游菌进入一种类芽孢状态,下一个生长周期的生物膜峰值与第一个相比降低。在4、13、42 ℃下,生物膜量呈缓慢递增趋势,温度会影响酶活,细菌营养代谢依赖酶的活性,远离最佳生长温度使细菌代谢活力降低,进而使生物膜生长周期变长[19]。

图2 不同温度下P. mirabilis生物膜形成量的光密度值随时间的变化Fig.2 Changes of optical density value of P. mirabilisbiofilm formation at different temperatures with time
2.2.2 气体环境和时间对P.mirabilis生物膜成膜的影响P.mirabilis是一种兼性厌氧菌,其在有氧和无氧状态下均能繁殖[20]。氧气可用性决定细菌能量产生,减少氧气会导致细菌生长缓慢[21],因此气体环境对生物膜形成具有潜在影响。图3表明,氧气充分条件下,24 h生物膜量达到峰值,完成第一个生长周期,在无氧环境下P.mirabilis生物膜生长缓慢,36 h还未完成粘附,不利于生物膜生长和成熟。因此P.mirabilis生物膜形成能力显著依赖于氧气含量。
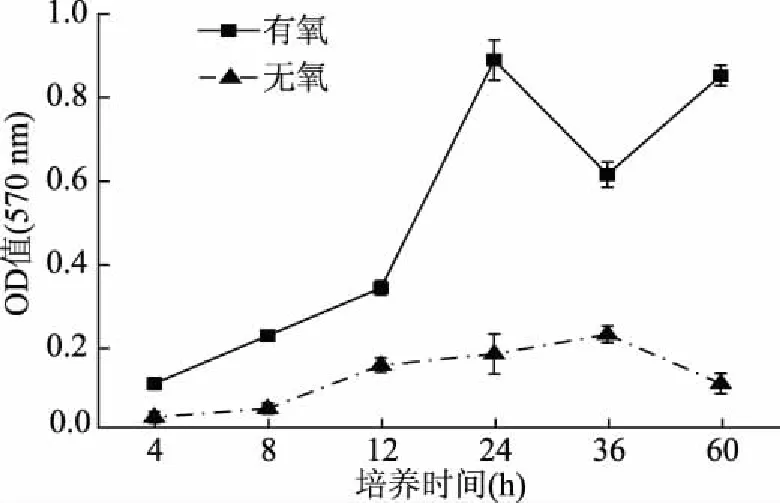
图3 不同气体环境下P. mirabilis生物膜形成量的光密度值随时间的变化Fig.3 Changes of optical density value of P. mirabilisbiofilm formation at aerobic and anaerobic conditions with time
2.3 培养基成分对P. mirabilis生物膜成膜的影响
2.3.1 pH对P.mirabilis生物膜成膜的影响 酸碱条件下会改变生物膜的物理化学性质并影响细菌粘附的基因表达[22]。初始pH3.0~5.0强酸性环境不利于细菌的生长,P.mirabilis很难形成生物膜(见图4)。裴标等[23]研究发现P.mirabilis在pH8.0~10.0的碱性蛋白胨水中生长良好,表明该菌具有嗜碱性,本实验证明P.mirabilis在pH8.0时生物膜量最大,pH11.0时,P.mirabilis仍能形成一定量的生物膜,进一步表明P.mirabilis是一种尿液病原体,在碱性导尿管表面易形成生物膜[10]。

图4 初始培养基pH对P. mirabilis生物膜形成的影响Fig.4 Effects of medium initial pHon P. mirabilis biofilm formation
2.3.2 NaCl含量对P.mirabilis生物膜成膜的影响P.mirabilis属于耐盐菌,在1.0%~10.0%的NaCl的溶液中均能生长[24]。图5显示,菌膜量随NaCl浓度增加而增大,NaCl质量分数2.0%对生物膜形成具有很强的促进作用,为原LB肉汤(NaCl质量分数0.50%)的1.24倍。NaCl质量分数超过2.0%后,菌膜量不断下降,NaCl质量分数10%几乎不产生生物膜。

图5 初始盐浓度对P. mirabilis生物膜形成的影响Fig.5 Effects of medium initial salinityon P. mirabilis biofilm formation
2.3.3 碳源种类和浓度对P.mirabilis生物膜成膜的影响 碳源种类和浓度均对生物膜的形成有显著影响(P<0.05)(图6)。在LB肉汤中添加质量分数为0.2%~1.0%麦芽糖对生物膜生长有明显的促进作用,麦芽糖质量分数为1.0%时达到生物膜量峰值;向原LB肉汤(葡萄糖质量分数0.10%)中添加葡萄糖、蔗糖和低聚果糖的质量分数超过0.20%,麦芽糖质量分数超过1.0%对生物膜形成量有抑制作用,抑制作用随添加量的增加而增加,抑制顺序从大到小依次为:低聚果糖>葡萄糖>蔗糖>麦芽糖。
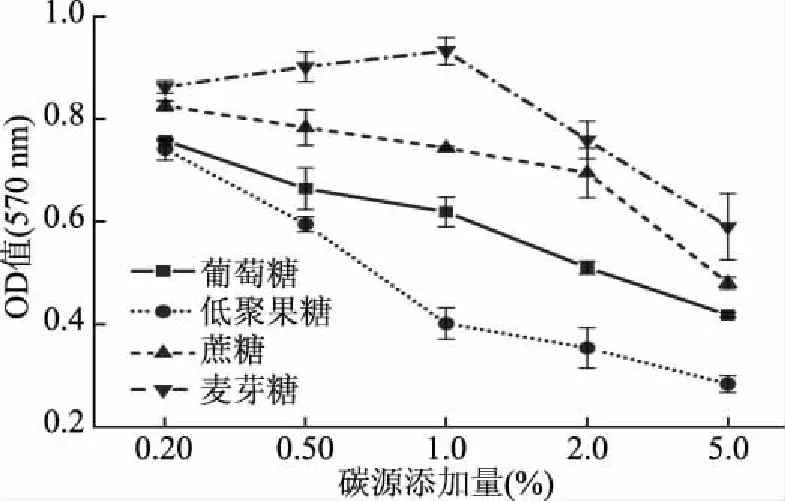
图6 碳源种类和浓度对P. mirabilis生物膜形成的影响Fig.6 Effects of carbon source type and concentrationon P. mirabilis biofilm formation
2.3.4 培养基用量对P.mirabilis生物膜成膜的影响 LB肉汤培养基用量对生物膜的形成影响显著(图7)。正常培养基营养物质含量(蛋白质质量分数1.0%;NaCl质量分数0.50%;葡萄糖质量分数0.10%;酵母膏质量分数0.50%)和培养基用量加倍,生物膜量均在24 h达到峰值,用量加倍的培养基生物膜量显著高于另外两组(P<0.05),说明P.mirabilis在富营养环境下更有利于生物膜生成,培养基用量减半的生物膜形成速率降低,生长周期延长,生物膜形成能力减弱。
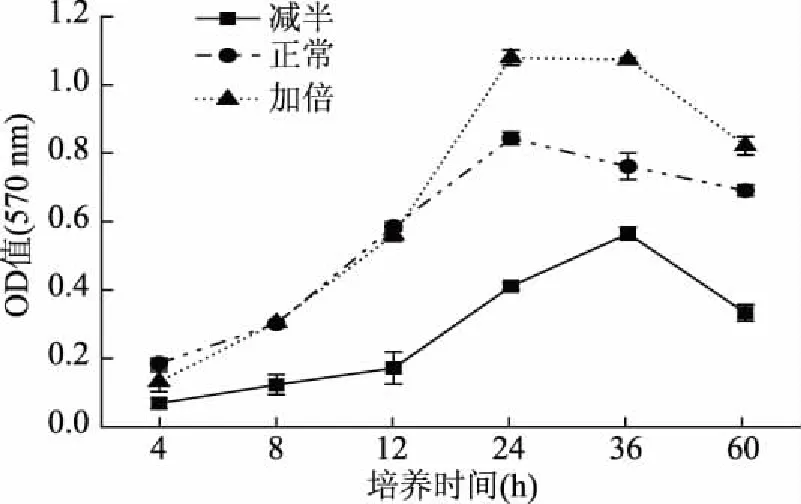
图7 培养基用量对P. mirabilis生物膜形成的影响Fig.7 Effects of medium dosageon P. mirabilis biofilm formation
2.4 接触材料对P. mirabilis生物膜的影响
2.4.1 对P.mirabilis生物膜内活菌数的影响 不同的接触材料在不同的培养时间下对生物膜内活菌数具有显著影响(P<0.05)(图8)。自然环境下调控生物膜形成方法之一是改变材料表面特征。有研究表明,通过研究特殊材料或对材料表面进行物理化学修饰可控制生物膜形成过程[25]。PP、木片、硅胶、玻璃是食品加工设备和器具中常用的原材料,图8反应了在其他条件相同条件下,分别培养24、48、72 h后,通过平板计数法测得4种不同材料表面上的生物膜内的活菌数目。24 h后,4种材料表面形成的生物膜内活菌数差异显著,其中木片粘附的菌体数目最多,硅胶次之,盖玻片和PP较少。菌体在木片、硅胶和盖玻片上培养24 h之后生物膜活菌总量递减,而菌体在PP片培养48 h后才形成较多生物膜,48 h后生物膜量降低。在生物膜形成的初始粘附阶段,接触材料表面的电荷性、亲疏水性及表面粗糙度都会直接影响微生物的附着、固定。Hyde等[26]研究发现疏水性表面的细菌粘附及生物膜成熟速度比亲水性表面要慢,因此P.mirabilis更易在亲水性材料表面附着,玻璃、硅胶、木材都为亲水表面,PP为疏水表面。在正常环境下,微生物表面为负电荷,更易附着在带正电荷的材料表面,材料的粗糙度,表面的缝隙、凸起都会影响细菌的粘附[27]。

图8 接触材料对P. mirabilis生物膜形成的影响Fig.8 Effects of contact materialson P. mirabilis biofilm formation注:不同大写字母代表相同培养时间下不同材料之间具有显著性差异(P<0.05);不同小写字母表示同种材料不同培养时间具有显著性差异(P<0.05)。
2.4.2P.mirabilis生物膜SEM结构观察 图9为P.mirabilis经过24 h培养在木片、PP片、硅胶、盖玻片4种不同食品接触材料下形成的生物膜扫描电镜显微结构图。从图中可见,木片表面粗糙且不均匀,有明显的孔隙、沟壑(图9a)。在木片上聚集的菌体在整个区域生长,菌体之间通过大量的卷曲菌毛粘连在一起,细菌鞭毛、菌毛和菌毛的附属物克服电双层的物理排斥力,可以巩固细菌-基质结合[19],在细胞外聚集形成广泛的无定形基质,参与生物膜的发育[28]。PP片表面平整,有明显的裂纹和深浅不一的孔隙,菌体在空隙内菌体数量偏多,分泌的细胞外基质少,24 h内未形成稳定生物膜结构(图9b)。硅胶片表面平整,有较多沟纹,无明显孔隙,硅胶片上形成蘑菇状生物膜结构,菌体被EPS包裹,集中在沟壑较深的部位(图9c)。玻璃材质的盖玻片最为光滑,无明显沟纹,几乎看不到孔隙,盖玻片上的菌体连接在一起,生物膜被EPS包裹紧密,结构呈扁平状(图9d)。P.mirabilis生物膜结构有蘑菇状和扁平状两种,其不仅受碳源种类和培养基种类的影响[29],也受接触材料的影响。

图9 不同接触材料表面形成P. mirabilis生物膜的SEM图Fig.9 SEM images of P. mirabilis biofilm formedon the surface of different contact materials
3 结论
本文研究表明,奇异变形杆菌(Proteusmirabilis)容易形成抗性较强的生物膜。初始菌浓度很低(10 CFU/cm2)时,经过一定时间培养也能成膜。培养基营养组成、用量、环境条件以及接触表面材料特性对P.mirabilis生物膜形成具有显著影响。P.mirabilis形成生物膜的最适环境:温度37 ℃、有氧状态下培养24 h;最适培养基组成:pH8.0、NaCl质量分数2.0%、麦芽糖质量分数1.0%;在富营养环境和粗糙的木片上P.mirabilis更易成膜。食品加工过程中综合运用这些条件,通过远离最适培养环境,调控营养组分并避免富营养环境的形成,选择合适的接触材料,有可能达到预防和控制P.mirabilis生物膜形成的目的,从而确保加工食品的生物安全性。

