FOLFOXIRI改良方案一线治疗晚期胃癌疗效及安全性分析
姜志超 张雯 孙永琨 杨林 崔成旭 周爱萍
胃癌是全球最常见的恶性肿瘤之一[1]。最新数据显示在中国胃癌发病率居第2 位,死亡率居第3位[2-3]。同时,中国胃癌患者初诊分期晚,约80%以上属于进展期或转移性患者。化疗是晚期胃癌的重要治疗手段,铂类联合氟尿嘧啶是晚期胃癌化疗的基本方案,而在此基础上联合紫衫类药物可进一步提高疗效[4]。
伊立替康是晚期胃癌标准二线治疗药物,在一线治疗中应用较少。小样本的Ⅱ期研究结果表明,FOLFOXIRI(奥沙利铂、氟尿嘧啶联合伊立替康)的三药方案一线治疗晚期胃癌的初步疗效较好,值得进一步深入研究。FOLFOXIRI三药方案在早期研究中伊立替康剂量强度为90 mg/m2/周,治疗晚期结直肠癌疗效优于两药方案,但不良反应突出,3/4级中性粒细胞减少发生率高达59%,腹泻30%[5]。近年来一些研究中,降低伊立替康剂量强度(60~75 mg/m2/周)的FOLFOXIRI方案在晚期结直肠癌一线及维持治疗中也取得了良好的疗效,且降低了不良反应[6-7]。而在小细胞肺癌的化疗中伊立替康剂量强度仅为40~45 mg/m2/周。鉴于胃癌患者营养状态及化疗耐受性差等特点,本研究尝试应用降低伊立替康剂量强度至120 mg/m2的FOLFOXIRI改良方案一线治疗晚期胃癌,探索其疗效和安全性。
1 材料与方法
1.1 一般资料
选取2016 年7 月至2019 年3 月于中国医学科学院肿瘤医院采用改良FOLFOXIRI方案一线治疗的晚期胃癌20 例。纳入标准:1)年龄≥18 岁;2)病理或细胞学证实为腺癌;3)人表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)阴性:免疫组织化学阴性、1+或2+且FISH 检测HER2 无扩增;4)既往未接受过化疗的晚期或转移性胃癌患者,新辅助化疗或术后辅助化疗结束6 个月以上复发的胃癌患者;5)根据RECIST 1.1标准,至少有一个可测量病灶。排除标准:1)其他类型胃癌,如鳞癌、神经内分泌癌;2)治疗前5 年内曾患其他恶性肿瘤,以根治为目的进行治疗的宫颈原位癌、皮肤鳞状或基底细胞癌除外;3)尿苷二磷酸葡糖醛酰转移酶1A1(UDPglucuronosyltransferase 1A1,UGT1A1)UGT1A1*28 纯和变异型及UGT1A1*6纯和变异型。
1.2 方法
1.2.1 治疗方案 FOLFOXIRI 改良方案:奥沙利铂85 mg/m2静点d1,伊立替康120 mg/m2静点d1,亚叶酸钙200 mg/m2静点d1,氟尿嘧啶2 400 mg/m2持续静点44 h,每14天为1个周期。
1.2.2 疗效及安全性评价 基线及每3 个周期进行一次影像学检查,包括CT、MRI 等,用于疗效评价。疗效评价参照RECIST 1.1 标准。主要终点为客观缓解率(objective response rate,ORR)。次要终点包括无进展生存时间(progression-free survival,PFS)、总生存时间(overall survival,OS)、疾病控制率(disease control rate,DCR)、缓解持续时间(duration of re⁃sponse,DOR)及安全性。PFS定义为入组至疾病进展或死亡的时间。OS定义为入组至死亡的时间。DOR定义为肿瘤缓解至进展或死亡的时间。不良反应根据NCI-CTCAE 4.0标准进行评估。
1.2.3 随访 通过电话及来院访视进行生存及安全性随访,末次随访为2020年2月7日。
采用SPSS 20版软件进行统计学分析。采用Ka⁃plan-Meier 分析法计算两组的PFS 和OS,采用Log-Rank法检验两组之间的差异。安全性分析以描述性统计分析为主,列表描述本次试验所发生的不良事件。以P<0.05为差异具有统计学意义。
2 结果
2.1 临床特征
20例患者中,男性16例,女性4例。中位年龄50.5(28~65)岁。20例患者原发灶均未切除,转移部位以腹膜后淋巴结和锁骨上淋巴结等远处淋巴结、肝脏、腹膜、网膜转移常见。病理低分化占80%。20例患者接受了UGT1A1检测。12例(60%)为野生型,5例(25%)为UGT1A1*1/*6 单位点杂合变异型,2 例(10%)为UGT1A1*1/*28单位点杂合变异型,1例(5%)为双位点杂和变异型(表1)。
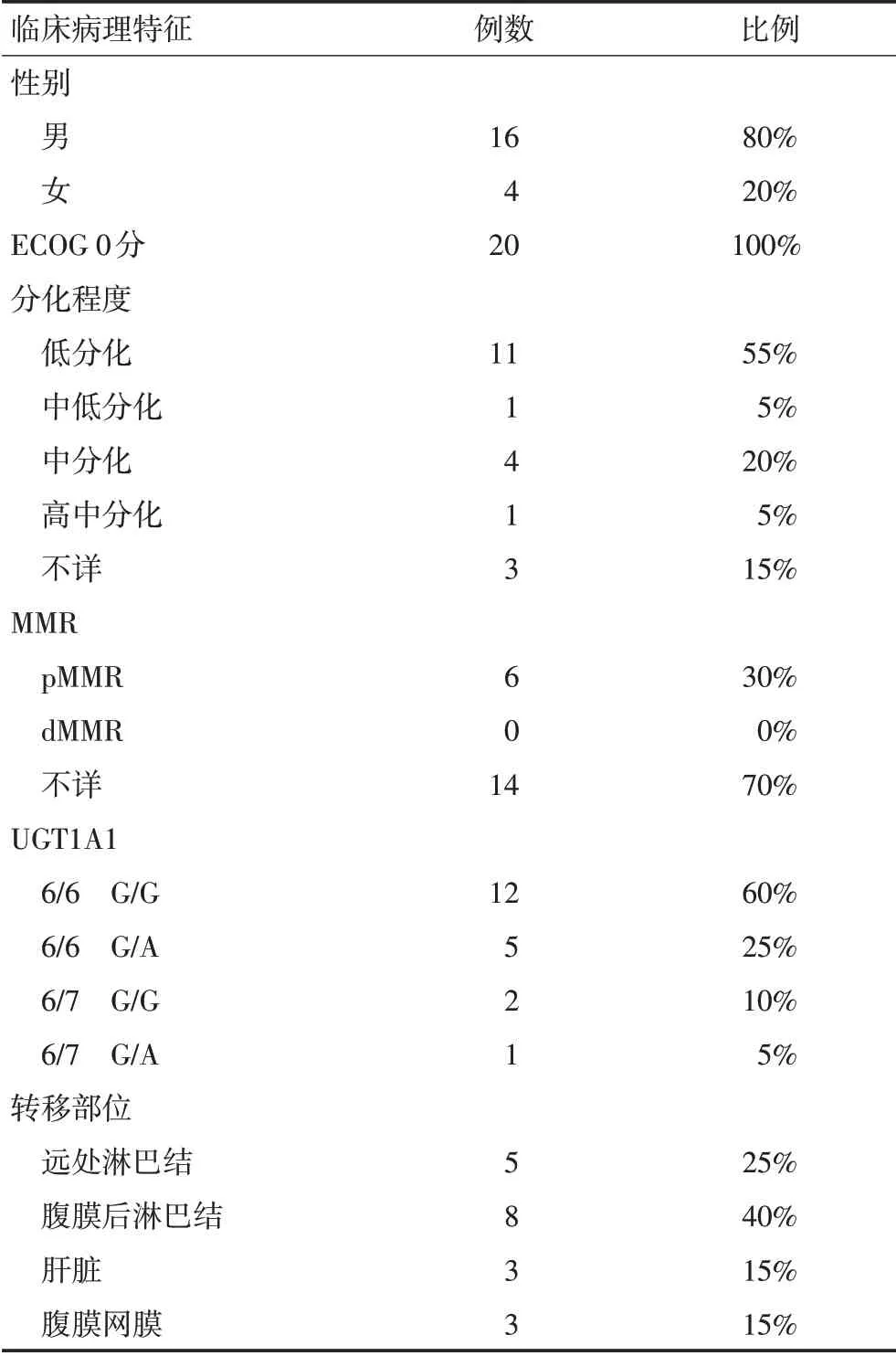
表1 20例患者临床病理特征
2.2 疗效及生存情况
中位随访时间为19.5个月。10例部分缓解(par⁃tial response,PR),9例疾病稳定(stable disease,SD),1例疾病进展(progressive disease,PD),无完全缓解(complete response,CR)。ORR 为50%,DCR 为95%(表2)。10例PR 患者均在第1次评效时达到最佳疗效,中位起效时间为1.6 个月,中位DOR 为8.7 个月。中位PFS 为9.5 个月(95%CI:7.309~11.691)(图1),中位OS为19.9个月(95%CI:9.754~30.046)(图2)。

表2 疗效评价

图1 20例患者PFS情况

图2 20例患者OS情况
2.3 安全性
常见不良反应包括中性粒细胞减少、白细胞减少、肝功能异常、消化道反应、腹泻等(表3)。常见3级不良反应包括中性粒细胞减少(50%)、腹泻(10%)、ALT升高(10%)。未观察到4级及以上不良反应。中位治疗周期数为8个周期,80%患者完成了至少6个周期化疗,仅1例(5%)患者因出现3级不良反应减量。UGT1A1野生型与突变型患者,在白细胞减少、中性粒细胞减少及腹泻的发生上无显著性差异。
2.4 二线治疗情况
截至末次随访,共18 例患者出现进展。11 例(61.1%)接受了后续的全身抗肿瘤治疗:4例(22.2%)接受了含紫杉类药物的二线治疗,4 例(22.2%)入组本院紫杉醇联合CM082治疗晚期胃癌临床研究,1例(5.6%)接受伊立替康联合替吉奥化疗,1例(5.6%)接受阿帕替尼治疗,1 例(5.6%)具体化疗方案不详(外院治疗)。2 例(11.1%)局部进展后行放疗。4 例(22.2%)进展后未行抗肿瘤治疗。1例(5.6%)进展后治疗信息不详(患者拒绝告知)。
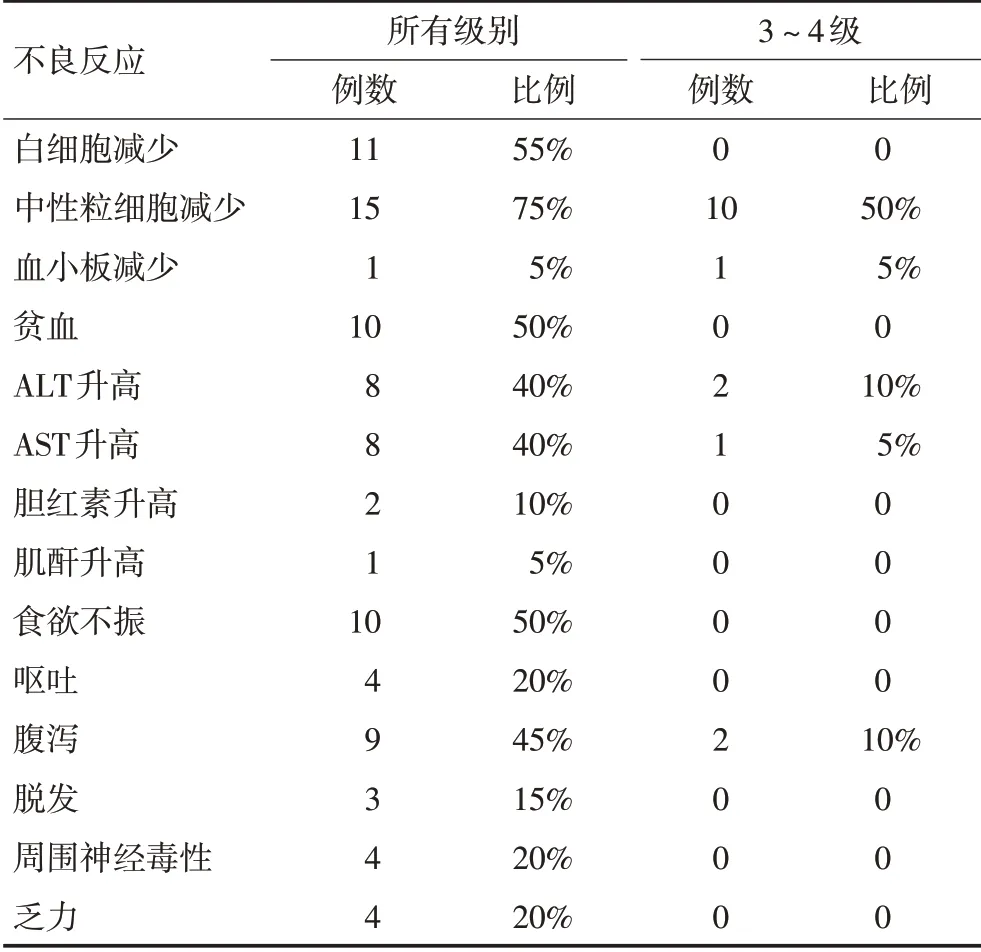
表3 不良反应
3 讨论
由于胃癌的复杂性及异质性,靶向药物的应用受到了一定限制,进展较缓慢。曲妥珠单抗虽可改善晚期胃癌患者生存,但胃癌HER2 阳性比例仅为15%~25%[8-9]。免疫检查点抑制剂虽在晚期胃癌后线治疗中取得一定进展,但一线联合化疗并未进一步提高疗效,微卫星高度不稳定者作为潜在获益人群仅占10%~20%[10],仍为少数。因此,化疗仍是目前晚期胃癌的主要治疗手段,优化方案是进一步提高疗效的重要途径。
本研究表明,FOLFOXIRI改良三药方案一线治疗晚期胃癌取得较好的疗效,ORR为50%,中位PFS 为9.5个月,中位OS达到了19.9个月。而临床常用的CF(顺铂、氟尿嘧啶)、SOX(奥沙利铂、替吉奥)、FOLFOX(奥沙利铂、氟尿嘧啶)、SP(顺铂、替吉奥)、XP(顺铂、卡培他滨)等含铂两药方案,ORR为25%~41%,PFS为3.7~5.7 个月,OS 仅为8.6~14.1 个月[11-15]。与之相比,FOLFOXIRI改良三药方案似乎显示出了更好的疗效。此外,在两项Ⅱ期研究中,FOLFOXIRI一线治疗晚期胃癌也取得了良好疗效,ORR分别为63.3%和66.7%,中位PFS分别为7.3个月和9.6个月,中位OS分别为11.9个月和14.8个月[16-17],上述两项研究中伊立替康剂量分别为165、150 mg/m2。
本研究还观察到FOLFOXIRI 改良方案起效较快,所有PR患者第一次评效时即达到最佳疗效,中位起效时间为1.6 个月。结果提示FOLFOXIRI 方案可能在胃癌新辅助治疗中具有潜在应用价值。
晚期胃癌患者常存在贫血、营养不良、消瘦等问题,因此往往对治疗耐受性差。本研究中,将伊立替康剂量进一步下调至了120 mg/m2,显示出了良好的耐受性。虽然与上述两项Ⅱ期研究相比,≥3 级中性粒细胞减少(分别为50%、48.9%、52.1%)发生率相当,但未观察到4 级中性粒细胞减少,显著低于上述研究。3 级腹泻发生率在各研究中比例相近。本研究治疗前进行UGT1A1基因检测,排除了双位点纯合变异型患者,在一定程度上降低了重度腹泻及粒细胞减少的风险,但研究样本量小,有待进一步扩大样本量验证。此外,上述两项Ⅱ期研究中约25.5%~31%的患者需进行减量[16-17],本研究中仅1 例患者进行了减量。本组病例的中位治疗周期达8个周期,持续治疗时间长与良好的安全性有关,可能也是OS 良好的原因之一。
综上所述,降低伊立替康剂量的FOLFOXIRI 改良方案一线治疗晚期胃癌,初步结果显示耐受性良好,疗效较好。该方案是否优于常用的FOLFOX、SOX、SP或XELOX等两药方案,仍需大量随机对照临床研究证实。

