铁含量测定的研究型教学实验设计与实践
王益林, 文辉忠, 舒 馨, 钟青梅, 邱子情, 黄晓霞
(广西大学化学化工学院,南宁530004)
0 引 言
研究型教学实验将科学研究的思维方法和技能融入实验教学中,具有综合性、研究性和应用性的特点,可培养学生的创新意识,提高学生运用理论知识和实验技能解决具体问题的综合能力[1-3]。目前,国内许多高校正陆续开设并完善研究型教学实验[4-6]。在基础分析化学实验中开设研究型教学实验,既能提高学生学习分析化学的兴趣、锻炼实践能力,也能培养学生的探索精神。为配合吸光光度法的教学,“邻二氮菲吸光光度法测定铁”是必做实验,学生对这一实验也很感兴趣。作为一种重要的微量元素,铁对人体健康有着较大的影响,缺铁会影响血红蛋白的合成,导致贫血症。枸杞[7]、当归[8]等中草药及黑木耳[9]、香菇[10]等食物中铁的含量较高,具有补铁功能。3,3′,5,5′-四甲基联苯胺(TMB)是一种安全而灵敏的还原型显色剂,本身无色,在辣根过氧化物酶(HRP)或金属离子(Cu2+、Fe3+)[11-13]的催化作用下,可被H2O2氧化生成最大吸收波长为652 nm 的蓝色电荷转移复合物。近年来,以TMB为显色剂测定过氧化苯甲酰[14]、Ag+[15]和ClO-[16]的研究也有报道。在文献调研的基础上,设计了利用Fe3+氧化TMB 发生显色反应测定实际样品中铁含量的研究型教学实验,内容包括实验条件的选择、方法分析性能的评估、分析样品的制备等完整的分析过程。该实验有助于学生巩固基础分析化学知识,了解科研工作的基本过程,培养学生的科研素养。
1 实验部分
1.1 实验原理
Ag+能将无色的TMB 氧化成蓝色的电荷转移复合物,Fe3+/Fe2+和Ag+/ Ag 两电对的标准电极电位接近,Fe3+显氧化性,也能使TMB氧化显色,当Fe3+的浓度在一定范围内时,溶液的吸光度与Fe3+的浓度关系服从比尔定律,可实现对Fe3+的含量进行测定。
1.2 主要试剂与仪器
NH4Fe(SO4)2·12H2O(广东光华科技股份有限公司);3,3′,5,5′-四甲基联苯胺(TMB,上海阿拉丁试剂有限公司);N,N-二甲基甲酰胺(DMF,国药集团化学试剂有限公司);冰醋酸(广东光华科技股份有限公司);无水乙酸钠(广东光华科技股份有限公司)。以DMF为溶剂配制1.0 mmol/L TMB 溶液;Fe3+标准溶液及其他溶液都以去离子水为溶剂配制。
UV-4802 紫外可见分光光度计(上海龙尼柯仪器有限公司);H1850 离心机(湖南湘仪实验室仪器开发有限司);DHG-9146A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司)。
1.3 实验方法
在系列10 mL 的比色管中,依次加入4. 0 mL HAc-NaAc(pH =3.50)缓冲溶液、1.0 mL 1.0 mmol/L TMB溶液、1.0 mL不同浓度的Fe3+标准溶液,用去离子水定容到刻度,充分混匀后在室温下反应25 min,用1 cm的比色皿在UV-4802 紫外可见分光光度计扫描其吸收光谱,并记录652 nm处的吸光度。
2 结果与讨论
2.1 机理探讨
采用饱和法对Fe3+与TMB 反应的计量关系进行了研究,初步探讨了TMB 的显色机理。实验时,固定Fe3+的浓度,改变TMB 的浓度,得到系列[TMB]/[Fe3+]比值不同的溶液,分别测其吸光度,并以吸光度为纵坐标、[TMB]/[Fe3+]为横坐标作图,如图1 所示。由图1 可见,当[TMB]/[Fe3+]的比值为2 时,在一定范围内继续增大TMB的浓度,体系的吸光度保持不变,由此认为TMB与Fe3+反应的计量比为2∶1。结合相关文献[16],推测TMB 与Fe3+可能的反应机理是在Fe3+的作用下,TMB被氧化成蓝色的电荷转移复合物(见图2)。

图1 吸光度A随[TMB]/[Fe3 +]的变化关系
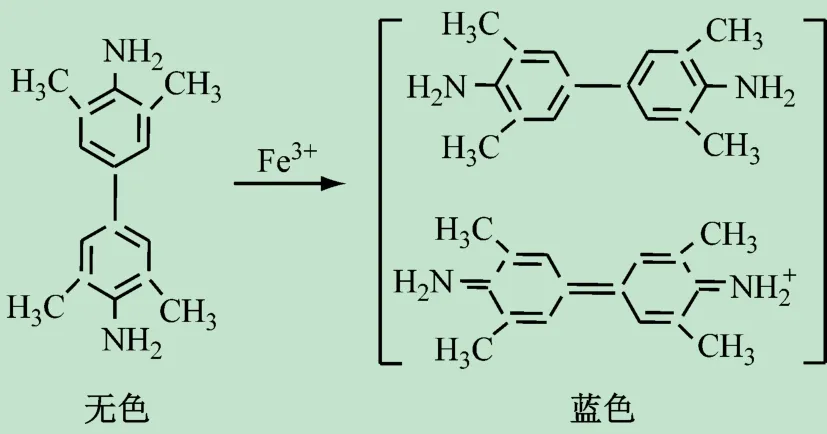
图2 TMB与Fe3 +可能的反应机理
2.2 测定条件的选择
TMB的显色反应一般在弱酸性条件下进行。实验在pH分别为3.0、3.5、4.0、4.5、5.0 和5.5 的HAc-NaAc缓冲溶液中,测定50 μmol/L Fe3+和100 μmol/L TMB反应25 min后的吸光度,以此确定发生显色反应的最佳pH。图3 数据表明,当pH =3.5 时,体系的吸光度值最大,因此,选择pH =3.5 的HAc-NaAc缓冲液为反应介质。
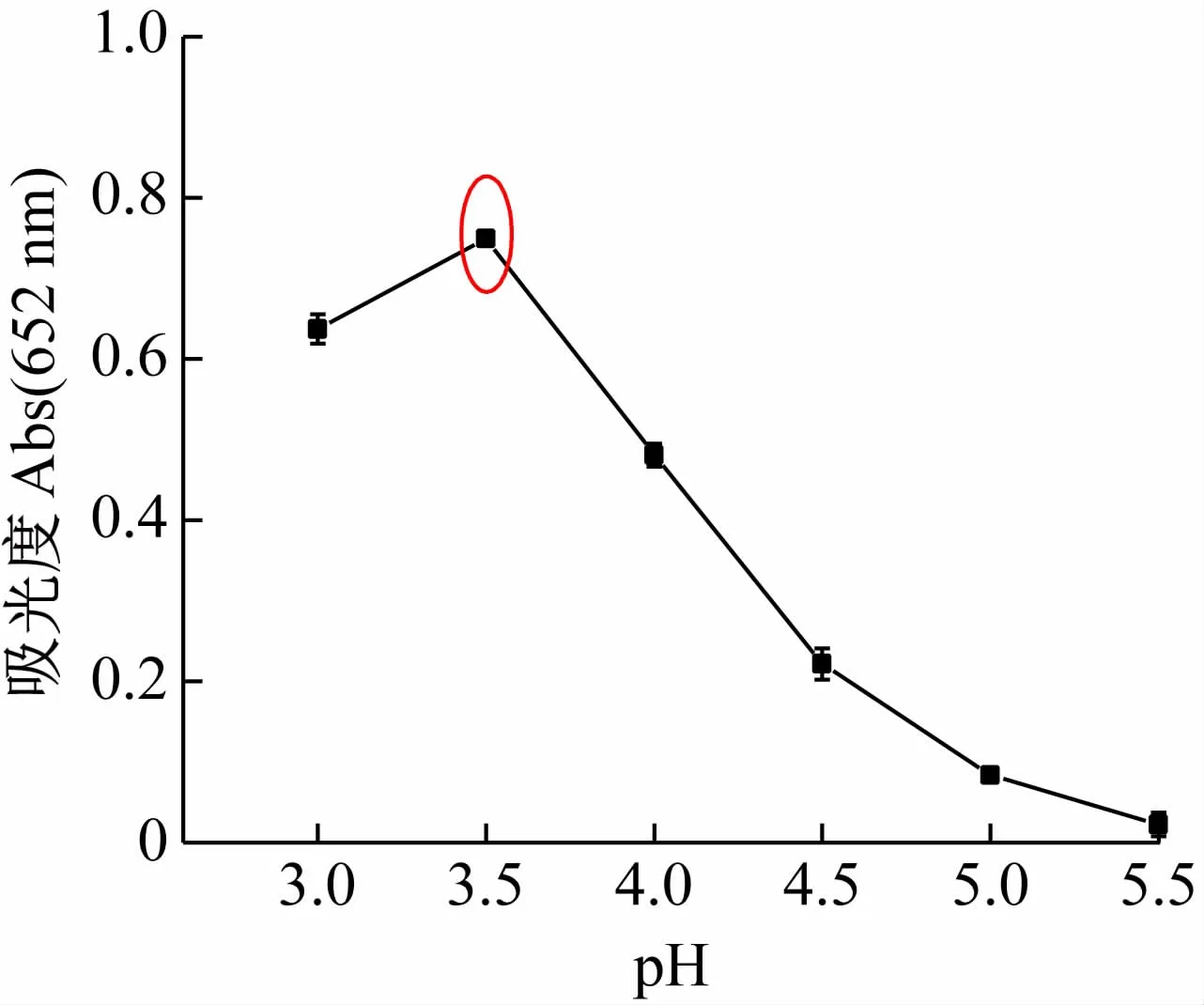
图3 pH对体系吸光度值的影响([Fe3 +]=50 μmol/L;[TMB]=100 μmol/L;25 min)
按实验方法,在pH =3.5 的HAc-NaAc 缓冲介质中,测定50 μmol/L Fe3+和100 μmol/L TMB的混合液在不同反应时间的吸光度并确定最佳显色时间。图4所示数据表明,开始阶段,溶液吸光度随时间的增加而增大,显色15 min 后继续延长时间,吸光度保持稳定不变,实验选择在常温下放置25 min后测吸光度。
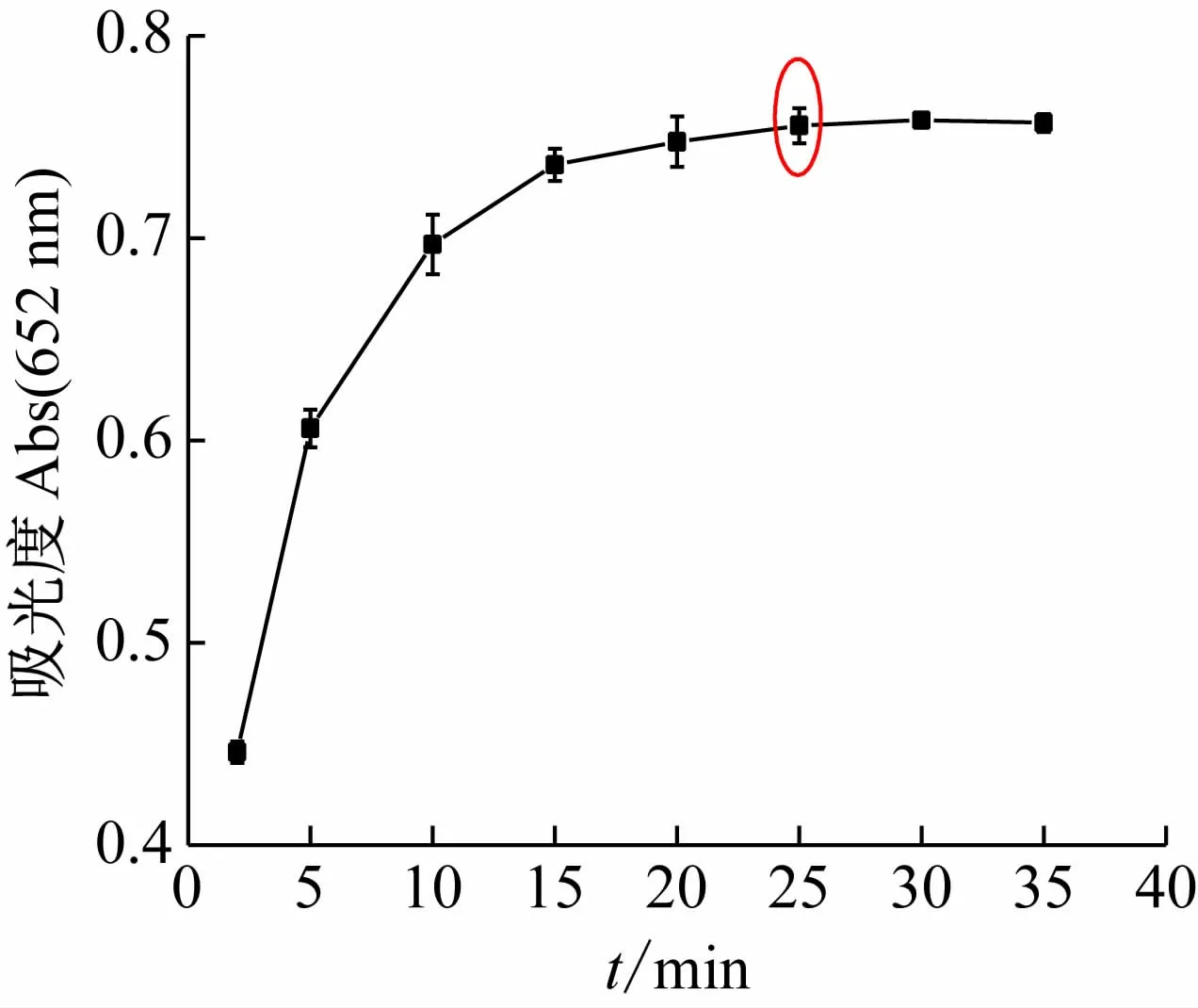
图4 反应时间对体系吸光度值的影响([Fe3 +]=50 μmol/L;[TMB]=100 μmol/L;pH =3.5)
2.3 方法的分析性能
当Fe3+离子浓度为50 μmol/L时,分别考察了浓度均为500 μmol/L的其他常见金属离子对检测信号的响应情况(见图5)。实验表明,K+、Ca2+、Mg2+、Zn2+、Cu2+等常见金属离子因不能使TMB氧化显色而没有信号响应,对Fe3+的测定没有干扰;但研究表明,等浓度的Ag+和Cr6+均产生干扰,不过一般植物样品中这2 种元素的含量极少,说明方法的选择性较好。
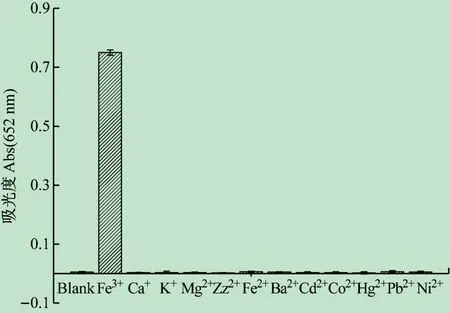
图5 本方法测定Fe3 +离子的选择性
按实验方法,测定TMB 在系列不同浓度Fe3+溶液中的吸收光谱。结果表明,溶液吸光度随Fe3+浓度的升高而增大(见图6),且Fe3+浓度在5 ~50 μmol/L范围内服从比尔定律(见图7),回归方程为A =0.015 1C +0.012 9,相关系数(R2)为0.998 8,方法检出限(3σ/k)为2.0 μmol/L。此外,从回归方程可以得到,当λ =652 nm时,摩尔吸收系数ε =1.51 ×104L/(mol·cm),方法的灵敏度略高于用邻二氮菲做显色剂的测铁法(ε =1.1 ×104L/(mol·cm)),可用于溶液中微量铁的测定。
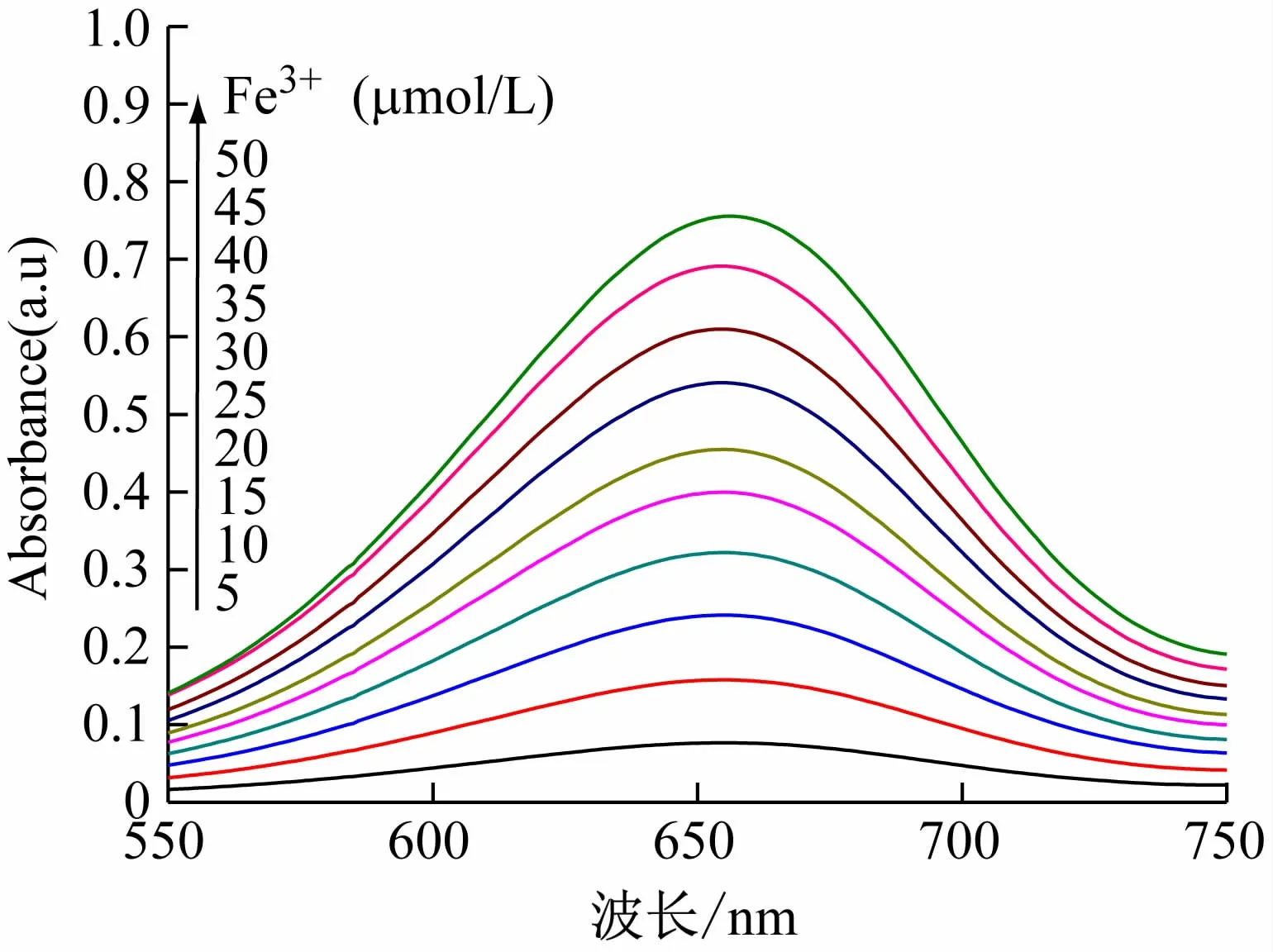
图6 TMB在不同浓度Fe3 +溶液中的吸收光谱
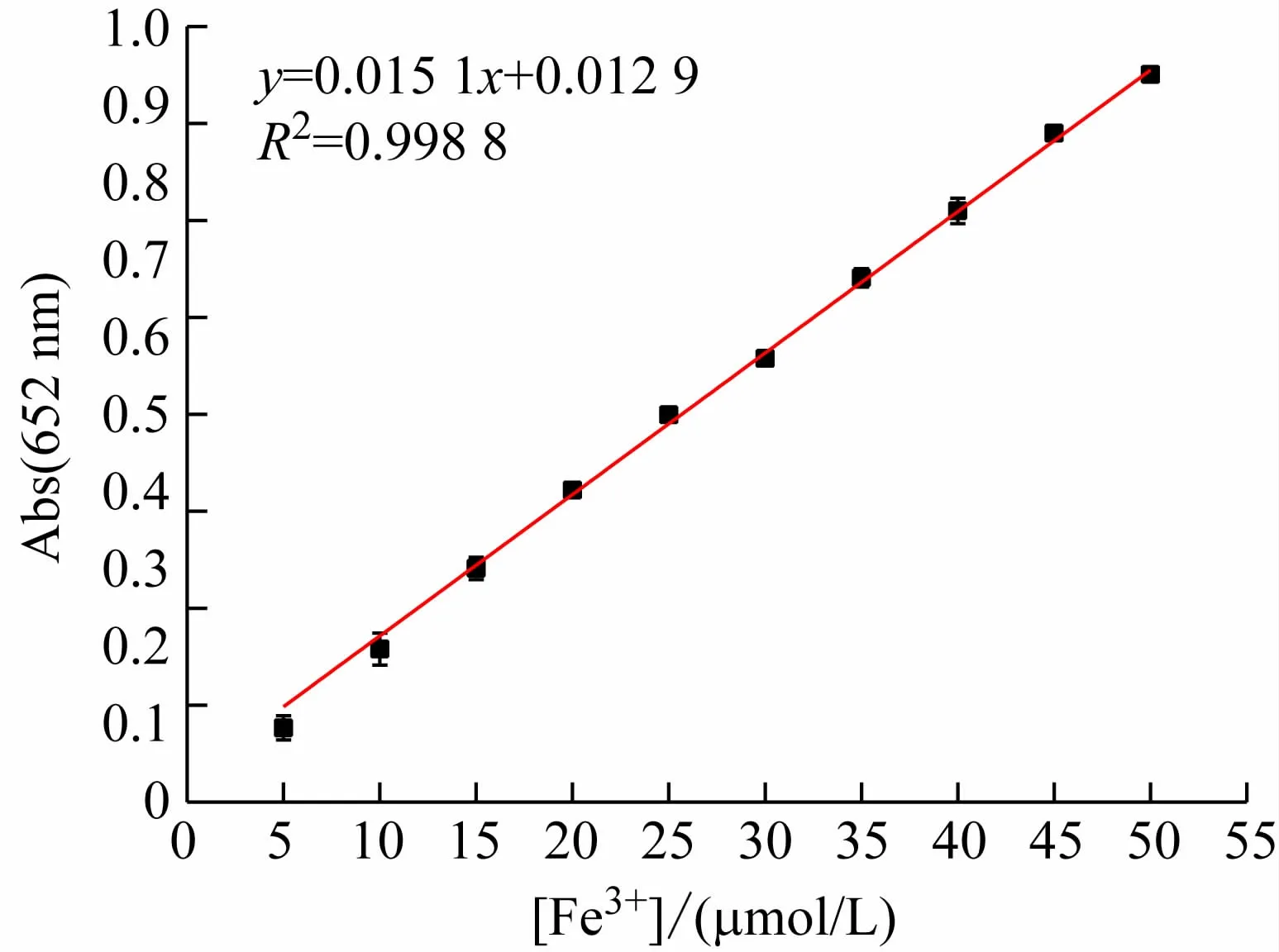
图7 吸光度与Fe3 +浓度的线性关系
2.4 实际样品的测定
取适量枸杞在60 ℃鼓风烘箱内烘40 min,粉碎后称取8.00 g置于坩埚内,在电炉上烧至完全变黑,转移至马弗炉内在800 ℃下焙烧2 h。冷却至室温后,加入5 mL浓硝酸、1 mL浓硫酸,在电炉上缓慢加热至沸腾,溶液变棕色,继续加热至冒白烟并持续2 min,溶液呈淡黄色。冷却后7 000 r/min离心5 min,取上清液,用浓NaOH调pH至4 ~6,用去离子水定容于100 mL容量瓶内,作为待测液。取1.0 mL 样品待测液,按实验方法测定,同时做2 种浓度的加标回收实验,具体数据见表1。回收率分别为104%和108%,表明方法的准确度高,满足微量分析要求。

表1 实际样品中Fe3+含量的测定结果(n=3)
通过下式计算出样品中铁的含量:
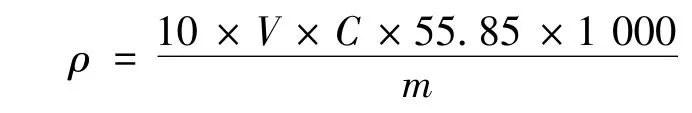
式中:ρ为样品中铁的含量(μg/g),V为待测样品经消解后定容到的体积(mL),C 为实际测得的铁含量(mol/L),m为称取的样品质量(g)。经计算,所测样品中铁的含量为66.5 μg/g。
3 结 语
本实验的设计依据学生所学分析化学理论知识并结合分析化学实验基本操作技能,确保了实验内容的综合性;测定对象为大家熟悉的实际样品,激发了学生学习的积极性。在反应机理的探讨、实验条件的选择、方法分析性能的评估及分析样品的制备与测定等一个完整的分析过程中,学生需运用所学理论知识去解析实验数据,这样可加深学生对分析化学基础知识的理解,提高学生运用分析化学知识解决实际问题的能力。此外,通过实验方案的设计及数据的分析和整理,学生既能从中体会到主动获取新知的乐趣,也可提高其科研能力。此实验在我校部分专业已开设3 年,教学效果良好。已有3 批学生依托紫外可见分光光度计申请了大学生创新实验项目,申请来做毕业论文的学生也明显增多,且其中1 人获得省级优秀毕业论文,多人获校级优秀论文。3 年来,以本科生为第一作者发表SCI和EI收录的论文各1 篇,核心期刊论文1 篇。

