以输液器为例分析医疗器械中微粒污染的检测方法研究
(广东省医疗器械质量监督检验所,广东 广州 510663)
微粒在临床医疗中的静脉输液环节对于输液安全具有重要影响,通常输液器中的微粒直径约为25 μm,如果伴随药液进入人体内,将引发血栓、炎症与病理性变异。GB 8368—2018《医疗器械-输液器标准》针对此类植入式医疗器械的质量标准作出了严格限制,对于微粒污染的检测方法提出了具体要求。
1 微粒污染检测方法
1.1 检测方法分析
GB 8368—2018《医疗器械-输液器标准》中要求以500 mL 洗脱液中的粒子总数作为评价微粒污染程度的标准,与GB 8368—2005 标准的检测原理保持一致。在检测过程中,要求确保在无菌环境下开展实验操作,利用冲洗液进行输液器管腔内壁的冲洗,收集并计算单位体积的液体中含有的粒子数目,实现对微粒污染情况的评估。新标准要求在层流条件下进行检测,选用孔径为0.45 μm 的真空滤膜进行空白对照液与检测液的过滤处理,并利用光阻或电阻检测法进行计数分析。在检测过程中,如果因空白对照液中粒子数目超标引发检测误差,需注重加强对冲洗液质量的控制,在取样环节沿杯壁缓慢收集蒸馏水,减少气泡数量,防止仪器计数错误。如果仍存在检测误差,需重新选取空白对照液,在空白液出口处增设过滤装置,完成空白液与检测液的比较,提升检测结果的精确度。此外,宜选取实验完成24 h后的蒸馏水作为检测液,保障实验器材的清洁度、达成实验标准[1]。
1.2 实验要求
在检测输液器微粒污染时,对实验环境、冲洗液、实验方法的要求如表1 所示,微粒数污染评价标准如表2 所示。
2 微粒污染检测方法在医疗器械质量检验中的具体应用探讨
2.1 微粒污染检测方法的应用
GB 8368—2018《医疗器械-输液器标准》中要求在层流条件下选用0.45 μm 的真空滤膜完成空白对照液与检测液的过滤处理,利用显微镜以50 倍放大倍数进行测量、计数,但在实际检测中受观察点、光源亮度、人的视力等因素的影响,导致检测结果存在一定误差,因此在实际检测中通常采用微粒分析仪作为等效方法进行检测。
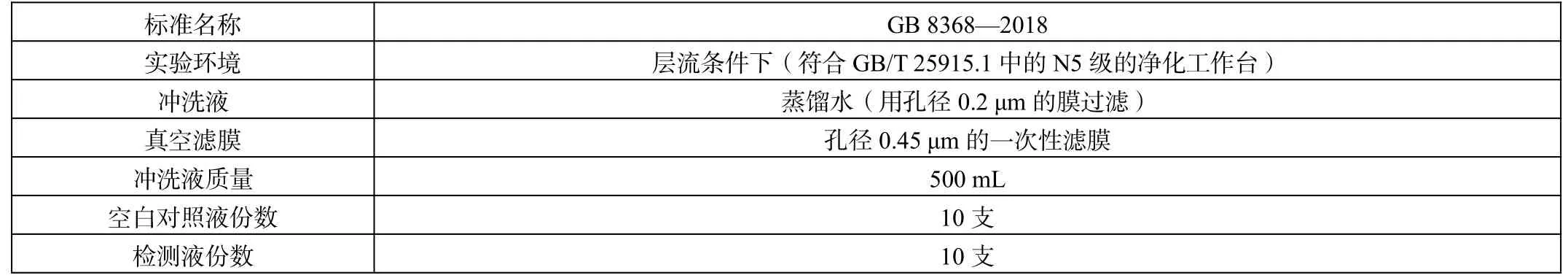
表1 新检测标准下对于实验环境、冲洗液与实验方法的要求

表2 微粒数污染评价
2.2 质量检验中需注意的问题
2.2.1 取样方式
通常在微粒污染检测过程中,常出现空白对照液中粒子数目多于检测液粒子数的情况,其成因主要与输液管材质有关,医用输液管的材质包含乳胶、PVC、硅胶、TPE 等类型,管壁对于微粒具有吸附作用,在实验检测环节由于冲洗液中的部分粒子被吸附在内壁上,导致检测液中的粒子数目少于空白对照液。同时,在将蒸馏水注入取样杯环节,如果在取样过程中产生大量气泡,将导致仪器将气泡误判为粒子,由此影响到计数结果的精确性。基于此,要求质量检验人员注重加强对取样方式的把控,在取样环节使蒸馏水沿杯壁流入到取样杯中,减少因取样操作产生的气泡,并且在计数前通过搅拌空白对照液将气泡排除,保障达成检测要求。在此基础上,还可选取精密药液过滤器增设在液体流出的出口位置,并利用蒸馏水进行输液器的反复冲洗,经由真空滤膜过滤处理后将空白对照液沿杯壁缓慢注入取样杯中,借此保障微粒污染指标与检测结果的准确性。
2.2.2 检测环境
为排除外部检测环境对实验造成的干扰,需将实验中取样后的蒸馏水放置约24 h 后再进行实验检测,保证获取到实验结果的准确性。同时,需做好取样杯的清洗工作,在每次取样时均选用纯化水或3 级水进行取样杯的循环冲洗,保障达成最佳检测环境标准。
2.3 微粒污染检测与防控建议
2.3.1 把好医疗器械质量关
为实现对微粒污染的防控,需从医疗器械生产环节入手把好质量关,基于GMP 规范进行医疗器械性能的把控,督促生产企业落实医疗器械质量生产管理标准,归纳总结出医疗器械生产、审查等环节易出现的质量问题,并编制具体的解决措施,保障输液器等产品的质量达标。同时,需扩展质量监督检验工作的覆盖范围,针对医疗器械的生产、运输、存储、投入使用等环节落实全过程管理,注重针对不同生产厂商、生产工艺、输液器材样式等指标进行把控,并加强对输液器存放环境的管理,避免因存放不当引发器材损耗、使用寿命下降等问题。以输液器橡胶注射件为例,其橡胶封口在长时间放置或冷热交替后均有可能产生损伤,造成微粒污染。因此需注意加强对输液器生产、运输、存储等环节的质量监管,把好医疗器械质量关。
2.3.2 完善医疗器械法规体系
2019 年国务院发布了关于修改《医疗器械监督管理条例》的决定,标志着医疗器械法规体系日臻完善,要求相关质量监督检验机构严格执行法规要求,并加强医疗器械风险防控体系的建设,将质量风险预防管理纳入到医疗器械研究设计与生产过程中,不断完善国家标准下的审查检验机制、细化检验标准,依托早期防控优化产品质量性能、功能效用与安全可靠性,为医疗器械质量提供保障。
同时,应督促各级医疗机构完善上报机制,基于“鼓励上报”原则进行医疗器械不良事件的上报,安排质量监督管理员落实日常对医疗器械质量的监管与检测工作,并将监督抽检结果纳入到考核机制中,针对检验流程、检验周期进行优化设计,完善信息沟通平台与数据库的建设,保障质量监督机构能够及时获取到不同输液器产品的具体信息,实现检测结果的动态反馈[2]。
2.3.3 加强医疗器械监督抽检
由于当前医疗器械的抽检方案主要由质量监督检验机构负责编制,在抽检方案的全面性方面有所欠缺,对此检验机构可综合收集医疗器械生产企业、使用机构等多方主体的意见,实现对抽检方案的精细化、合理性设计,例如针对高值耗材类产品,可采用购样方式进行抽检;针对大型医疗器械设备,需采用现场检验与后期复验相结合的方式等。同时,检验机构需联合食品药品监督管理部门加快省级监管条例的出台,针对具体监管思路、检验制度进行精细化设计,保障有效提升医疗器械使用质量。此外,质量监督检验机构还应加快建设专业抽检工作队伍,创新人才招收聘用渠道,落实内部培训机制建设,依托竞争上岗、绩效量化评价等方式调动员工的工作积极性,并依托科研创新实现对检验技术的研发与推广,增加科研立项,借此培育复合型医疗器械检验人才与团队,更好地为医疗器械的质量监督检验工作提供智力支持,助力医疗器械产业实现转型升级目标。
3 结论
由于输液器的微粒污染问题将引发局部血管堵塞、静脉炎、组织缺氧甚至形成肿瘤,严重影响到患者输液安全与身体健康。因此,务必要落实对输液器等医疗器械的质量监督与检验工作,采取专业微粒污染检测方法,编制科学的质量监督抽检方案,保障落实对医疗器械质量的把关,降低医疗器械不良事件发生概率。

