植入型给药系统的应用与发展趋势
于鲲梦,平其能,孙敏捷
(中国药科大学药学院药剂学教研室,江苏 南京211198)
口服和注射是目前最为普遍和流行的给药途径,但对某些药物而言存在生物利用度低、半衰期短、需要反复多次用药等问题,因此需要研究开发其他途径的给药系统以提高药物的疗效,并使其更加安全和可靠。植入型给药系统(IDDS)是一类经手术植入或经特殊装置导入皮下或靶部位的控制释药系统[1],主要具有以下优点:1)实现局部或全身给药,降低剂量并减小副作用;2)避免首过效应和胃肠道降解,提高生物利用度;3)载药量高,体积较小,可延长药物作用时间,特别适合慢性及老年性疾病的长期治疗,提高患者顺应性。近年来,随着理论和技术的发展,IDDS的应用逐渐增加,主要分为皮下埋植型、注射植入型和智能植入型等,本文就常见植入系统的种类、临床应用及进展情况进行综述。
1 皮下埋植型植入剂
1.1 非生物降解型
非生物降解型植入剂是早期研究及应用的植入体系之一,由在体内不可生物降解的载体材料通过一定制备方法制成,常用材料为硅橡胶、聚氨酯、聚丙烯酸酯、聚乙烯酸乙烯酯共聚物等[2]。通常分为贮库型和骨架型,在贮库型植入剂中,药物贮库核心被非生物降解的惰性聚合膜包裹,药物的渗透性及膜的厚度决定了药物的释放速率,常可以达到恒定释放速率(即零级释放)[3]。骨架型植入剂则将药物均匀分散或溶解在非生物降解的控释骨架材料中,通过扩散作用释放到周围环境,通常符合Higuchi释放模型M(t) =A[DCS(2C0-CS)t]1/2[1],其中M(t)为t时间释药量,A为基质的表面积,D为溶质在聚合物材料中的扩散系数,CS为药物在基质中的溶解度,C0为药物的初始总浓度。药物的释放速度受浓度梯度、扩散距离、基质溶胀程度的影响,并与包裹的药量C0成正比。
临床上最为熟知、用于长效避孕的埋植皮下胶囊Norplant®,该产品包含6个硅橡胶小胶囊,各包裹36 mg左炔诺孕酮,将其埋植于女性上臂内侧皮下,避孕周期长达5年,自1990年被美国FDA批准上市后现为多个国家所广泛使用[4]。Mirena®是一款小型聚乙烯“T”形避孕环,植入女性子宫内后可在5年内持续释放左炔诺孕酮,避孕有效率达99%以上,并可因患者需要随时将其取出,方便中止。截至目前,经美国FDA批准上市的非生物降解型植入产品包括 Vantas®、Retisert®、Nexplanon®、Supprelin LA®、Iluvien®、Probuphine®、NuvaRing®等。同时,关于植入剂给药设备的开发层出不穷,Merck Sharp & Dohme B.V.公司开发了一种棒状植入剂给药器,将药物从导管推出,无需施加侧面力,并于2017年收录进美国FDA橙皮书Implanon®项下。然而,非生物降解型植入给药系统在释药周期结束后,需通过手术进行收集并将其取出,这一过程亦常常造成患者身体的不适和二次伤害。
1.2 可生物降解型
随着高分子材料的研发应用,与机体相容、可生物降解型植入剂逐渐面世。所用载体材料在体内可自发降解为单体小分子,降解机制包括水解、酶解、氧化、物理降解等过程,pH值和温度等外部环境因素亦有影响[2]。要求降解产物无毒且易通过生理途径代谢和排出,因此释药结束后不需要再通过手术将其取出,大大提高了患者的依从性。这类材料已部分替代非生物降解材料用于避孕药、抗肿瘤药植入剂的生产,如植入片Gliadel Wafers®于2000年开始用于术后脑瘤的化疗,亦可将其他不能透过血脑屏障的抗肿瘤药(如卡铂、环磷酰胺)直接植入颅内进行治疗[5]。此外上市产品还包括Zoladex®、Ozurdex®、Sinuva®等。
1.2.2 聚合物材料 对于植入制剂所采用的材料,因其遗留在体内而规定更加严格,且需要对聚合物的物理性质如机械动力学、降解动力学、材料及其降解产物的安全性和刺激性等有精准的认识和掌控。目前最常用的材料为人工合成的聚酯如聚乳酸(PLA,1)、聚乙醇酸(PGA,2)、聚乳酸-乙醇酸共聚物(PLGA,3)、聚己内酯(PCL,4)等[7]。这些聚合物易于合成且具有良好的生物相容性、生物降解性及机械强度,如今被广泛使用。聚合物的降解速率取决于其亲水性、玻璃化转变温度(Tg)、相对分子质量及分布、温度和pH等环境条件,降解时间范围从1 ~ 6个月及以上不等,因此可以通过调节聚合物的性质如种类、相对分子质量、结晶性及制剂表面性质和形态等调节降解速率,实现特定的释药动力学要求[8]。
1.2.2.1 聚乳酸 PLA也称为聚丙交酯,迄今为止,是人类历史上研究和利用最广泛的可生物降解脂肪族聚酯。PLA以重要农业经济作物(如玉米等)经过现代生物技术生产出的乳酸为原料, 通过丙交酯开环聚合法或乳酸直接缩聚法合成,成本低且具有良好的生物降解性和机械性能,是通过美国FDA认证的安全材料并可与生物体液直接接触,具有广阔的应用前景[9]。与其他生物材料如聚乙二醇(PEG)相比,PLA具有出色的热加工性,Tg与熔融温度分别约为55和175℃,可用于挤出,薄膜浇铸,吹塑或纤维纺丝等工艺,目前已作为某些组织、骨骼内植入的医疗制品使用。Li等[10]通过热熔挤出工艺成功制备了PLA/PEG-聚丙二醇(PPG)-PEG/地塞米松(PLA/F68/Dex)微棒状植入剂,通过皮下植入大鼠体内后可抑制炎症反应1个月以上,且主要器官的组织病理学研究表明该植入物无毒,可作为疏水药物载体的潜在应用安全选择。
1.2.2.2聚乙醇酸 PGA是通过乙醇酸聚合制备的聚酯,是首批用于生物医学领域的可生物降解的聚合物之一。PGA仅有一种高度结晶形式,具有极好的机械性能(优于PLA),由PGA制造的可生物降解的缝合线Dexon®自1970年起被广泛使用。但PGA降解速度过快且不溶于许多常见溶剂,降解产生的酸性副产物会导致周围组织发炎,因此,该聚合物并未单独用于药物递送[11]。
1.2.2.3聚乳酸-乙醇酸共聚物 PLGA也称乙交酯-丙交酯共聚物,由乳酸和乙醇酸按照一定比例共聚而成,兼有2种聚酯材料的优势,不仅具有良好的生物相容性和生物可降解性,显著优点是可以通过改变聚合物的相对分子质量和丙交酯与乙交酯的比例,调节聚合物的物理性能,从而实现预期要求[12]。PLA与PGA常见比例为50 : 50、75 : 25、85 : 15,疏水性及降解时间随PLA的比例增加而增加,PLA与PGA比例为50 : 50时降解速度最快,约为1 ~ 2个月。另外,PLGA的Tg值约为40 ~ 60℃,具有较好的热力学性能,可加工成各种形状和尺寸,可溶于较多常见溶剂,非常适合植入物的制备[2],是生物医学应用中研究最多的可降解聚合物,目前已有多个基于PLGA的植入剂经美国FDA批准上市。Zoladex®是由英国阿斯利康公司研发的一种白色或乳白色柱形植入剂,适用于晚期前列腺癌和乳腺癌的姑息治疗。该产品的活性药物成分为醋酸戈舍瑞林,规格分别为3.6和10.8 mg。药物分散于PLGA缓释骨架材料中,经注射器皮下给药,释药周期分别为28 d和3个月。Ozurdex®是一种玻璃体内PLGA植入剂,含有0.7 mg地塞米松,于2009年获得美国FDA批准上市用于治疗黄斑水肿,其中美国的Oculex Pharmaceuticals公司于2004年获FDA专利批准,开发了一种地塞米松生物降解型植入给药装置,可在48 h内维持0.05 mg · L-1的药物质量浓度,3周内维持在 0.03 mg · L-1[13]。
1.2.2.4 聚己内酯 PCL是一种低熔点(55 ~ 60℃)的半结晶聚合物,与其他聚合物相比降解时间较长(可达数年),可与多种其他聚合物(常见为PEG)共混改变降解速率[14]。PCL由于成本低、高度多样化及良好的生物相容性,已获得美国FDA批准应用于医疗,广泛地用于组织工程支架、再生骨骼、缝合线和伤口敷料材料等,并且为皮下植入剂的重要候选材料之一[15]。Sinuva®是一种可自我扩张的药物洗脱鼻窦植入剂,由聚(L-丙交酯-乙交酯)和聚(L-丙交酯-ε-己内酯)组成,可逐步释放药物糠酸莫米松超过90 d。
除有机可生物降解聚合物外,另有一类无机生物陶瓷材料递送系统,具有良好的机械特征和生物相容性,广泛应用于骨感染、眼内植入物、纳米多孔涂层等,常用材料包括羟基磷灰石、磷酸三钙(TCP)、铝钙磷氧化物等。这类磷酸钙类陶瓷材料植入体内后经过一段时间发生降解,可部分或全部吸收,其中降解显著的为β-TCP陶瓷,降解产生的Ca、P可进入循环系统,为新生骨形成提供基本要素[16]。
2 注射型在体植入剂
注射型在体植入剂是指以液体形式注射于人体,在生理条件下转变为固体或半固体药物贮库的植入剂形式[17]。与传统的预成型植入剂相比,该剂型具有生产相对简便、对机体损伤小、患者依从性好等优点,可用于全身性及局部药物递送、组织工程、三维细胞培养、整形外科等。但往往需要使用有机溶剂,如N-甲基吡咯烷酮(NMP)、环己烷、丙酮等,可选择的范围较小;另外,控制其在体内的成形对控制释药速率十分重要。根据体内成形的机制,可大致分为在体交联体系、在体固化有机凝胶、在体相分离体系等类型[18]。
针对这一情况,有如下建议:(1)直接补贴创业企业和团队。调整租金补贴的对象,从对孵化器运营方的补贴,改为直接补贴给符合条件的企业,尤其加大对处于开创初期的企业和团队的补贴力度,条件允许的话,让个别团队可以拎包加盟。(2)以奖代补。在开发区建设前期,为吸引资本投资孵化器建设,对孵化器适当扶持是应该的,但现在孵化器建设发展到这一阶段,不能够一成不变地继续实行利益均沾的普惠型的补贴政策,要防止“二房东”的现象,防止孵化器企业间出现基于补贴不一的情况下的恶性竞争,可以考虑逐步撤销原来孵化器租金补贴的政策,以奖代补,对管理规范、发展趋势好的孵化器实行奖励性补助。
2.1 在体交联体系
在体交联体系是把聚合物在体内相互交联而形成固态体系或凝胶[17]。根据交联的原理,主要可分为光致交联、与交联剂发生的化学交联及特定单体的物理交联。该体系对体内反应条件要求严格,且化学交联反应发生时通常会释放出一定的热量,对机体组织造成损伤,物理交联体系则对聚合物自身的构象具有较高的要求[17]。Ono等[19]通过紫外线照射制备了同时引入叠氮化物和乳糖的光致交联壳聚糖(Az-CH-LA)凝胶作为软组织的生物黏合剂,在体内可维持1个月;凝胶内含紫杉醇并可在21 d内保持生物活性,但是由于凝胶的生物降解作用,在最初的24 h内发生了突释,之后则缓慢释放。
2.2 在体固化有机凝胶
有机凝胶由不溶于水的两性脂质分子组成,可在水中膨胀形成各种液晶相,其性质由脂质的结构特性、温度、药物性质及体系含水量决定[17]。有机凝胶制备工艺相对复杂且影响因素较多,限制了该体系的深入研究。最早使用的在体固化有机凝胶材料是可生物降解型脂肪酸甘油酯如单油酸甘油酯、单亚油酸甘油酯、单棕榈酸甘油酯,室温下为蜡质,但组分复杂不易控制且稳定性较低,目前研究较多的是L-丙氨酸衍生物体系。Plourde等[20]将N-硬脂酰基-L-丙氨酸(甲)乙酯溶于红花油/NMP混合溶剂中得到含醋酸亮丙瑞林的W/O型乳剂,注入体内后,NMP向外部含水环境扩散从而固化形成凝胶。大鼠体内实验结果表明,醋酸亮丙瑞林可缓释14 ~25 d,并可使血浆睾酮水平在50 d内维持较低水平。
2.3 在体相分离体系
2.3.1 pH诱导的凝胶系统 该体系所用聚合物分子中含有大量可解离基团,当以液态注入给药部位后,由于pH环境的改变,电荷间相互排斥导致分子链的伸展与相互缠结,从而发生溶胶-凝胶的相转变[21]。壳聚糖、卡波姆(Carbopol®)、丙烯酸聚合物等是最常用的材料。Srividya等[22]使用Carbopol®940作为胶凝剂,Methocel E50LV为增黏剂,成功制备了氧氟沙星原位凝胶眼部给药系统。该制剂在配制环境(pH = 6)下为液体,注射入眼后pH升至7.4则发生快速凝胶化转变,形成的凝胶可在8 h内持续释放药物。
2.3.2 热塑胶浆体系 热塑胶浆体系应用时,将聚合物以熔化物形式注入体内,冷却至体温时可形成半固体贮库,聚合物凝固后的结晶度影响药物的释放。特别适用于难溶性药物,避免了使用有机溶剂,但使用前需加热软化,造成使用不便,且较高的软化温度会对注射部位造成损伤[23]。所用材料通常熔点较低(25 ~ 65℃),固有黏度控制在 0.005 ~ 0.08 L · g-1,其中低分子量聚原酸酯(POE)的软化温度(35 ~45℃)相对较低,尤其适用于热塑胶浆体系。Schwach-Abdellaoui等[24]将甲氧氯普胺(MTC)溶于POE胶浆中,用于治疗胃肠道疾病。但由于MTC具有高度水溶性和酸性,从基质中释放过快,因此向POE中加入少量Mg(OH)2降低释药速率。体内实验将POE/MTC胶浆通过皮下注入狗的颈部后,可持续释药30 h以上。
2.3.3 溶剂移除沉淀体系 该体系利用相分离原理,将水不溶性聚合物溶于与水互溶的有机溶剂后注入体内,有机溶剂向周围的体液环境扩散,同时周围的水分子扩散进入聚合物,使其固化从而在注射部位沉淀形成药物贮库[17]。药物主要通过扩散释放,接触含水介质后,聚合物溶液的表面首先固化,阻碍扩散,但内部结构仍较为疏松;且固化过程需要一定时间,因此该体系的主要不足是突释较大,另外有机溶剂具有一定的毒性[25]。大量研究通过调节聚合物性质,改进制备工艺如制备在体微球、在体微粒,加入添加剂等方式以期得到较为理想的药物贮库。目前该体系已有产品经美国FDA批准上市,Eligard®系列为醋酸亮丙瑞林皮下注射用混悬剂,可缓释1、3、4、6个月不等,用于姑息治疗晚期前列腺癌[17];Atridox®是一种盐酸多西环素凝胶,将其直接注入牙周袋内缓慢释放药物,用于治疗牙周炎[26]。
2.3.4 热致溶胶-凝胶转变体系 将聚合物和药物溶于适宜溶剂中,热致溶胶-凝胶转变体系在低温或室温条件下为溶胶态,且黏度较低,因此可通过无创伤或微创方式注入作用部位;进入体内后温度上升,聚合物的溶解性发生突变而形成凝胶。发生溶胶-凝胶转变的温度通常称为低临界溶解温度(LCST)。常用的材料为聚氧乙烯-聚氧丙烯嵌段共聚物、聚乙二醇-聚乳酸嵌段共聚物、纤维素类衍生物等。这些聚合物均包含一定比例的亲水嵌段,低温时可形成足量的氢键使聚合物保持溶解状态;随着温度的升高,氢键数目减少至某一临界点,导致体系发生相分离而形成凝胶[21]。不足之处在于该体系往往因过于亲水而造成亲水性药物突释现象严重。新型温敏水凝胶ReGel®(PLGA-PEG-PLGA)负载紫杉醇后的产品OncoGelTM与市售产品Taxol®相比,可有效降低给药剂量(6 g · L-1紫杉醇),对人类乳腺癌的疗效更高且降低了紫杉醇的全身毒副作用,药效可持续6周左右,用于治疗食道癌、脑癌和乳腺癌[27]。
3 机械泵、智能型可植入系统的发展
3.1 植入泵
植入泵是具有微型泵的植入剂,通过将泵或者导管植入到作用部位,依靠自身或外部环境的推动力缓慢注入药物。与非降解型/降解型植入系统相比,释药速率更稳定(一般可达零级释放),并可以根据临床需求更准确地调节给药速率;动力源可长期使用并可通过皮下注射等方式向泵中补充药液,避免了多次注射;但普遍成本较高,部分装置外挂,影响患者依从性[21]。根据释放的动力不同,可分为:输注泵、蠕动泵、渗透泵等。
3.1.1 输注泵 输注泵以氟碳化合物作为推动力,广泛用于胰岛素给药的糖尿病治疗,亦被用于抗凝治疗和抗肿瘤治疗。最早应用此原理的产品为美国Metal Bellows公司的Infusaid®植入泵,装置内含氟碳推动剂与药物贮库2个腔室,由缠绕着金属波纹管的圆盘钛相隔;推进剂在固定温度下产生恒定的蒸汽压力,推动药物通过限流器恒速释放[4]。
3.1.2 蠕动泵 由Medtronic公司开发的Synchromed®是一个完全植入式蠕动泵,由可旋转的螺线型电导组成,通过施加的外部电场及微电子系统控制药物释放,改变电场强度可调节释药速率,用于鞘内递送阿片类镇痛药、治疗严重痉挛的巴氯芬及其他药物[28]。
3.1.3 渗透泵 植入型渗透泵与口服渗透泵片类似,其释药推动力为渗透压。注入皮下后,泵外周体液中的水分子透过半透膜进入促渗室,溶解促渗剂(通常为氯化钠)形成饱和溶液,推动隔膜另侧贮库室的药液从导药小孔推出。该体系可实现药物的恒速释放,但载药量受限。Duros®系统为应用此原理的典型产品,用于释放醋酸亮丙瑞林治疗前列腺癌(Viadur®),目前还在开发递送其他药物如艾塞那肽(降糖药)、干扰素(Omega Duros®)、舒芬太尼(Chronogesic®)及其他镇痛药[29]。
3.2 基于微机电技术的可植入系统
随着精密机械制造技术与微机电技术(MEMS)的不断发展,可植入机械泵、电子泵已成为现代医疗体系的重要组分,用于连续实时监控人体的温度、阻抗、心电图和呼吸频率等生理参数。植入传感器大致分为压力传感器、温度传感器、神经信号传感器、化学传感器及生物可吸收电池,所用材料包括金属、半导体、绝缘体、人工合成聚合物等[30]。Son等[31]设计了一种多功能可吸收电子植入支架,血流与温度传感器对作用部位进行监测,同时载有免疫抑制剂(例如雷帕霉素)纳米颗粒,有助于催化活性氧物质的清除和再狭窄的治疗。
基于MEMS的植入式微芯片设备可在其硅芯片上同时负载多个极微型药物贮库,贮库表面被金箔或其他薄膜覆盖,植入体内后,施加电压使其金箔发生电化学溶解从而释放药物。该给药系统的优点为可长期稳定地储存药物并实现复杂的给药方案如脉冲给药、个体化给药、根据需要输送多种药物等[32]。
3.3 应答式给药系统
实现药物的脉冲式释放通常有2种解决方案:第一种是预先对载药装置进行设计如多层骨架系统,使其在预定时间或以预定顺序释药;第二种则通过响应局部环境因素(如磁场、电场、声压、光和热)的变化或反馈体内信息来控制与调节药物的释放,称为应答式给药系统,也称为智能型给药系统。根据调节机制不同,分为开环式给药系统与闭环式给药系统。前者通过外部环境变化刺激药物释放,常耦合生物传感器;后者为自我调节机制,通过反馈体内环境变化如特定分子的浓度释药,最常见为葡萄糖敏感型给药系统,当检测到体内血糖浓度升高时系统可自动释放胰岛素[33]。但是在临床可用之前,需要研究生物相容性问题及从外部控制递送系统触发药物释放的便利方法。
4 应用
4.1 生殖健康
用于生殖健康的植入剂通过埋植在皮下、阴道内、子宫内长期释药,主要用于避孕,是目前公认的最有效的避孕方法之一。表1介绍了几种常见的用于女性健康的植入剂。
4.2 肿瘤治疗
口服化疗药物是治疗肿瘤最常用的给药途径,但药物剂量大,常导致严重的全身性副作用,例如中性粒细胞减少症和心肌病[37]。通过将药物递送装置直接植入到作用部位可大大减少药物剂量,从而降低对其他健康组织造成的损害。目前研究较多,部分产品实例见表2。

表1 用于女性健康的可植入给药装置示例Table 1 Examples of implantable drug delivery devices for women's health
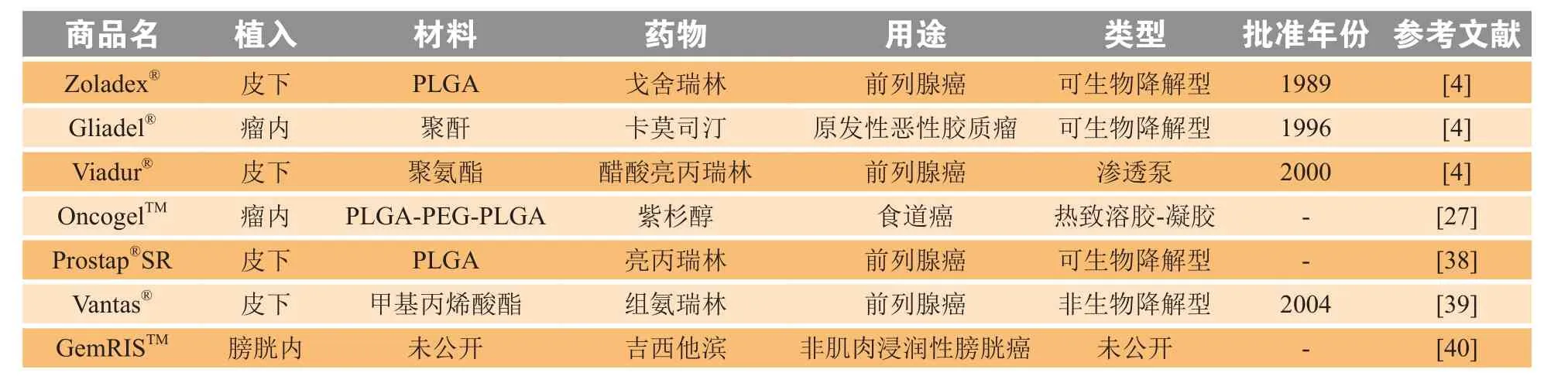
表2 用于肿瘤治疗的可植入给药装置示例Table 2 Examples of implantable drug delivery devices for cancer treatment
4.3 眼部疾病
由于眼部独特的解剖学结构造成的生理障碍以及泪液的稀释作用,难以将药物递送至眼部后段并在治疗期间保持有效浓度;并且由于眼部环境较为敏感,给药设备常造成患者不适,因此如何实现眼部特别是眼后部有效给药是目前亟待解决的一个难题。植入型给药装置可直接植入到作用部位,提高药物浓度;并且因长时间持续释药,减少给药次数从而提高患者的依从性。但常伴随药物突释、剂量倾泻、生物利用度低等现象[41]。表3列出了一些目前已开发的眼部植入剂,包括早期植入眼睑的周效的毛果芸香碱到目前应用的可生物降解的地塞米松玻璃体内植入棒和更昔洛韦眼后植入微粒等。
4.4 心血管疾病
不可降解型植入给药装置的重要应用之一为药物洗脱支架(DES),是目前治疗心血管疾病特别是冠状动脉疾病的常规治疗方法,可将患者的冠状动脉再狭窄减少60% ~ 75%[43]。通常由金属支架、抑制内膜生长的药物和控制药物释放的聚合物组成,支架表面覆有药物涂层,主要通过扩散作用释放药物。表4列出了自2003年以来美国FDA批准的几种DES体系。
尽管DES彻底改变了冠状动脉疾病的治疗方法,但在极少数患者中仍然存在后期不良反应。药物洗脱生物可吸收血管支架(DEBVS)与其相比具有一系列优势,在需要用作支架时执行DES的所有功能,在不再需要时可被人体自然吸收和代谢。因此,避免了永久性植入剂带来的慢性炎症并加速愈合,减少长期双重抗血小板治疗的需要,并且可以使冠状动脉恢复至自然的健康状态,从而消除或大大减少了晚期支架血栓的形成[4]。Abbott Vascular公司开发的Absorb™由可生物降解材料PLA制备而成,在体内随着时间推移而溶解。自2012年起在欧洲以及亚太地区和拉丁美洲的部分地区销售,自2013年1月以来处于美国的随机临床试验阶段。
4.5 其他
IDDS在多个领域具有较大的应用潜力,尤其适用于慢性疾病的治疗。慢性疼痛治疗难度大,且伴随着过量服用药物导致成瘾或死亡的高风险[45]。植入剂还可用于治疗传染病,特别是结核病,结核病的治疗时间长,副作用大,患者对治疗方案的依从性较差,常导致治疗失败和产生耐药性[46]。另外有调查研究显示,约50%的精神分裂症患者不遵守治疗方案,易导致复发、住院和其他不良后果[47]。在这种情况下,植入型给药装置将是确保患者顺应性从而完成治疗的理想选择。表5总结了用于治疗慢性疼痛和中枢神经系统疾病的一些可植入药物递送装置。

表3 用于眼部疾病的可植入给药装置示例Table 3 Examples of implantable drug delivery devices for ocular diseases
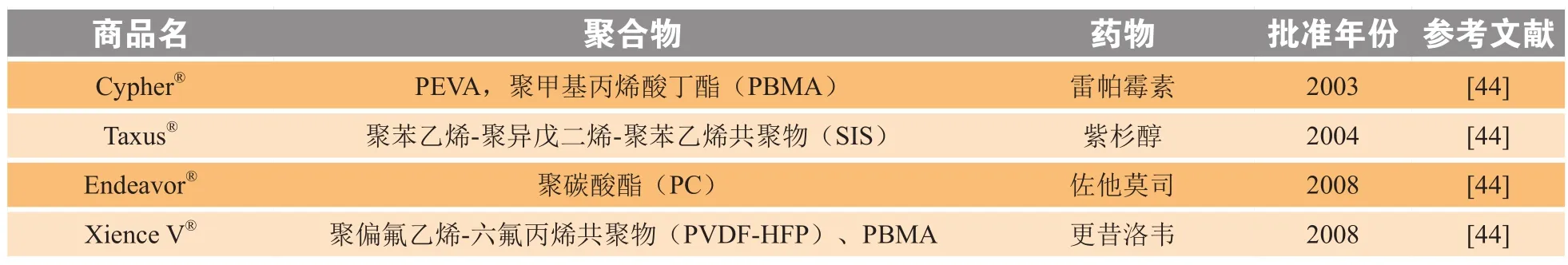
表4 自2003年美国FDA批准的几种不可降解型药物洗脱支架示例Table 4 Several non-degradable DES approved by the FDA since 2003
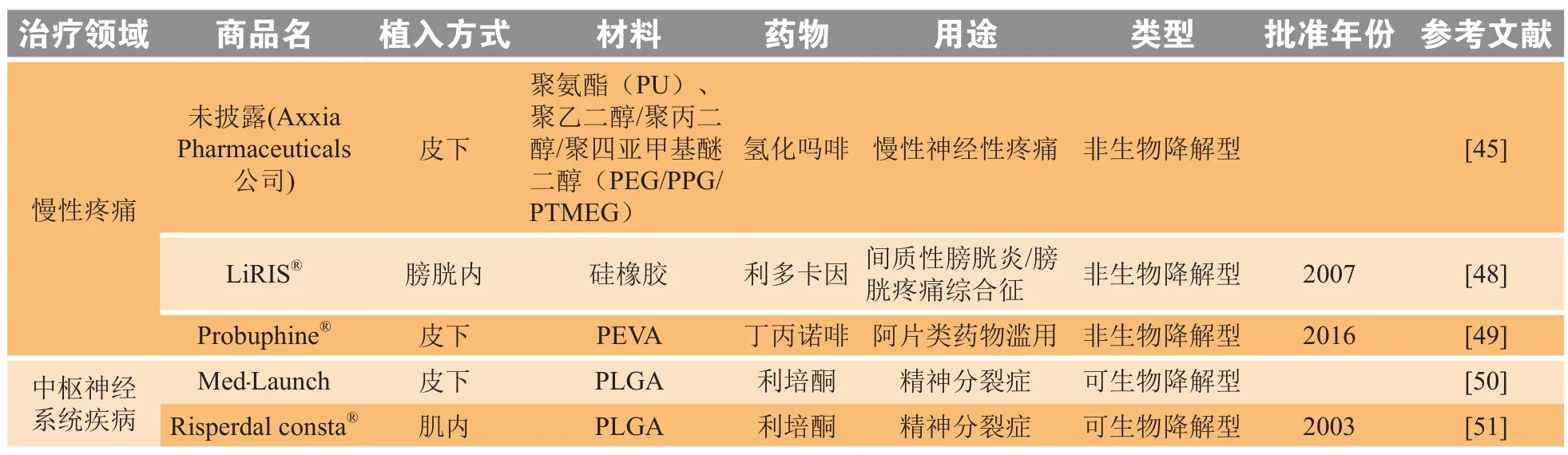
表5 用于治疗慢性疼痛和中枢神经系统疾病的植入剂示例Table 5 Examples of implantable drug delivery devices for pain management and central nervous system disorders
5 结语与展望
尽管IDDS与传统的给药方式如口服、静脉注射等相比有一系列优势,但仍存在一些问题。首先,植入体内的给药方式本身会对患者造成一些身体不适和生物相容性差等问题,因此需不断改进植入设备使其变得更加小巧温和,降低对人体的伤害,提高患者的依从性。其次,植入剂需要在较长的一段时间内,实现在特定位置以特定速度缓慢释放药物,这通常需要十分复杂精密的系统设计,增加了研究难度及开发成本,因此如何以最低的成本获得最有效的给药系统是植入剂发展道路上的另一大难题。然而,随着微电子技术、微/纳米制造技术、3D打印技术等前沿领域不断发展成熟,未来智能型、多功能、医疗器械与药物一体化植入给药系统将会得到发展,改变传统的剂型概念,为改善人们的临床需求作出巨大贡献。

