电化学提锂技术中电极材料和电极体系的研究进展
郭志远,纪志永,陈华艳,时雅滨,张帆,赵颖颖,刘杰,袁俊生
(1 河北工业大学化工学院/化工节能过程集成与资源利用国家-地方联合工程实验室,天津300130;2 河北工业大学化工学院/海水资源高效利用化工技术教育部工程研究中心,天津300130;3 河北省现代海洋化工技术协同创新中心,天津300130;4 天津工业大学分离膜与膜过程国家重点实验室,天津300387;5 北京交通大学海滨学院,河北黄骅061199)
锂及其化合物被广泛应用于玻璃、陶瓷、电子、新能源汽车、军工国防和航空航天等领域。近年来,随着电子产品和新能源汽车的快速发展,使得对锂离子电池的需求量与日俱增[1-2]。根据相关全球锂资源供需分析,2023 年锂资源供应将不能满足需求,因此锂资源的开发成为研究热点[3]。
当前,锂资源的主要来源为锂矿石和盐湖卤水。由于矿石提锂存在高能耗和高污染的缺点,加之盐湖卤水占陆上总量的70%~80%,盐湖卤水提锂已成为获取锂资源的主要途径。随着富锂盐湖卤水资源的快速开发利用,开发对象逐渐转向低品位盐湖卤水锂资源[4]。与此同时,伴随大规模海水淡化产业的蓬勃发展,减少浓海水的直排,并进行资源化利用(海水中锂素储量达2600 亿吨,为陆上总量的万余倍)成为共识[5]。因此,低品位盐湖卤水/(浓)海水成为下一阶段获取锂资源的重要渠道。由于低品位盐湖卤水(Li+浓度<24.5mg/L)和(浓)海水(0.17~0.34mg/L)等溶液中锂的相对含量低,且共存多种碱金属和碱土金属离子(如K+、Na+、Mg2+、Ca2+),其中,与锂离子物性相近的Mg2+含量较高(国内盐湖卤水中Mg/Li 质量比一般在35 以上,(浓)海水中的比值则高达7400 多),使得其开发更为困难。因此,锂的选择性提取和高效富集成为低品位锂资源提取技术需求的核心[6]。传统的蒸发沉淀法仅适用于Li+浓度较高、低镁锂比的卤水。针对这些复杂稀薄溶存锂资源的开发利用,纳滤[7]、电渗析[8-9]、离子交换与吸附法[10-11]、电化学提锂法逐渐被开发。其中,电化学提锂法具备选择性高、适用于低品位锂资源、环境友好的优势而受到广泛关注。
在电化学提锂过程中,电极材料的选择/制备和提锂电极结构体系/装备的构建是影响电化学提锂过程的两个最主要因素。本文围绕近年来国内外电化学提锂技术的研究,对锂吸附电极材料的选择/制备和提锂电极结构体系的发展两方面进行了总结分析,并针对目前电化学提锂过程存在的问题及不足指出后续研究方向,以期为电化学提锂技术更好的发展和应用提供思路和参考。
1 电化学技术原理
电化学提锂是利用锂离子电池(lithium ion batteries,LIBs)正极材料在充放电过程中会伴随Li+在固相电极和液相电解液两相之间转移的原理来实现的。在充电过程中正极材料被氧化,Li+从正极材料中脱出到电解液中;在放电过程中,正极材料被还原,Li+从电解液中嵌入到正极材料中[12-13]。基于放电过程,把LIBs里的有机电解液换为含锂的卤水/浓海水,可实现Li+的提取;基于充电过程,把LIBs 里的有机电解液换为成分单一的回收液,即可实现Li+的回收。
电池的正极材料主要有LiFePO4、LiMn2O4和LiCoxMnyNi1-x+yO2等[14]。其中,尖晶石型LiMn2O4因其高的Li+选择性,作为离子筛(能吸附特定离子的复合氧化物多孔材料)用在锂资源的提取上已得到广泛应用[15-16],其应用包括吸附(吸附目标离子至离子筛内)和洗脱(用酸性或强氧化性洗脱剂将目标离子从离子筛内再生出来)两个过程。对于洗脱过程,常用的洗脱剂为HCl、H2SO4和HNO3等,后期为抑制酸洗过程中Mn的溶损,过硫酸盐洗脱剂逐渐被开发应用[15,17]。当前,离子筛对于Li+的吸附机理被认为是由离子交换与吸附和氧化还原两类反应共同作用的[18-19]。
电化学提锂避免了离子筛再生过程中酸性或强氧化性洗脱剂的使用,不仅实现了提锂的环境友好性,还避免了洗脱剂对离子筛结构的破坏,具有适用于低品位卤水、环境友好、能耗低等优势。电化学提锂的成本主要为设备(电极材料及装置)成本和运行成本。在运行成本上,由于电极材料对Li+的高选择性,在Li+的分离纯化和富集过程中其仅消耗少量电能(≤30W·h/mol Li+),低于电渗析的100~2000W·h/mol Li+[9]。因此,通过电极材料和装置优化控制其设备成本后,电化学提锂技术将具有广泛的应用前景。电极材料的制备和电极体系构建的参考条件分别为:Li+交换容量、选择性、循环稳定性等;电极体系的设备成本、提锂过程能耗和提锂效率等。
2 Li+脱/嵌电极材料
在电化学提锂过程中,一般存在两个电极。其中,“工作电极”用来实现Li+的选择性嵌入/脱出过程;“对电极”用来与工作电极形成闭合回路,其主要分为电子导体和离子导体两类,以使得电化学提锂体系保持电中性。此外,在一些研究中还会加入Ag/AgCl 或饱和甘汞电极做参比电极,并用来稳定电极电势。通常,工作电极材料与锂离子电池的正极材料相似,选择的主要参考条件为电极的活性材料对锂的选择性和交换容量及其循环稳定性等。工作电极的活性材料对于Li+的高效选择性主要由其晶格空位大小所决定。Li+在所有的金属离子中具有最小的离子半径,而锂离子筛活性材料小的晶格空位因具有阻碍其他离子半径较大离子的吸附,而表现出对Li+的高选择性[20]。目前,应用的电极活性材料主要有LiFePO4、 LiMn2O4和LiNi1/3Co1/3Mn1/3O2等。
2.1 LiFePO4电极
LiFePO4的晶体结构属于典型的橄榄石型结构(图1)[21],由FeO6八面体和PO4四面体构成晶体骨架,Li+具有一维的可移动性。Li+在铁的氧化与还原过程中实现Li+的脱出与嵌入过程。
LiFePO4在实现Li+脱出与嵌入过程中的反应过程分别如式(1)和式(2)所示。

橄榄石型的LiFePO4结构中[LiO6]八面体和[FeO6]八面体之间的[PO4]四面体限制了LiFePO4的体积变化,使得其具有良好的循环稳定性,但同时也限制了Li+在充放电过程中的嵌入和脱出,使得Li+的扩散速率较低。此外,由于其结构中没有连续的[FeO6]共棱八面体网络,电子传导只能通过Fe-O-Fe进行,使其电子电导率也较低,因此在电池的充放电过程中其倍率性能较差,对应其提锂效率也相对较低。
2.2 LiMn2O4电极
LiMn2O4属于典型的尖晶石结构,如图2 所示。图2(b)和(c)分别为LiMn2O4和Li+脱出后λ-MnO2的三维框架结构,MnO2构成了三维的锂离子嵌/脱通道,使其相较于LiFePO4具有更高的离子电导率和电子电导率[22],从而具备更好的倍率性能。
LiMn2O4在实现Li+脱出与嵌入过程中的反应过程分别如式(3)和式(4)所示。
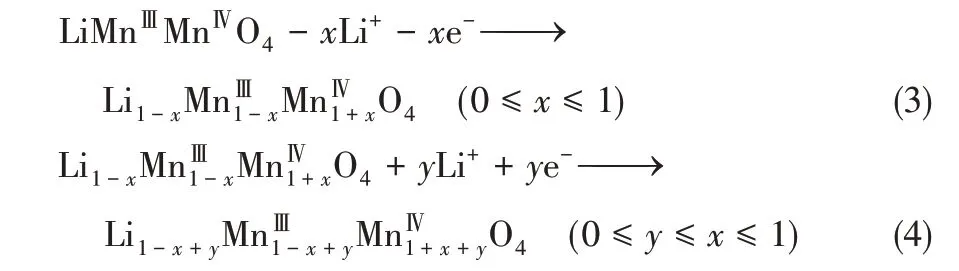
LiMn2O4材料中Mn易溶损,导致其循环稳定性较差,研究者们通过改进其制备方法来提高其循环稳定性[23]。其制备方法主要为高温固相法和水热合成法[24]。高温固相法合成工艺较简单,适合大批量生产;水热合成法所得产品纯度较高,但操作较为复杂,批量生产受到规模限制。Xu 等[23]用高温固相法合成LiMn2O4粉末,将其与炭黑、PVDF 按照质量比8∶1∶1 进行混合后涂覆在铂片上制成LiMn2O4粉末电极,并用水热合成法制备了自支撑LiMn2O4膜电极。其制备路线是先在阴极电沉积制备Mn(OH)2,通过氧化得到Mn2O3,再在0.025mol/L LiOH 溶液中进行水热反应得到自支撑的LiMn2O4膜电极。对比两者的电化学提锂性能发现,由于高温固相法得到的LiMn2O4晶体中杂质成分较高,影响了电极的可逆反应,100 次循环后LiMn2O4粉末电极的Li+吸附量为理论值的60.5%,而自支撑LiMn2O4膜电极的Li+吸附量为理论值的82.6%。自支撑LiMn2O4膜电极表现出更好的循环稳定性。
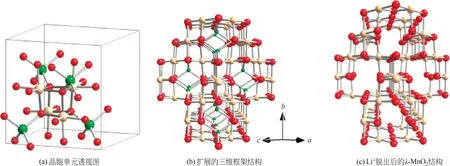
图2 尖晶石型LiMn2O4结构[22]
2.3 LiNi1/3Co1/3Mn1/3O2 电极
LiNi1/3Co1/3Mn1/3O2为层状结构,因其高的理论容量、高的充放电倍率和较好的循环稳定性,被认为是理想的正极材料,并被广泛应用[25]。此外,其在水溶液体系中表现出更快的充放电倍率性能,还具有良好的稳定性,1000 次循环后其容量损失仅有9.1%[26]。
Lawagon 等[27]将其应用于卤水体系中进行电化学提锂研究。层状LiNi1/3Co1/3Mn1/3O2电极的锂提取与释放过程示意如图3所示。在第一步的放电过程中Li+嵌入到电极中,而在第二步的充电过程中,Li+再次释放到溶液中。在复杂的卤水体系中,LiNi1/3Co1/3Mn1/3O2电极表现出对Li+的高选择性。最终获得的溶液中LiCl纯度达96.4%,且过程能耗仅为2.60W·h/mol Li+。
2.4 电极材料对比
基于已有主要研究,对于上述三种电极材料的提锂性能对比如表1所示。

图3 LiNi1/3Co1/3Mn1/3O2电极提锂过程[27]

表1 电极材料提锂性能对比
橄榄石结构的LiFePO4循环稳定性较好,但其电导率较低,提锂过程中所需的平衡时间较长,效率较低。LiMn2O4制备较为简单且价格较低,但其在离子嵌脱过程中出现的晶格结构变化使其循环稳定性较差。LiNi1/3Co1/3Mn1/3O2具有较快的离子嵌脱速率和循环稳定性,但其制备条件要求较为苛刻,成本较高。针对目前各电极材料存在的优缺点,通过电极掺杂、包覆等方法对电极材料进行改性,进一步开发出兼具良好选择性、吸附容量、吸附效率及循环稳定性的新型电极材料,将对电化学提锂技术的发展及应用起到巨大的推动作用。
3 电化学提锂体系
除了电极材料外,电化学提锂体系的构建对电化学提锂的设备成本、提锂效率和能耗都有着关键的影响。因此,研究者们尝试通过改进电极体系来促进电化学提锂的发展。
3.1 金属对电极体系
3.1.1 Pt对电极体系
Kanoh 等[31]于1993年首次提出利用电化学方法从水溶液中提取Li+资源,组成Pt/λ-MnO2体系进行提锂,λ-MnO2的嵌锂容量达到11mg/g。
以λ-MnO2为阴极时发生还原(嵌锂)反应为式(5)。

以λ-MnO2为阳极时发生氧化(脱锂)反应为式(6)。
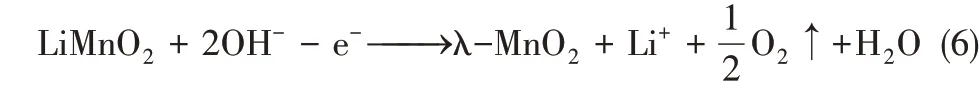
因Pt 电极为惰性电极,故提锂过程会产生水解副反应,使其能耗偏高,并产生气体副产物。此外,溶液的pH 条件需进行严格控制,以防止共存Mg2+结垢现象的发生。为避免电解水副反应的发生,能捕获阴离子的对电极被开发,其中Ag/AgCl电极因其与Cl-能发生良好的氧化还原反应而得到广泛应用。
3.1.2 Ag/AgCl对电极体系
由于Ag/AgCl 电极较为稳定的氧化还原电势及良好的Cl-结合和释放性能,避免了电解水副反应的发生,大大降低了过程能耗,提升了电极的循环稳定性,从而使得Ag/AgCl 对电极体系广泛发展。Pasta 等[32]于2012 年开发了一种由捕获Li+的电极(LiFePO4)和捕获Cl-的电极(Ag)组成的LiFePO4/Ag电极体系来进行提锂过程,主要包括四个步骤,如图4所示。
第一步,将FePO4电极和Ag 电极放入原料液中,将两电极短接,FePO4发生还原(嵌锂)反应,Ag 电极发生氧化(嵌氯)反应,实现氯化锂的提取,具体反应如式(7)所示。
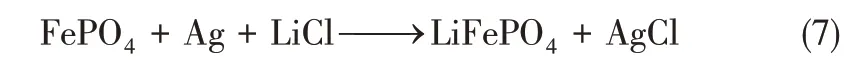
第二步,将反应结束得到的LiFePO4和AgCl放入50mmol/L的KCl回收液中。
第三步,以LiFePO4为阳极、AgCl 为阴极,在两电极间加入正向直流电场。LiFePO4发生氧化(脱锂)反应,AgCl发生还原(脱氯)反应,实现LiCl的释放,具体反应如式(8)所示。

图4 LiFePO4/Ag电极体系提锂原理[32]

第四步,将反应结束后得到的FePO4和Ag 电极再次放入原料液中,进行第一步反应。
如此重复以上四个步骤,可实现LiCl的选择性提取。由于步骤一为自发反应过程,因此其不仅不需要消耗能量,还可以释放能量,其能耗分析如图5所示。由于步骤一为释放能量的过程,步骤三为消耗能量过程,因此每次循环过程需要消耗的能量为图5中阴影部分的面积。
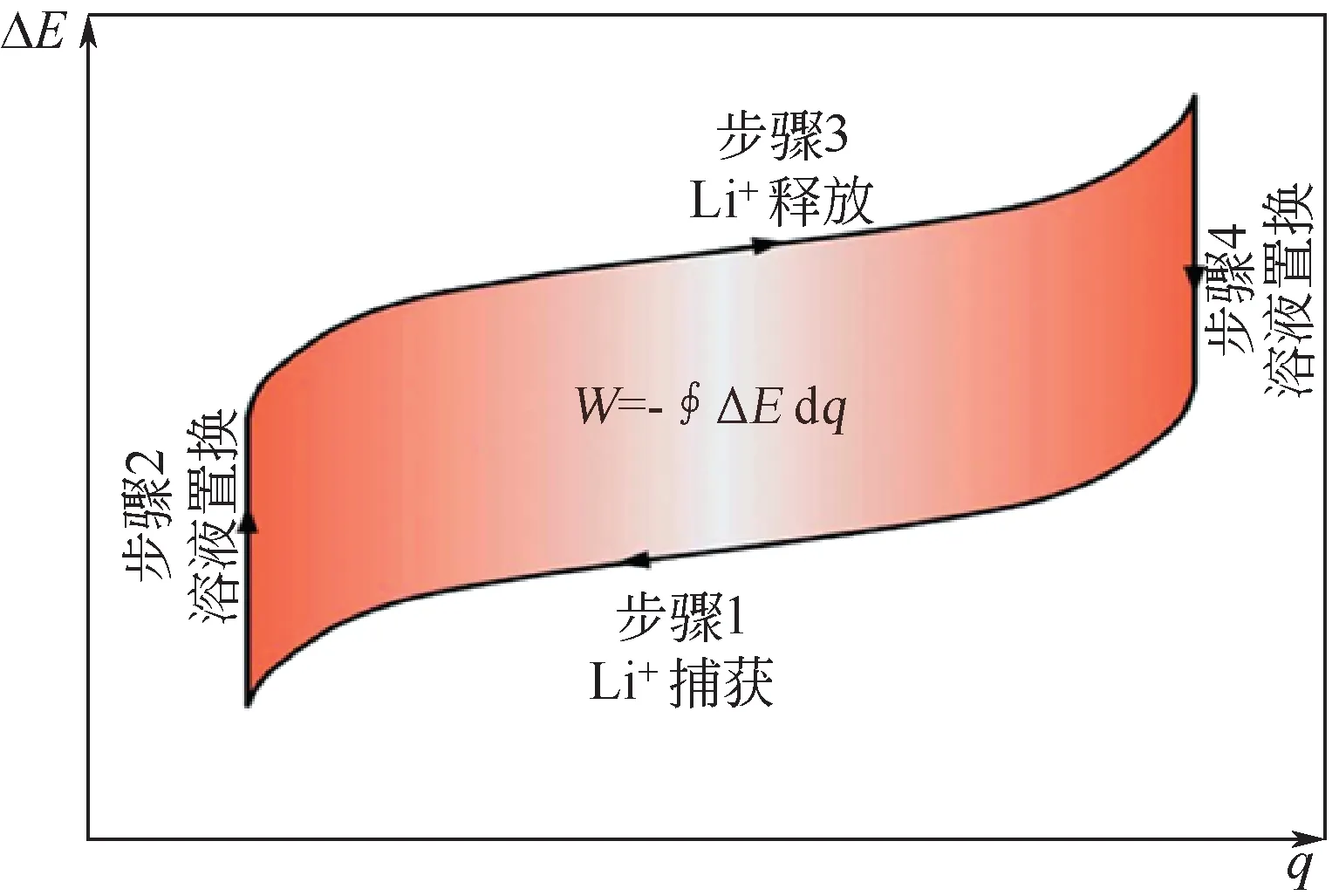
图5 LiFePO4-Ag电极体系提锂过程能量消耗[32]
LiFePO4电极对Li+表现出了较高选择性,LiFePO4/Ag 电极体系可实现将Li∶Na=1∶100 的卤水中Li+的选择性提取,得到Li∶Na=5∶1 的溶液,且其能耗仅为144W·h/kg Li。
此外,Jaehan[33]和Lawagon 等[27]分别于2013 年和2018 年开发了λ-MnO2/Ag 和Li1-xNi0.33Co1/3Mn1/3O2/Ag体系用于混合溶液中锂资源的回收,也达到了避免水电解的低能耗锂提取反应过程。但贵金属Ag 电极的使用限制了该电化学提锂体系的应用及发展。因此,为进一步降低电化学提锂设备成本,具有经济性的其他对电极体系逐渐被开发。
3.1.3 Zn对电极体系
Zn 电极相较于Ag 电极而言价格较为低廉,且具有较为稳定的氧化还原电势。Kim 等[30]构建了LiMn2O4/Zinc 体系来实现LiCl 的选择性回收,其提锂过程示意如图6所示。
如图6(a)所示,电化学提锂装置由阴离子交换膜分隔为两个室,λ-MnO2电极置于左侧原料液中,Zn 电极置于右侧ZnCl2溶液中。在锂提取过程中,将两电极进行短接,则λ-MnO2进行嵌锂过程,同时Cl-从原料液中向右迁移至右侧,Zn 被氧化为Zn2+。其反应方程如式(9)所示。

在氯化锂的回收过程中其反应过程如图6(b)所示,在LiMn2O4和Zn 电极间施加正向直流电场,LiMn2O4发生氧化反应,Li+从电极上脱出到溶液里;左侧溶液中Zn2+发生还原反应,被还原为Zn 单质。其反应方程如式(10)所示。

λ-MnO2电极对锂表现出了较高的选择性,如图6(c)所示三次循环后,原料液中Li+浓度的增加量远大于其他杂质离子;同时,如图6(d)所示,电极显示出较强的循环稳定性,在100次循环后,其嵌锂容量保持初始容量的73%。锂回收过程能耗为6.3W·h/mol Li。此外,电极对锂的选择性系数随电流密度的增加而降低,在电流密度分别为0.5mA/cm2、0.75mA/cm2和1.0mA/cm2条件下,其选择性系数分别为14.4、9.2 和6.6;并且随着电流密度的增加,更多的杂质成分获得能量嵌入λ-MnO2电极中。
3.2 非金属对电极体系
3.2.1 活性炭对电极体系
为替代贵金属甚至金属对电极,Kim 等[34]用活性炭电极代替了Ag 电极,组成λ-MnO2/活性炭体系(如图7),降低了设备成本。在活性炭阴极表面负载一张阴离子交换膜以避免充电过程中Li+的嵌入;在阳极和阴离子交换膜中间加一张尼龙隔网组成水通道。

图6 LiMn2O4/Zinc体系提锂过程[30]
λ-MnO2/活性炭体系提锂过程原理如图8(a)所示。其提锂过程分为两步:放电过程即锂的提取过程,Li+嵌入到λ-MnO2中,Cl-嵌入到活性炭电极中;充电过程即锂的回收过程,Li+和Cl-分别从LiMn2O4和活性炭电极中脱出,而阴离子交换膜阻挡了Li+嵌入到活性炭电极中,提高了提锂效率。图8(b)为充放电过程中离子浓度变化。在放电和充电过程中,Li+浓度分别呈现出了明显的下降和上升趋势,而杂质离子的浓度没有出现明显变化,从而实现了锂选择性提取的目的。此外,该电极体系在循环50 次后,其库仑效率仍保持在97%以上,电极对Li+选择性没有下降,表现出了优异的循环性能。

图7 λ-MnO2/活性炭体系提锂装置[34]

图8 λ-MnO2/活性炭体系提锂过程原理和离子浓度变化[34]
3.2.2 聚吡咯对电极体系
聚吡咯(polypyrrole,PPy)是一种高分子导电聚合物,由于其存在共轭π键,电子可以在聚合物链上进行自由转移,因此具有良好的导电性,常用来做电极吸附材料或电极材料的改性[35-36]。此外,PPy在氧化还原过程中还具有优异的Cl-可逆交换特性[37]。如图9 所示,PPy 在还原过程中会释放Cl-;在氧化过程中会吸附阴离子,并表现出阴离子可逆交换性能。
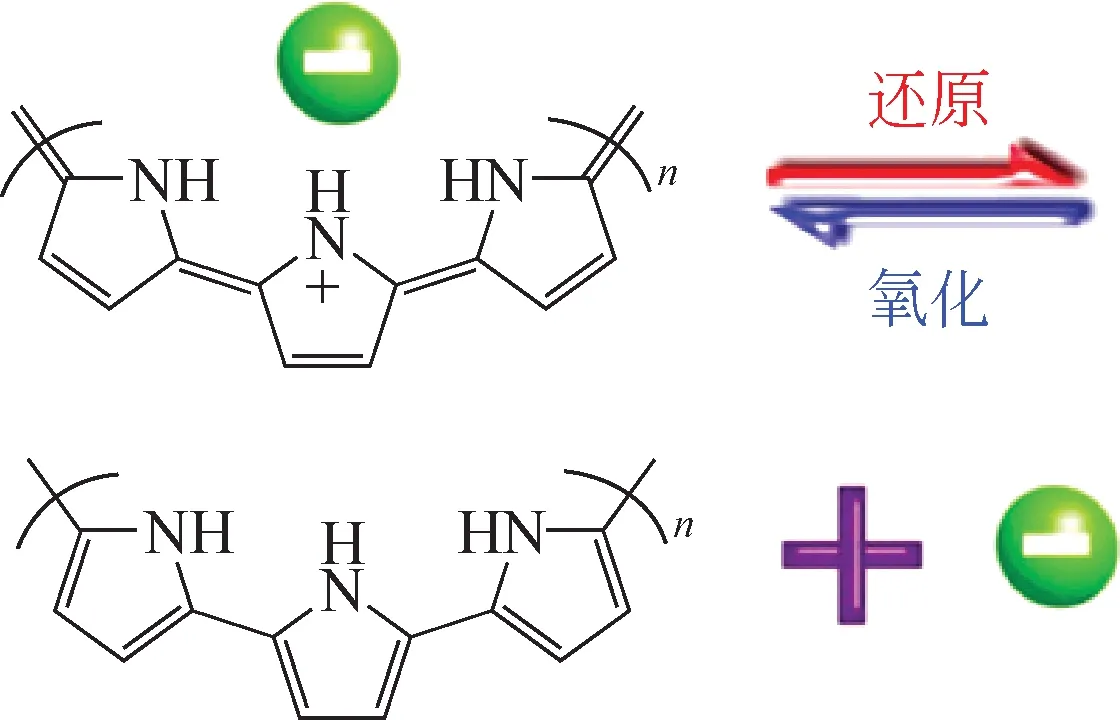
图9 PPy的阴离子交换机理[37]
基于PPy 的上述特性,Calvo 等[38-40]开发了LiMn2O4/PPy 电极体系来实现LiCl 的回收,其提锂过程如图10所示。

图10 LiMn2O4/PPy电极体系提锂过程[40]
两电极的反应分别如式(11)和式(12)所示。其中,图10 左侧反应为式中的正向反应过程,右侧反应为式中的逆向反应过程。

总的反应方程为式(13)所示。

该反应过程的反应电势低于1V,在200次循环后充电效率保持50%,且其能耗为1mol Li 5~10W·h。
上述电化学提锂过程均使用了其他材料的对电极,单次只能进行锂的提取或回收单一过程,提锂效率较低。为避免对电极的使用,提高提锂效率,研究者们开发出了“摇椅式”电化学提锂体系。
3.3 “摇椅式”电极体系
“摇椅式”电极体系是将富锂态电极和贫锂态电极组成电极体系。两电极分别置于由阴离子交换膜分隔的回收室和原料室内,通过施加正向电场,富锂态电极进行氧化(脱锂)反应,贫锂态电极进行还原(嵌锂)反应,实现脱锂与嵌锂过程的同步进行,提高了提锂效率。
3.3.1 LiFePO4/FePO4电极体系

图11 LiFePO4/FePO4电极体系提锂原理[42]
中南大学赵中伟教授团队[41-42]于2013 年开发LiFePO4/FePO4电极体系(如图11)来实现氯化锂溶液的选择性提取。电解槽被阴离子选择性交换膜分隔为两个隔室:将LiFePO4电极置于回收溶液(0.5mol/L NaCl)中,FePO4置于原料液(含锂卤水)中。在电场下,LiFePO4阳极发生氧化(脱锂)反应,阴极发生还原(嵌锂)反应。该过程中原料液中的阴离子(Cl-)会跨过中间的阴离子交换膜迁到回收液中,具体反应如式(14)和式(15)所示。
LiFePO4(阳极)

FePO4(阴极)

反应结束时LiFePO4电极和FePO4电极分别转变成FePO4和LiFePO4电极。将两电极进行位置调换,然后重复上述过程,即可实现氯化锂的选择性提取。在纯的LiCl溶液中,其嵌锂量在10h达到最大值38.93mg/g LiFePO4,并将Mg/Li 为60 的卤水降到了0.45。此外,低的操作电压更有利于实现锂与杂质离子间的分离,高的操作电压则会使更多的杂质离子嵌入到电极中,从而使得电极对Li+的选择性下降。
3.3.2 LiMn2O4/Li1-xMn2O4电极体系
基于LiMn2O4良好的离子导电性和电子导电性,河北工业大学纪志永教授团队[29]开发了LiMn2O4/Li1-xMn2O4电极体系(如图12),并实现了LiCl的选择性提取。LiMn2O4阳极在直流电场作用下失电子,使得Mn(Ⅲ)被氧化为Mn(Ⅳ),Li+从LiMn2O4电极上释放到回收液中;Li1-xMn2O4阴极在电场下得电子,使得Mn(Ⅳ)被还原为Mn(Ⅲ),Li+从原料液中嵌入到电极中。当两电极分别完成其对应的嵌/脱过程后,将两电极位置进行颠倒,实现锂资源由原料液侧向回收液侧的转移。其阳极和阴极反应分别如式(3)和式(4)所示。此外,Liu 等[43]也围绕类似体系,就温度、离子浓度、电压等条件对提锂性能影响做了相应探究。

图12 LiMn2O4/Li1-xMn2O4电极体系提锂原理[29]
LiMn2O4/Li1-xMn2O4电极体系可以实现锂资源的高效选择性提取,在纯的LiCl溶液中其提锂量达到34.31mg/g LiMn2O4。共存离子对提锂性能的影响顺序为Mg2+>Na+>Ca2+>K+,其影响顺序由离子半径大小和离子价态共同决定,小的离子半径更利于嵌入到电极内部;同时,价态高的离子需要克服更大的水和自由能去水化进入到电极中,从而使得嵌入过程更加困难[44-45]。此外,低的操作电压更利于实现锂与共存离子间的分离,与其他研究结果一致[28,30]。在模拟的卤水提锂中,其Li+/Na+、Li+/Mg2+和Li+/Ca2+分别上升300倍、70倍和110倍;在模拟浓海水提锂过程中,其Li+/Na+、Li+/Mg2+和Li+/Ca2+分别上升360 倍、90 倍和105 倍,电流效率达86%。该电极体系可实现卤水/浓海水中锂的高选择性回收,但目前其提锂能耗(约为20W·h/mol Li)相较于含其他对电极材料还偏高。因此,需要通过提锂过程及装备设计优化进一步降低其过程能耗,提高其提锂性能。
4 结语
电化学提锂技术是对传统提锂方法的发展,在低品位、复杂共存离子的溶液体系下表现出显著优势。其中,锂吸附电极材料及其电化学提锂体系设计是影响电化学提锂性能的两个关键因素。对于复杂体系中锂资源的提取,锂吸附电极材料的选择依据主要是吸附容量、选择性和循环稳定性。目前,LiFePO4、LiMn2O4和LiNi1/3Co1/3Mn1/3O2三种电极材料应用最为广泛。电化学提锂体系的设计原则主要为设备成本、提锂效率和单位能耗等。目前,相比于其他材料对电极体系,“摇椅式”电极体系因其避免对电极的使用,降低了设备成本,提高了提锂效率而具有一定优势,但其能耗较含对电极体系还偏高。
电化学提锂技术目前还存在着一些问题需要被进一步研究解决。针对电极材料的制备,如何在电极制备过程中防止活性物质流失的同时避免过度包埋,如何克服锂的交换容量较低、电极循环性能较差和高的操作电流/电压会使得电极对锂的选择性下降等不足;针对提锂体系和装置设计及提锂过程,目前“摇椅式”电极体系能耗还偏高,需进一步优化装置设计及提锂过程以降低能耗,提高提锂性能。因此,电化学提锂技术后续需要在以下几个方面继续开展深入系统的工作。
(1)通过调整黏结剂的种类和用量以及功能材料负载量等条件来优化电极制备工艺,在降低乃至防止活性物质流失的同时避免功能材料的过度包埋,以保障乃至进一步提升电化学提锂效率。
(2)通过电极改性(如掺杂或包覆)制备新型电极材料,提高电极对锂的交换容量、选择性和循环性,并克服电极在高的操作电流/电压条件下选择性下降的不足。
(3)通过电极材料结构参数的变化,探究电极材料的物性参数对提锂性能的影响机理,为后续电极材料的设计提供指导。
(4)通过系统探究共存离子及操作条件对提锂动力学过程的影响,指导优化电化学提锂过程。
(5)通过对电化学提锂设备进行优化,提高提锂过程的自动化水平,提升其提锂效率,推进电化学提锂的工业化应用进程。

