苹果砧木M26和M9-T337组培快繁体系的建立
成思琼,颜 盟,梁 彬,韩秀清
(1.杨凌新世界组培有限公司,陕西 杨凌 712100;2.陕西省果业研究发展中心,陕西 杨凌 712100;3.陕西新世界果业集团有限公司,陕西 杨凌 712100)
目前,世界现代苹果产业发展的趋势是无毒、矮化、自根[1]。使用矮化砧木是实现苹果矮化密植栽培效果最为显著、应用最广泛的一种途径[2]。近年来,苹果矮化自根砧因其树体矮小,适于密植,且具有早果、丰产、优质、果品均一性好等优点,在世界各国得到广泛的应用[3]。砧木M9与M26作为应用较广的苹果主要矮化砧木,其在生产上需求量较大。但是,苹果砧木M9和M26的繁殖,还存在繁殖系数低、扦插生根难、试管苗成活率低且难于生根等问题[4],严重的影响了苹果良种化和产业化进程。而组织培养技术为苹果砧木快繁开辟了新的途径。我国的植物组织培养水平居世界领先地位[5-7],已有大量的苹果砧木及新品种通过组织培养途径建立了快繁体系[8-10]。王淼淼[11]等研究发现苹果矮化砧木“矮砧6号”适宜增殖培养的植物生长调节剂配比为6-BA 1.0 mg·L-1+NAA 0.05-0.1 mg·L-1,增殖系数可达到每4周4.53倍;适宜组培苗生根的植物生长调节剂为IAA 1.0 mg·L-1+IBA 0.4 mg·L-1,平均生根率为90%以上,平均生根数为6条,根系发达,移栽后成活率达90%以上;孙清荣等[12]以苹果抗寒半矮化砧木“54-118”为试材,研究发现,无菌苗的适宜增殖培养基为QL+6-BA 1 mg·L-1+IBA 0.3 mg·L-1+30 g·L-1蔗糖,增殖系数为5.1,适宜的生根培养基为1/4MS+ IBA 0.5 mg·L-1+20 g·L-1蔗糖,生根率为77.9%,平均每株根数为3.5;杨艳敏等[13]研究发现对于品种“马克9”,最佳诱导、增殖和生根培养基分别为MS+6-BA 1.5 mg·L-1+NAA 0.1 mg·L-1、6-BA 0.8 mg·L-1+NAA 0.1 mg·L-1和1/2MS+IBA 0.5 mg·L-1+NAA 0.3 mg·L-1,诱导率为85.7%;对于品种“辽砧2号”,最佳诱导和增殖培养基分别为MS+6-BA 1.5 mg·L-1+NAA 0.1 mg·L-1、6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1诱导率为87.5%,最佳生根培养基同“马克9”;对于品种“GM265”,最佳诱导和增殖培养基分别为MS+6-BA 1.0 mg·L-1+NAA 0.1 mg·L-1、6-BA 0.8 mg·L-1+NAA 0.1 mg·L-1,诱导率为78.5%,最佳生根培养基同“马克9”。笔者试验研究苹果砧木M9与M26的离体培养,总结系统的组培快繁体系,以期为工厂化育苗提供可靠的技术和理论依据。
1 材料与方法
1.1 材料
苹果砧木M9-T337、M26,均由杨凌新世界组培有限公司种质资源圃提供。选择生长健壮且无病虫害的一年生枝条为试材,使用时只选取幼嫩新梢的茎尖2~3 cm。
1.2 方法
试验在杨凌新世界组培有限公司组培实验室及驯化温室内进行。基础培养基为MS和WPM,生长调节剂主要有BA、IBA、IAA、NAA、GA等,培养基灭菌条件为122℃、20 min,培养室内温度均为24±2℃,光照强度1 500~2 000 lx,光照时间16 h·d-1。
1.2.1 外植体消毒方法 4~5月份从种质资源圃选取两个砧木的新稍或带腋芽的茎段,去掉大叶,剪成2~3 cm长,置于培养瓶中。在超净工作台上,先用75%的酒精处理30 s,再用1%的次氯酸钠处理10、12、15 min或0.1%升汞处理5、8、10 min,用无菌水冲洗4-5次,然后用无菌滤纸吸干表面水分,用手术刀切掉变褐损伤部分,茎段长度大致为1~2 cm,每个茎段带1~2个腋芽,接种于初代培养基中(MS+6-BA1.0 mg·L-1+IBA0.5 mg·L-1+蔗糖30 mg·L-1+琼脂6.5 mg·L-1,PH5.8),每个处理接种30个外植体,重复3次,置于培养室内培养,接种25 d后统计污染率、褐化率及成活率。
污染率(%)=污染数/接种数×100%;
褐化率(%)=褐化数/接种数×100%;
成活率(%)=成活数/接种数×100%。
1.2.2 初代培养基的筛选 初代基础培养基为MS+蔗糖30 mg·L-1+琼脂6.5 mg·L-1,pH5.8,另附加激素6-BA(0.5,1.0,1.5 mg·L-1)+NAA(0.01,0.025,0.05 mg·L-1),以及6-BA(0.5,1.0,1.5 mg·L-1)+IBA(0.3,0.4,0.5 mg·L-1),在上述添加不同激素配比的MS培养基上进行外植体建立,每个处理接种30个外植体,重复3次。
1.2.3 继代培养基的筛选 经过初代培养获得的外植体,即可接种在继代培养基上进行增殖培养,继代基础培养基为MS+蔗糖40 mg·L-1+琼脂6.5 mg·L-1,PH5.8,另附加激素6-BA(0.3,0.5,0.75 mg·L-1)+NAA(0.05,0.1,0.15 mg·L-1),以及6-BA(0.3,0.5,0.75 mg·L-1)+IBA(0.3,0.4,0.5 mg·L-1),在上述添加不同激素配比的MS培养基上进行继代培养,每个处理接种30个外植体,重复3次,25d后调查芽的生长状况,统计增殖率。
增殖率(%)=增殖茎尖数/接种茎尖数×100 %。
1.2.4 生根培养基的筛选 选生长健壮、长势一致、高度1.5 cm左右的继代苗,接种到生根培养基上进行生根培养,新梢接种后置于黑暗下培养5 d,此后正常光下培养[3]。生根培养基为1/2MS(WPM)+蔗糖25 mg·L-1+琼脂6.5 mg·L-1,PH5.8,另附加激素IBA(0.3,0.5,0.75 mg·L-1)+IAA(0.3,0.5,0.75 mg·L-1),在上述添加不同激素配比的培养基上进行生根培养,每个处理接种30个继代苗,重复3次,接种20 d后统计生根率、生根数和生根长度。
生根率(%)=长出根的试管苗数/接入的试管苗数×100%;
平均根条数(条/株)=长出根的总条数(条)/接入的试管苗数(株)。
1.2.5 驯化炼苗 驯化炼苗分为闭瓶炼苗和开口炼苗两个阶段。
闭瓶炼苗:把生根15 d左右的试管苗搬入温室进行驯化,控制温度在22~25℃,光强在4 000~8 000 lx,闭瓶炼苗10~15 d后,先松盖通气后揭盖,逐步适应外界环境,一般换气时间为3~5 d。
开口炼苗:揭盖后继续炼苗3~7 d,期间根据天气情况喷0.1%的CaCl2溶液,使叶片适应低湿环境。前期需要遮阳,将光照控制在4 000~8 000 lx,试管苗茎干微呈红色,叶大而浓绿,根系木质化时开始移栽。
1.2.6 移栽及栽后管理 从瓶内取出经过锻炼的生根试管苗,除去根部的培养基,移栽到营养钵中,置于温度25℃左右,光照6 000~8 000 lx的温室或塑料大棚中。移栽基质选用下层2/3基质,上层1/3蛭石,移栽后立即用0.1%多菌灵溶液浇透,以杀菌保湿,最后搭小拱棚覆盖,遮荫。以后每3 d喷1次多菌灵溶液,移栽后1周左右通风,增强光照,控制温度不宜过高过低,有助于促进试管苗缓苗,早进入速生期,减少病害,提高成活率。
1.3 数据处理
试验数据采用Excel 2010进行处理,使用SPSS18.0进行统计学分析,处理之间的比较采用单因素方差分析(Duncan,P<0.05)。
2 结果与分析
2.1 不同消毒方法对外植体诱导分化的影响
从表1可知,随着消毒剂处理时间的延长,M26和M9-T337污染率呈下降趋势,褐化率呈升高趋势;同一品种,0.1%HgCl2处理效果明显优于5% NaClO,但是处理时间越长,褐化率越高。5% NaClO处理时,诱导率在处理15 min时最高,分别为19.8%和18%;0.1% HgCl2处理时,诱导率在处理8 min时最高,分别为28.5%和31.2%,由此可见,升汞处理时间不宜太长,处理后对外植体的毒害比较大。综合比较,M26和M9-T337最佳的外植体消毒方法为0.1% HgCl2处理8 min。
2.2 不同激素及浓度配比对初代培养效果的影响
由表2可知,适宜浓度的6-BA和NAA及IBA激素配比可以诱导M26和M9-T337外植体的再生,但不同的激素组合对外植体的诱导率不同。随着6-BA浓度的提高,诱导率呈升高趋势,在1.0 mg·L-1时,诱导率最高。此后随着6-BA浓度的升高,诱导率逐渐下降。不同的激素组合,对外植体的诱导效果也不相同,6-BA浓度适宜的条件下,一定浓度范围内,外植体的诱导率随NAA和IBA浓度的增加而增加。M26最适宜的外植体建立激素组合为6-BA1.0 mg·L-1+NAA0.025 mg·L-1,芽诱导率最高为44.9%;M9-T337最适宜的激素组合为6-BA1.0 mg·L-1+IBA0.5 mg·L-1,芽诱导率最高为35.8%。
2.3 不同激素及浓度配比对继代培养效果的影响
由表3可知,不同浓度的 6-BA 处理对苹果品种和砧木继代培养的分化有显著差异,6-BA 浓度在0.3~0.75 mg·L-1的浓度范围内,分化系数随浓度增加而先升高后降低。当 6-BA的处理浓度为0.5 mg·L-1时,两个品种继代培养的分化系数均显著高于其它浓度处理。继代苗的高度受NAA和IBA浓度的影响比较大,由表3可知,IBA浓度0.5 mg·L-1时,M26和M9-T337继代苗最高,分别为1.79 cm和1.81 cm。M26最佳的继代培养激素配比为6-BA0.5 mg·L-1+NAA0.05 mg·L-1,M9-T337最佳的继代培养激素配比为6-BA0.5 mg·L-1+IBA0.5 mg·L-1。
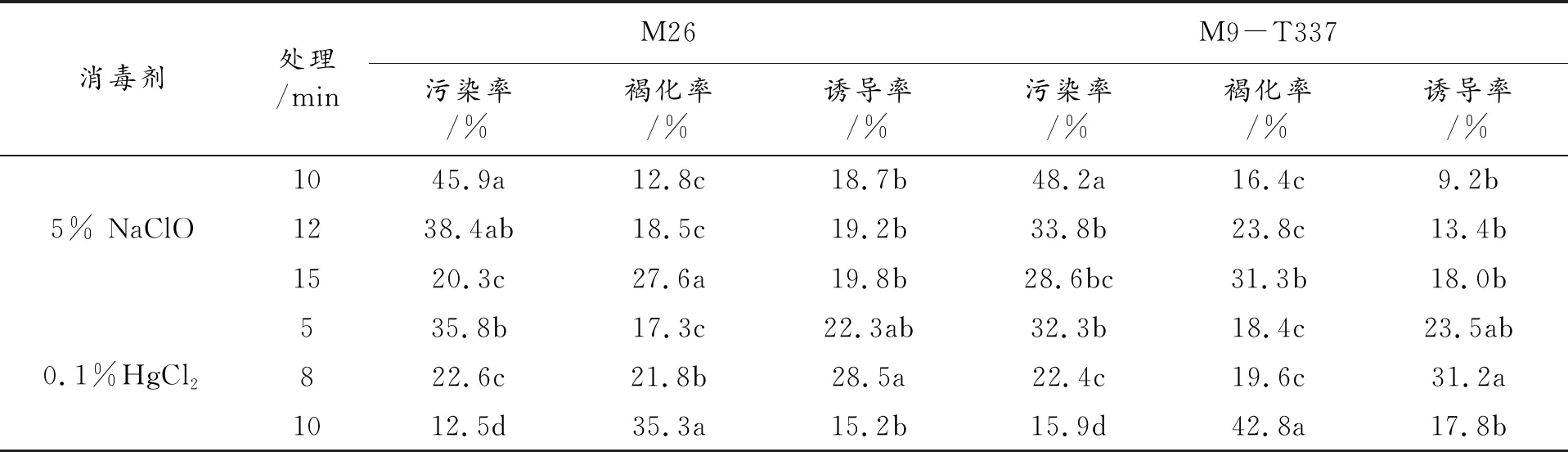
表1 不同消毒方法对外植体诱导分化的影响

表2 不同激素及浓度配比对芽诱导分化的影响

表3 不同激素及浓度配比对继代培养的影响

表4 不同激素及浓度配比对生根培养的影响
2.4 不同激素及浓度配比对生根培养效果的影响
由表4可知,不同的培养基种类,对苹果砧木M26和M9-T337生根效果的影响不同,当激素种类及浓度相同时,1/2WPM培养基生根效果优于1/2MS培养基的升高效果,生根率高,单株生根条数多,且愈伤组织比较小。适宜浓度的生长素可以促进根的生长。当IAA浓度为0.5 mg·L-1时,生根率和单株生根数随着IBA浓度的增加呈现先增加后降低的趋势;当IBA浓度为0.5 mg·L-1时,生根率和单株生根数随着IAA浓度的增加也呈现先增加后降低的趋势。由此可知高浓度的生长素会抑制根的生长。M26和M9-T337最适宜的生根培养基均为1/2WPM+IAA 0.5 mg·L-1+IBA 0.5 mg·L-1。
3 结论与讨论
苹果砧木能够成功离体培养的关键在于建立外植体[14]。外植体的建立过程中,材料是否污染、取材时间、消毒方法及时间等因素都直接或间接的影响外植体建立[15]。笔者研究以M26和M9-T337的离体新稍进行初代培养,研究发现最佳的消毒方法为0.1% HgCl2处理8 min,最佳的初代培养基分别为MS+6-BA1.0 mg·L-1+NAA0.025 mg·L-1和MS+6-BA1.0 mg·L-1+IBA0.5 mg·L-1。
在苹果砧木M26与M9-T337试管苗增殖培养过程中,植物激素的种类和浓度是影响继代扩繁成功的关键,细胞分裂素的浓度尤为重要[16]。生长素与细胞分裂素对细胞生长分化具有协同作用,它们不同配比与不同量,对细胞分化起到至关重要的调节作用[2]。此外,培养基种类与基因型也是继代培养能否成功两个非常重要的因素[17]。试验得出M9与M26的最佳增殖培养基配方分别为MS+6-BA0.5 mg·L-1+NAA0.05 mg·L-1和MS+6-BA0.5 mg·L-1+IBA0.5 mg·L-1。
组培苗的生根需要一定时间暗培养来促进根原基的形成,孙清荣等[18]研究认为,暗培养5 d再转光下培养为诱导苹果矮化砧GM256试管苗生根的最佳培养条件。本研究在生根培养的过程中,新稍接种后置于黑暗下培养5 d,此后正常光下培养,生根效果好。培养基种类对组培苗的生根影响也很大,徐凌飞等[19]研究MS、1/2MS、1/3MS和1/4MS四种培养基对砀山酥梨试管苗生根的效应,得出1/4MS为其最适生根培养基。张庆田[14]研究发现基本培养基1/2WPM确实比1/2MS适合于苹果砧木M9的生根,在试管苗整个生根过程中,生长调节剂必不可少。三种生长素类物质的活性强弱顺序为NAA>IBA>IAA。周莉[20]研究发现,低浓度的NAA较IBA和IAA更利于苹果砧木的生根。本研究发现,M26和M9-T337最适宜的生根培养基均为1/2WPM+IAA 0.5 mg·L-1+IBA 0.5 mg·L-1。

