超声辅助复合酶法制备碎米多孔淀粉及结构比较
吴丽荣 叶兴乾 田金虎 张惠玲
(宁夏食品微生物应用技术与安全控制重点实验室;宁夏大学农学院1,银川 750021)
(智能食品加工技术与装备国家地方联合工程实验室;浙江省农产品加工技术研究重点实验室;浙江大学生物系统工程与食品科学学院2,杭州 310058)
淀粉是自然界中最丰富的碳水化合物之一,因其可再生性、低成本以及对环境压力较小而被广泛应用于造纸、纺织和食品等领域[1]。然而,天然淀粉小的表面积和孔体积等特性很少能满足食品和工业生产所需的特定物理化学性质[2, 3]。多孔淀粉作为一种具有高孔隙量、高比表面积及良好吸附性和分散性的改性淀粉可以满足许多工业食品的需求,因而备受关注[4,5]。例如,多孔淀粉作为一种理想的缓释材料,可吸附香料、甜味剂、酸性调味品、酶、调味剂等[6]。此外,一些材料如二十二碳六烯酸(DHA)、维生素A、胡萝卜素和姜黄素等在大气或光照下容易被氧化或分解,通过多孔淀粉吸附后可达到有效保护作用[7]。常用的多孔淀粉的制备方法包括化学法、生物法和物理法[8-10]。特别是酶法、超声法等制备的多孔淀粉具有绿色环保、工艺方便、性质优良等优点而备受青睐。然而,目前有关物理、生物方法复合制备多孔淀粉的研究还较少。特别是将大米淀粉采用超声预处理后,以复合酶解的形式制备多孔淀粉的研究还鲜见报道。本研究以稻米企业加工过程中低附加值碎米所提取的淀粉为原料,采用响应面法优化超声辅助复合酶法制备多孔淀粉的最佳工艺条件,然后通过扫描电镜(SEM)和X-晶体射线衍射(XRD)表征淀粉颗粒的微观结构及晶型结构,通过傅里叶红外光谱(FTIR)研究多孔淀粉的特征官能团变化,以期为后续的碎米高值化利用提供借鉴。
1 材料与方法
1.1 实验材料
碎米:宁夏昊王集团;碎米淀粉采用碱法进行提取[11];α-淀粉酶(BR)、糖化酶(液化型,10 U/mL);NaOH、Na2HPO4、C6H7O8(均为分析纯);D-GLUCOSE Megazyme;元宝牌大豆油。
1.2 仪器与设备
HC-3018R高速冷冻离心机;JY92-IIDN超声波细胞粉碎机;722N可见分光光度计;Gemini300扫描电子显微镜;XRD-7000衍射仪;NICOLET 6700红外光谱分析仪。
1.3 方法
1.3.1 碎米多孔淀粉的制备
精确称取10.0 g碎米淀粉,加入40 mL磷酸氢二钠-柠檬酸缓冲液调浆,超声处理一段时间。加入 α-淀粉酶和糖化酶,在恒温水浴锅中温和搅拌一定时间后,加入 4% 的NaOH溶液终止反应。将悬浮液在8 000 r/min的条件下离心5 min,去除上清液,用蒸馏水洗涤沉淀3次。沉淀置于50 ℃鼓风干燥箱中干燥直至恒重,研磨过100目筛。
1.3.2 吸油率的测定
精确称取烘干至恒重的淀粉0.50 g,记为m1,置于已知质量的离心管中,记为m2,用移液枪量取5 mL大豆油与淀粉混匀后静置30 min,在4 000 r/min的条件下离心20 min,将上层大豆油吸出,称取离心管和淀粉的总质量,记为m3[12]。按公式计算。
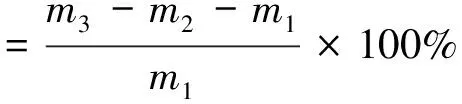
1.3.3 水解率的测定
根据武赟等[13]的方法略加修改,取淀粉水解后的上清液1.0 mL,加水稀释200倍。再取稀释后的上清液0.1 mL与3.0 mL GOPOD溶液于5 mL离心管中,对照组为0.1 mL D-GLucose标准品与3.0 mL GOPOD溶液,空白组为0.1 mL蒸馏水与3.0 mL GOPOD溶液,混合均匀后于45 ℃条件下预热20 min,冷却至室温后在510 nm处测定吸光值。
×100
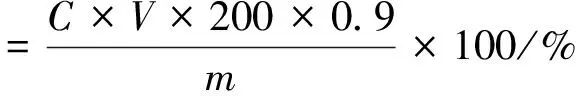
式中:C为D-Glucose质量浓度/mg/mL;V为反应体系中淀粉乳体积/mL;m为反应前淀粉质量/g;200为稀释倍数。
1.3.4 单因素实验
研究影响多孔淀粉吸附容量的反应条件,包括超声时间、超声功率、酶促反应温度、反应溶液的 pH、α-淀粉酶和糖化酶的质量比(酶配比)、酶与淀粉的总量的质量比(加酶量)和酶解时间7个因素,以吸油率和水解率为评价多孔淀粉制备效果优劣的的指标。初始实验条件为:超声时间30 min、超声功率400 W、酶解温度40 ℃、pH=4.0、α-淀粉酶∶糖化酶=1∶3、加酶量1.2%、酶解时间4 h,后续实验依次将前因素的最优值代入。
1.3.5 响应面实验设计
根据Box-Behnken设计原理,以超声时间、超声功率、加酶量、酶解时间4个因素为自变量,以吸油率为响应值,运用Design-Expert 8.0.6进行实验设计,因素水平编码见表1。

表1 Box-Behnken 设计因素水平
1.3.6 淀粉颗粒的结构表征
将原淀粉、超声处理淀粉和多孔淀粉粉末分别涂覆在粘附有双面胶带的样品架上,在真空状态下,用金溅射涂布机给样品涂覆一层薄薄的金层,在3 kV的加速电压下,通过SEM观察淀粉的形态特征[14]。
1.3.7 淀粉颗粒X-晶体射线衍射测定
根据Yang等[15]的方法略加修改,使用X射线衍射仪分析样品的结晶结构。样品于45 ℃烘箱中放置12 h。在40 kV和40 mA下用Cu-Kα辐射(K-Alpha1=1.540 598,K-Alpha2=1.544 426,K-Alpha2/ K-Alpha10.5)。发散狭缝固定为0.38 mm。扫描范围为4°~40°(2θ)。使用Origin pro 9.1整合峰。计算相对结晶度(Xc)。
Xc=Ac/(Aa+Ac)×100%
式中:Ac和Aa分别为X射线衍射图上的结晶区域和非晶区域。
1.3.8 傅里叶红外光谱分析
天然淀粉、超声处理淀粉和多孔淀粉的傅里叶变换红外(FTIR)光谱在NICOLET 6700光谱仪上进行测定。将2种样品与固体KBr粉末混合,并将约40 mg该混合物用于制备粒料。将KBr颗粒干燥并进行FTIR分光光度测定。以4 000~500 cm-1的波数记录透射率。
1.3.9 数据处理与统计分析
采用SPSS 24.0软件统计分析实验数据,采用Origin pro 9.1和Design-Expert 8.0.6 软件绘制图表。
2 结果与分析
2.1 多孔淀粉制备的单因素实验结果
图1为超声时间、超声功率、温度、pH、酶配比、加酶量和酶解时间对多孔淀粉水解率和吸油率的影响。只进行4 h酶解反应的多孔淀粉的吸油率只有64%左右,而超声预处理30 min再酶解相同时间的吸油率提高近10%。超声作用破坏了淀粉颗粒表面的水束层,有利于复合酶对淀粉的水解[16]。此外也可能是超声波导致淀粉一定程度的损伤或产生了孔隙,增大了酶-底物的界面面积,增加了二者的接触机会[17]。随着超声时间的延长,吸油率降低,水解率持续增大。原因在于超声时间过长,淀粉的损伤和孔隙变大,酶大量渗透到颗粒内部,淀粉过度水解,多孔出现坍塌,从而导致吸附性下降[4]。
随着超声功率的增大,吸油率先增大后减小,水解率一直增大。这是因为超声时会发生“空穴效应”,产生的剪切力可切断淀粉的长链,且超声波产生的自由基会攻击淀粉分子,导致α-1,4糖苷键断裂,为酶水解淀粉提供了更多的结合位点[18]。
吸油率随温度的升高先增大后减小。当温度低时酶活性较低,随着温度的升高,酶活性增加使水解程度增大,吸附能力增加。水解率增加,可能是因为淀粉因膨胀而使吸附量降低,淀粉颗粒的无定形区域因温度升高而受损,导致水解率显著增加[19]。
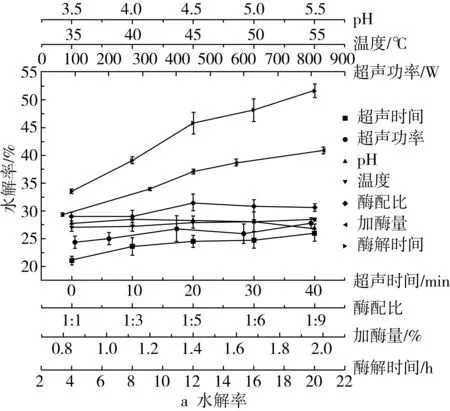
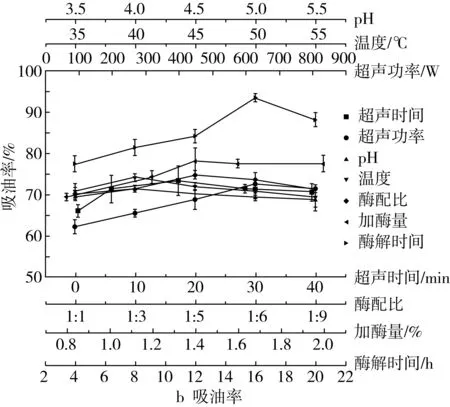
图1 不同影响因素对水解率和吸油率的影响
随着pH的增大,水解率和吸油率都先增大后减小,在pH=4.0时均达到最大值。当pH值改变时,酶的结构和底物的电荷性质可能会发生转变,使得底物不能与活性位点结合或不能进行催化[20]。
当α-淀粉酶∶糖化酶达到1∶5时,水解率和吸油率都达到最大值。α-淀粉酶是一种内切酶,可以随机水解淀粉的α-1,4糖苷键,而糖化酶是一种外切酶,不仅可以水解α-1,4糖苷键,还可以水解 α-1,6糖苷键[19]。酶配比在1∶5时吸油率和水解率值最大,表明此时两种酶协同效果最好。
当酶总量的增加时,吸油率先增加后减小,而水解率一直在增加。酶用量较小时,淀粉中只形成了小而浅的孔,主要是表面吸附。进一步增加酶量时,孔数量增多且孔洞增大,吸附容量增加,导致了水解率和吸油率的增大[10]。当酶的添加量继续增大时,大量的酶分子与底物结合,剧烈的水解破坏了淀粉的多孔结构,使淀粉的吸附能力反而下降。
随着酶解时间的增加,吸油率先增加后减小。这是因为在水解初期,随着反应时间的延长,孔隙量增加且变大变深,致其吸附量增加。当水解时间超过16 h,淀粉颗粒的多孔结构开始破碎并分解成许多小颗粒,小颗粒被水解后最终完全转化为葡萄糖,这种过度水解破坏了淀粉的多孔结构,因此淀粉的吸油率开始降低[21]。
2.2 响应面优化结果分析
结合单因素实验结果及淀粉与油不相溶的特性,吸油率的测试误差较小,可真实反映多孔淀粉的吸附能力[22]。因此吸油率更适合作为优化指标。以吸油率为指标,进行响应面实验设计并优化参数。实验设计及结果如表2所示。
运用Design-Expert 8.0.6软件对表2的实验数据进行多元回归拟合分析,得到二次多项回归模型:
吸油率=97.53-2.75×A+5.84×B+2.90×C-4.36×D-1.11×AB+1.07×AC+1.88×AD+0.13×BC-1.50×BD+1.50×CD-1.70×A2-1.30×B2-1.30×C2-3.13×D2
响应面结果的方差分析见表3。模型F值=4.57>0.05,P= 0.003 7<0.01,表明模型显著。而且B、D的影响极显著(P<0.01),A、C的影响显著(P<0.05),对吸油率影响的先后顺序是:超声功率>酶解时间>加酶量>超声时间。失拟项F值=2.52>0.05;P=0.193 8>0.05,表明未知因素对实验结果的影响很小,模型拟合程度较好,实验误差较小,可以用此模型说明各因素与响应值之间的关系。
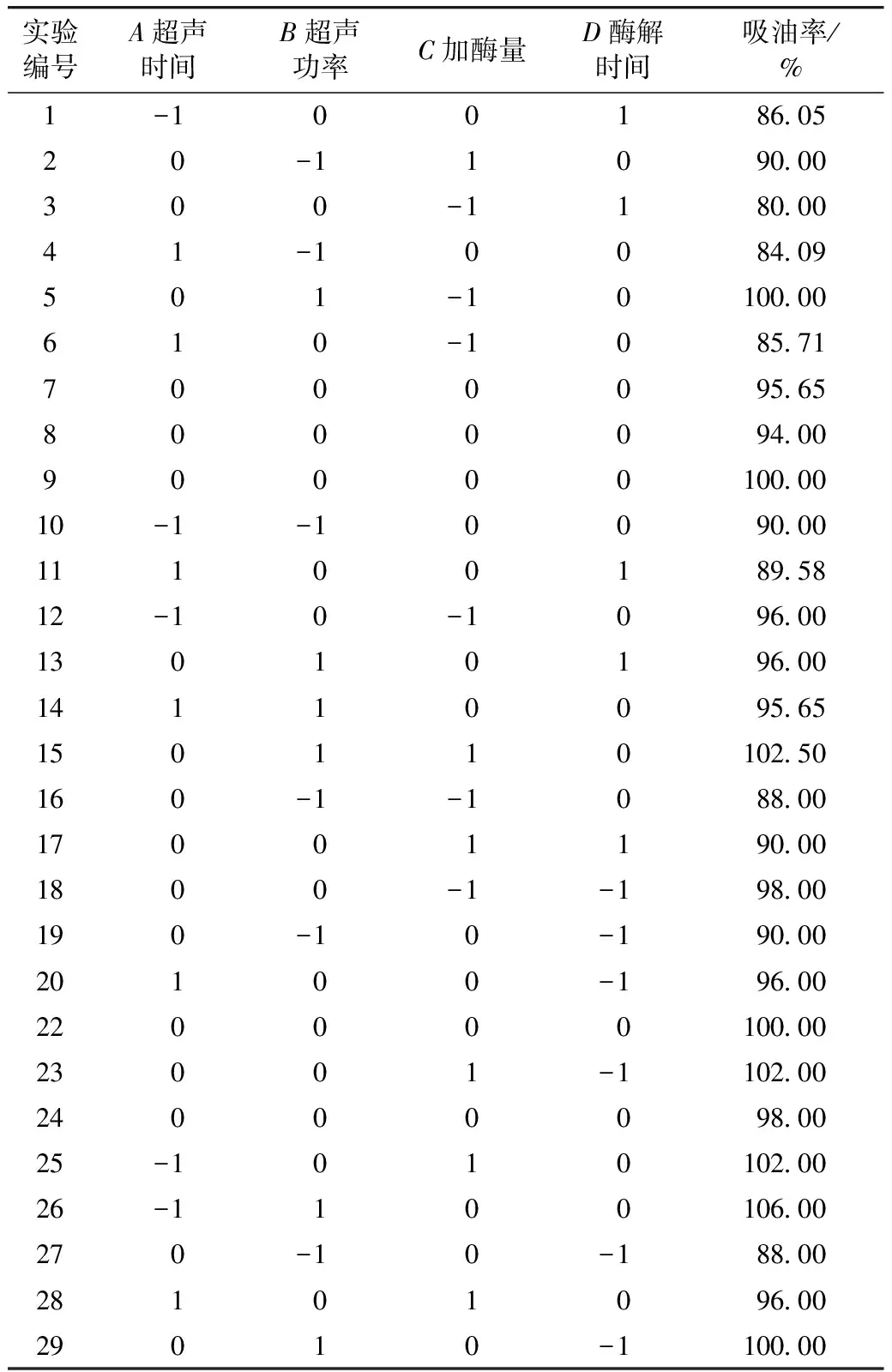
表2 响应面实验设计方案及结果
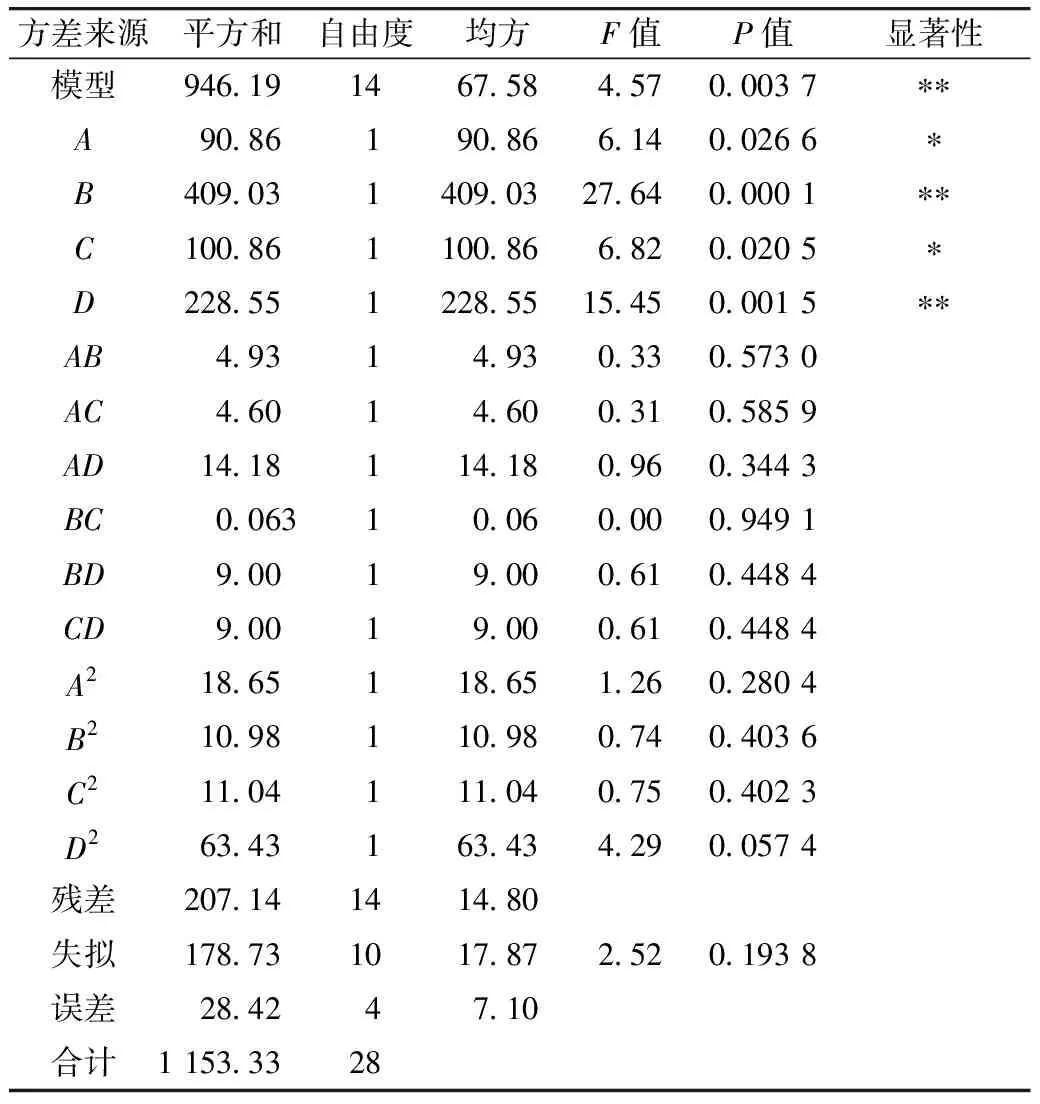
表3 吸油率回归方程方差分析
注: *为差异显著(P< 0.05),**为差异极显著(P<0.01)。
2.2.1 响应面分析
由图2可知,在选定的范围内,随着超声时间、超声功率、加酶量和酶解时间的增加,响应值吸油率都表现出了先增大后减小的趋势。当超声功率和加酶量过大,酶解时间和超声时间过长,碎米淀粉被充分水解,淀粉的孔隙结构被破坏,出现坍塌。对油的吸附性变差,导致吸油率降低。4个因素之间都有一定的交互作用,但是交互性不显著(P>0.05)。从等值线可看出,各因素中心点附近的吸油率值都比较高,说明此条件下的多孔淀粉的吸附性能较好。
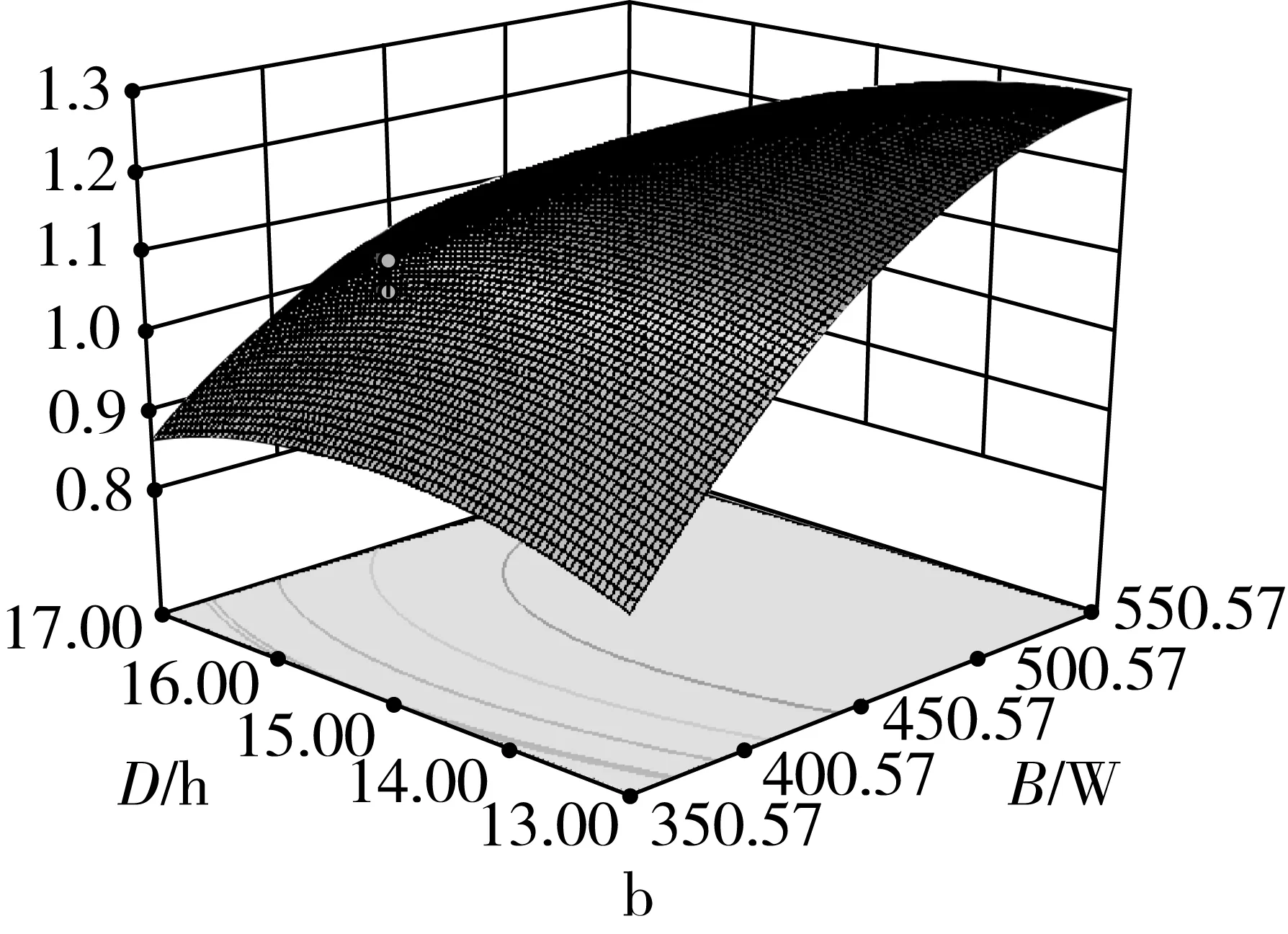

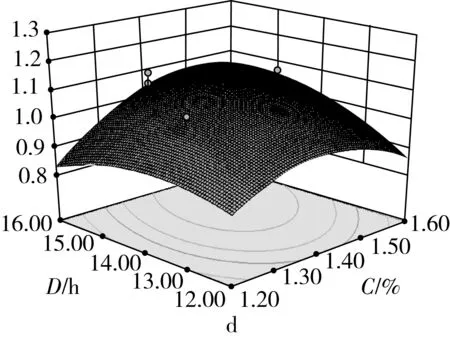

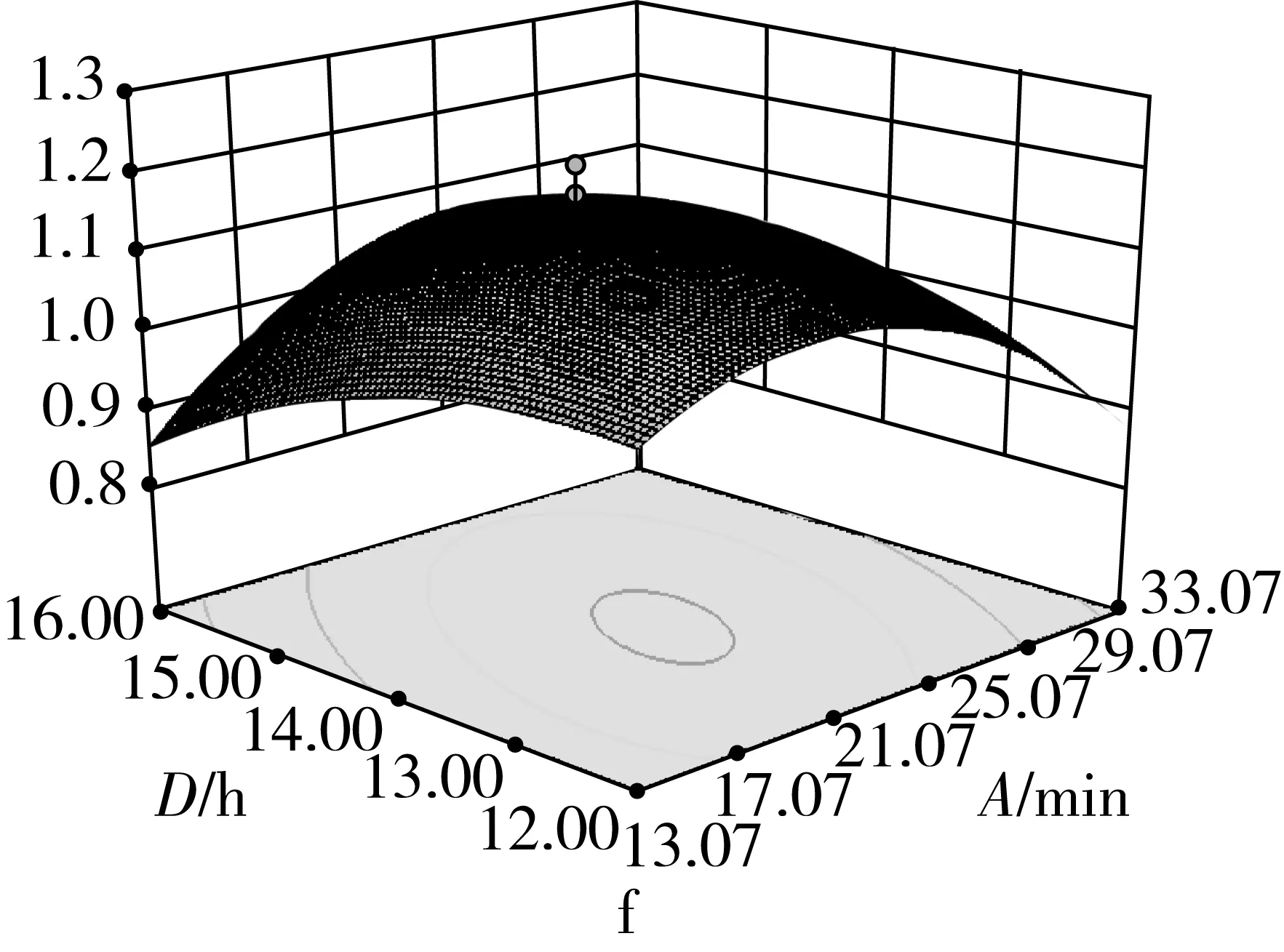
图2 不同因素间交互作用的等值线图
2.2.2 验证实验
用Design-Expert 软件的响应面优化实验结果,对各实验因子最优化分析后,得到的吸油率预测值为106%,此时A、B、C、D的值分别为25 min、450 W、1.43%、14 h。根据实验的实际可操作性,将优化条件的值调整为25 min、450 W、1.4%、14 h。以最佳条件做3组平行验证实验,结果见表4。实际吸油率值为105.33%,与预测值接近。充分验证了此模型的准确性。
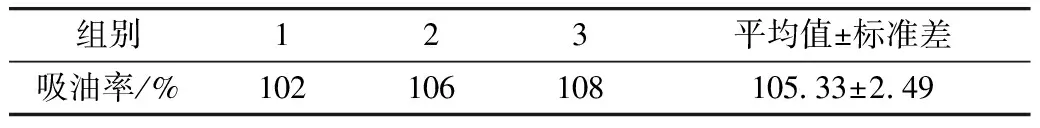
表4 验证实验结果
2.3 淀粉的表面形态观察
图3a是原碎米淀粉电镜图,天然淀粉表面光滑,呈不同锐度的不规则多边形形状。通过(450 W,25 min)超声处理后得图3b,发现淀粉颗粒表面出现了皱褶、裂纹和零星几个浅而小的凹陷的小坑,结果与Sujka等[23]的研究结果一致。而通过超声预处理后再经 α-淀粉酶和糖化酶酶解后获得了多孔淀粉图3c,发现其中大多淀粉均形成了相对均匀、较大且较深的孔。
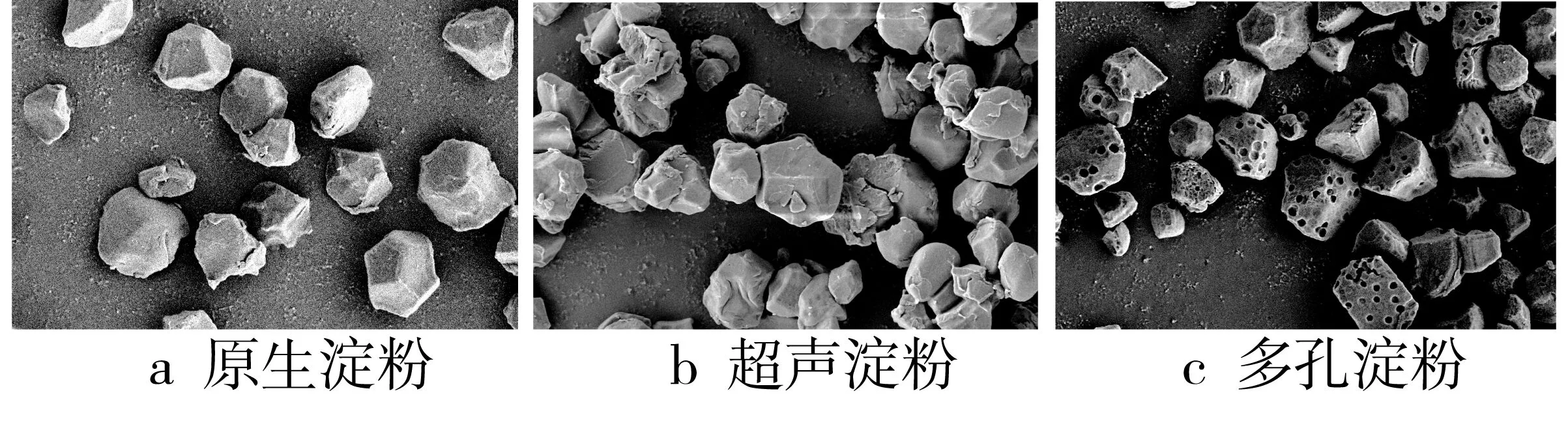
图3 淀粉的扫描电镜图
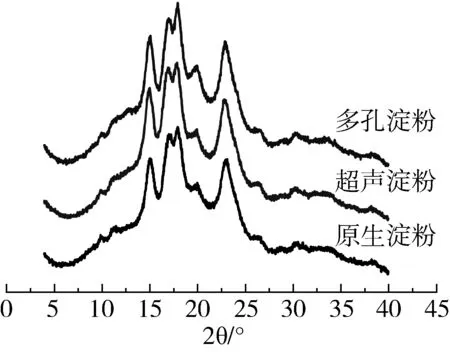
图4 原生淀粉、超声淀粉和多孔淀粉的X-晶体射线衍射图
2.4 X-晶体射线衍射分析
原生淀粉、超声处理淀粉和多孔淀粉的衍射图谱如图4所示。原淀粉的衍射峰在约15°和23°处出现强烈的衍射峰,并且在2θ的17°和18°附近显示出未解析的双峰,表明其结晶型是A型。此结果与Jiang等[24]报道结果一致。超声波处理淀粉和多孔淀粉都保持了A型结晶结构,Li等[25]和Zhu等[26]报道过相似的结果。原淀粉的结晶度为(33.67±1.5)%,酶解淀粉的结晶度为(34.94±1.5)%,略高于原淀粉。这是因为在酶解过程中无定形淀粉比结晶淀粉更容易被消化。超声处理淀粉结晶度为(31.08±1.5)%,略低于原淀粉。
2.5 傅里叶红外光谱图分析

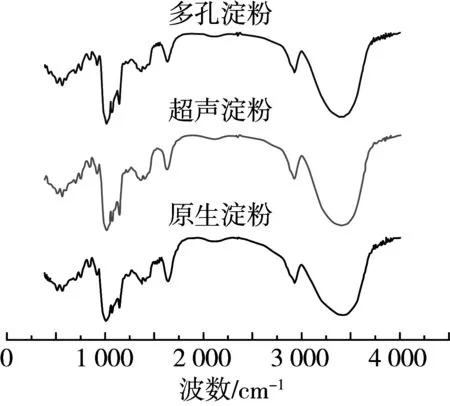
图5 原生淀粉、超声淀粉和多孔淀粉的红外光谱图
3 结论
一定强度的超声预处理有助于复合酶法制备多孔淀粉。超声辅助酶法制备碎米多孔淀粉的最佳工艺条件为:超声时间25 min,超声功率450 W,温度40 ℃、pH=4.0、酶配比1∶5(α-淀粉酶:糖化酶)、加酶量1.4%、酶解时间14 h,此条件下的吸油率为105.33%。因此,超声辅助酶法是一种制备碎米多孔淀粉的高效方法。通过SEM观察超声波处理后的淀粉表面出现了皱褶、裂缝和凹陷,酶解后的的淀粉表面出现了多而深且较大的孔。XRD结果表明,原淀粉、超声处理淀粉和多孔淀粉都是典型的A型结晶结构,超声处理和酶解并没有改变淀粉的晶体类型;同时,FTIR图谱表明这2种处理方式不会改变淀粉的化学结构。

