直肠癌患者外周血T细胞亚群与营养状况及短期预后 的相关性
陈若,张红雁
(安徽医科大学附属省立医院肿瘤放疗科,安徽 合肥)
0 引言
直肠癌是我国常见的消化道肿瘤之一,在全球所有恶性肿瘤发病率中位于第3位,死亡率高居第4位[1,2],且我国发病率以及死亡率逐年都有上升的趋势[3]。随着对疾病了解的日益深刻,直肠癌治疗全程化的管理越来越趋向精细化、个性化。因此,如何利用多学科综合治疗的优势来提高直肠癌患者生存率和生活质量、降低直肠癌的复发率,成为我国直肠癌临床研究中亟待解决的问题之一。
本研究通过观察直肠癌患者治疗前后营养风险筛查、营养状况,并通过流式细胞技术检测直肠癌患者围放疗期外周血CD4+T细胞、Treg细胞及CD4+/CD8+的变化情况,探索是否可以有基于血液的免疫相关生物标记物具有预测新辅助放化疗早期反应的可能,并同时可以预测患者预后生存情况。
1 资料和方法
1.1 病例的选择
选择安徽省立医院肿瘤放疗科2018年1月至2019年10月54例接受盆腔精确放射治疗的原发直肠腺癌患者。
1.2 入组标准
(1)病理为直肠腺癌的患者;(2)无严重心、肝、肾功能不全,无活动性全身感染,且无严重的消化系统疾病、营养代谢疾病和内分泌疾病病史;(3)未同时接受免疫治疗的患者;(4)无其他肿瘤以及放疗前CT、MRI等各项影像学检查提示未见远处器官转移;(5)按照术前(已行手术患者)或放疗前(未行手术患者)定位扫描时MRI分期,选择TNM分期为II-III期的患者;(6)自愿参加并签署知情同意书。本研究经安徽省立医院医学伦理委员会批准(伦理批件号:2019KY伦审第101号)。
1.3 排除标准
(1)有远处转移的患者;(2)曾合并其他恶性肿瘤的患者;(3)同时接受慢性系统性免疫治疗的患者;(4)患者依从性差,不能配合完成本研究的信息采集。
1.4 治疗方案
1.4.1 方案推荐
局部进展期直肠癌患者现推荐行“新辅助放化疗+手术”或“手术+辅助放化疗”,采用 6Mv-X线IMRT(intensity-modulated radiation therapy ,适形调强放疗)治疗,给予全盆腔照射,主要剂量分割方式为25 Gy/5f/1周和50 Gy/25f/5周。
1.4.2 靶区勾画
(1)术 前 靶 区 定 义:GTVnd(lymph node gross tumor volume,阳性淋巴结大体肿瘤体积)包含直肠MRI/盆腔CT显示的直肠系膜区、骶前区、髂总、髂内、闭孔以及髂外大于1cm的转移淋巴结和癌结节。CTVp(primary tumor CTV,原发肿瘤临床靶体积)特指原发灶的临床靶区,包括原发灶头脚方向外扩2cm的范围。CTV(clinical target volume,临床靶体积)为包括高危淋巴结引流区,部分髂总、髂内、髂外(下界到股骨头出现水平)、闭孔、骶前、直肠系膜区以及腹股沟淋巴引流区(视病人具体情况确定是否包括),PTV(plan target volume,计划靶体积)在CTVp和CTV基础上前后左右外放0.5-0.7cm。(2)术后靶区定义:包括瘤床、吻合口或会阴瘢痕、术后高危淋巴结引流区及高危复发区,部分髂总、髂内、髂外(下界到股骨头出现水平)、闭孔、骶前、直肠系膜区以及腹股沟淋巴引流区,PTV在CTV基础上前后左右外放0.5-0.7cm。正常组织限量:膀胱V50<50%,小肠V50<10%、最大剂量小于52Gy,股骨头V50<5%。
1.4.3 具体方案
本研究根据患者个体化情况,治疗方案分为3种:(1)术前短程大分割放疗(放疗后7-10天行手术)(2)术前常规分割放疗同步化疗(放疗后4-6周行手术)(3)术后常规分割放疗同步化疗(具体手术方式由外科医师决定,术后4周至6周行放疗)。同步化疗方案为卡培他滨(正大天晴/罗氏)化疗(卡培他滨剂量根据患者体表面积计算,用量为825mg/m2,一日两次,每周第一天至第五天服用)。
1.5 检测方法
于研究对象实施第一次放疗前一天、放疗计划结束后一天及放疗结束后一月抽取患者静脉血2mL,行血常规以及生活检测,并采用流式细胞术检测患者外周血T细胞亚群的占比 ,采用三激光10色法,检测患者血清CD4+T细胞占淋巴细胞百分比、Treg细胞占CD4+T细胞百分比以及CD4+/CD8+比值。
1.6 营养风险筛查
NRS2002评分1分:可通过口服来补充蛋白质需要量;NRS2002评分2分:患者需卧床,需要一定的肠外或肠内营养支持;NRS2002评分3分:通过肠外或肠内营养支持,可使患者机体内蛋白质分解和氮丢失明显减少。总分值≥3分,予以患者饮食指导。
1.7 随访
患者放射治疗后1月门诊或住院随访,记录体重数据,采集血常规、T细胞亚群、肿瘤标志物等血液学指标等,评估患者远期疗效包括局部控制率、无病生存率、无远处转移率及总生存率。
1.8 统计学处理
应用SPSS 22.0进行本研究资料分析。主要数据为多时点观测计量资料,以均值±SD描述,组间比较为单因素重复测量方差分析+组内各时点间两两比较差值t检验。检验水准α=0.05。
2 数据和结果
2.1 基本资料
54例直肠癌患者资料列于表1。其中,男性35例,女性19例;年龄为27-87岁,中位年龄为55岁,平均年龄为55.96岁;病理为高分化腺癌8例,中分化腺癌33例,低分化腺癌13例;根据美国癌症联合委员会(AJCC)制订的第8版TNM分期标准Ⅱ期14例,Ⅲ期40例。术前短程快速大分割放疗9例,术前常规分割放疗17例,术后常规分割放疗28例。
2.2 结果
详细数据汇总及比较见表2。分别为:
2.2.1 外周血免疫功能指标变化
外周血CD4+T细胞绝对值、Treg细胞绝对值放疗结束时较放疗开始时下降,放疗结束后一月较放疗结束时绝对值升高具有统计学意义。患者外周血CD4+/CD8+比值放疗结束时较放疗开始时升高,放疗结束后1月较放疗结束时绝对值下降,结果具有统计学意义(P<0.05)。
2.2.2 按照放疗结束后营养状况分组
将前白蛋白放疗结束后比放疗开始时降低10%归为前白蛋白下降组,余下患者归为前白蛋白未下降组对比。其中,对于Treg细胞绝对值,前白蛋白下降组放疗开始至结束较未下降组低,有统计学意义(P<0.05);CD4+T细胞、CD4+/CD8+比值统计学无明显差异(P>0.05)。
2.2.3 按照放疗结束后肿瘤标志物分组
将CEA或CA199放疗结束后比放疗开始时升高并超过正常值的患者归为CEA升高组或CA199升高组,余下患者归为CEA无升高组或CA199无升高组。其中,对于CD4+/CD8+比值,CEA升高组或CA199升高组放疗开始至结束一直呈下降趋势,CEA无升高组或CA199无升高组放疗结束时较开始时升高,放疗结束后开始下降。

表1 纳入研究患者基本特征
3 讨论
直肠癌是一种严重威胁人类健康、影响生活质量的消化道恶性肿瘤,放射治疗在直肠癌治疗中起着重要的作用,但局部复发和远处转移仍是需要解决的问题之一[4,5]。近年来,直肠癌治疗领域除了放疗、手术、化疗、靶向治疗和免疫治疗,已成为一个新的研究热点[6]。本研究选择局部进展期直肠癌患者,采集患者放化疗期间外周血,通过观察、了解患者放射治疗模式下免疫细胞的变化情况,寻找能在直肠癌治疗中预测预后的特异性指标。
肿瘤微环境是由炎症微环境、免疫微环境、血管生成微环境等共同构成,在肿瘤的发生、发展、侵袭、转移中发挥着重要作用[7]。有研究[8]将消化道恶性肿瘤患者与健康人外周血T淋巴细胞亚群表达水平比较后提出,恶性肿瘤患者体内会出现免疫紊乱,免疫系统功能较正常患者低下。而Treg细胞作为一类负调节免疫应答的淋巴细胞,通过发挥免疫抑制功能,参与维持自身免疫耐受和避免过量免疫应答等过程[9],是机体维持免疫稳态的重要机制之一。有研究[10]通过测定细胞程序性死亡-配体1和Treg细胞在结直肠癌组织中的表达,发现Treg细胞高浸润的患者2年无进展生存期高于Treg细胞低浸润的患者。本研究中直肠癌患者CD4+T细胞绝对值及Treg细胞绝对值于放疗结束后到结束后一月时免疫功能有一定回升的趋势,一定程度提示放疗影响了细胞免疫,且Treg细胞高浸润对患者预后的改善有一定价值。Treg细胞产生的外泌体可调控肿瘤细胞以及肿瘤的微环境,引起肿瘤免疫逃逸,影响肿瘤的形成、侵袭和转移[11],如将Treg细胞来源的外泌体作为治疗的手段,后续研究可以根据检测Treg细胞数目来设计这些新型治疗方案加入放疗方案的时间点。前白蛋白和白蛋白都是目前临床上用于评估患者营养状态的指标[12],本研究中营养状态较差的局部进展期直肠腺癌患者放疗期间以及放疗结束后外周血Treg细胞绝对值低于营养状态较好的直肠癌患者,表明免疫系统越活跃的患者在接受放疗和对抗肿瘤的过程中营养状况影响越小,预后更佳。营养不良可能降低肿瘤对放化疗治疗的敏感性,使免疫系统反应降低,而造成对患者疗效及预后的不利影响。
表2 患者放疗前后免疫指标变化
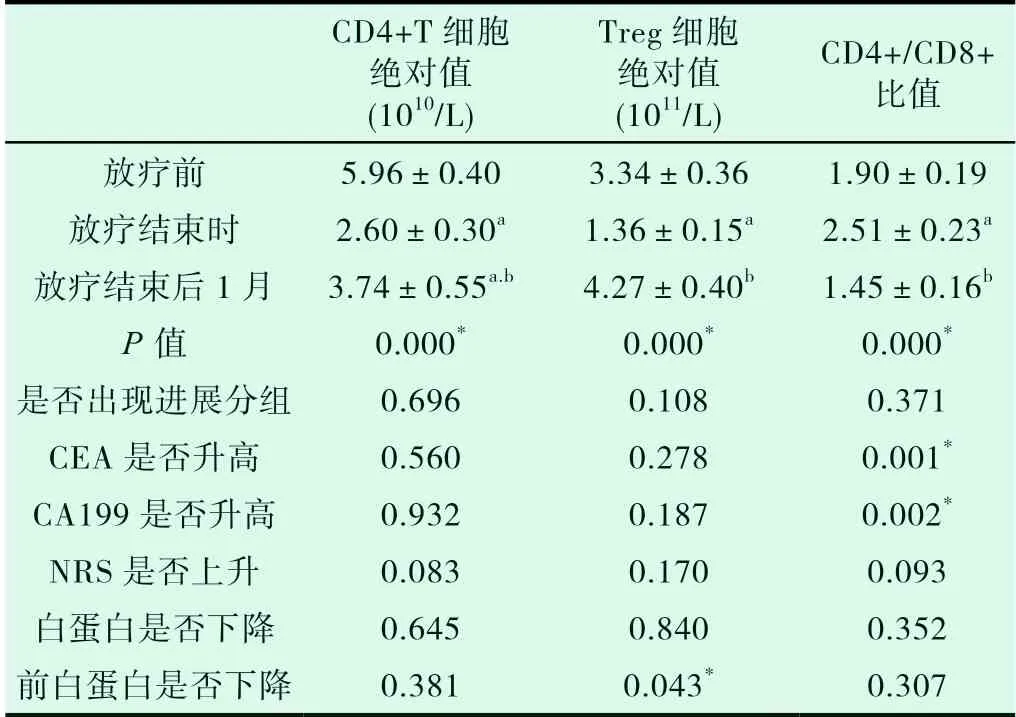
表2 患者放疗前后免疫指标变化
注:显著性标记a、b分别为和放疗前、放疗结束时比较P<0.05;显著性标记*为P<0.05组间有统计学差异
CD4+T细胞绝对值(1010/L)Treg细胞绝对值(1011/L)CD4+/CD8+比值放疗前 5.96±0.40 3.34±0.36 1.90±0.19放疗结束时 2.60±0.30a 1.36±0.15a 2.51±0.23a放疗结束后1月 3.74±0.55a.b 4.27±0.40b 1.45±0.16b P值 0.000* 0.000* 0.000*是否出现进展分组 0.696 0.108 0.371 CEA是否升高 0.560 0.278 0.001*CA199是否升高 0.932 0.187 0.002*NRS是否上升 0.083 0.170 0.093白蛋白是否下降 0.645 0.840 0.352前白蛋白是否下降 0.381 0.043* 0.307
直肠癌是消化道恶性肿瘤中预后相对较好的一类疾病。有回顾性研究[13]分析了264例直肠癌患者接受治疗后的生存时间,最长者为75个月,3年和5年生存率分别为75.43%、51.69%。本研究中局部进展期直肠癌患者最短随访时间为治疗结束后4月,最长为23月,截止至2020年1月,仅有4例患者出现病情进展,与无进展组对比数据暂无明显差异。由于研究未有充足时间随访分析患者治疗后3-5年的生存情况,现临床上多应用CEA、CA199来辅助判断患者的预后以及提示患者可能出现的进展[14]。根据患者治疗前后CEA、CA199肿瘤学指标的变化分组,发现肿瘤指标无升高组在放射治疗进行时CD4+/CD8+比值有上升趋势,待放疗结束后缓慢下降;但是肿瘤指标升高组治疗期间CD4+/CD8+比值无升高趋势,呈一直下降的趋势至肿瘤放射治疗后1月,表明了CD4+/CD8+比值放射治疗期间无上升的直肠癌患者预后优于CD4+/CD8+比值放射治疗期间一直下降的患者。当CD4+/CD8+比值下降时,提示机体的免疫状态出现紊乱,抗肿瘤能力下降,也一定程度上表明了免疫细胞功能较强的直肠癌患者放射治疗后预后更佳。
目前,国内缺乏针对直肠癌开展的前瞻性观察性研究,本研究动态记录直肠癌患者自放疗开始至放疗结束后随访数据,发现局部进展期直肠癌患者外周血放疗前与放疗结束时、放疗前与放疗结束后1月CD4+T细胞及Treg细胞绝对值一定程度上提示放疗调动了细胞免疫;放射治疗中以及放疗结束后CD4+/CD8+比值偏低一定程度上预示着预后不良,且免疫功能越活跃的患者在接受放疗和对抗肿瘤的过程中营养状况受影响小,预后更佳。T细胞亚群检测作为非侵入型手段,目的是筛选高获益人群,提高治疗的个体化以及精准化,预测疗效性预后。

