鲤鱼重组IL–17N 的原核表达条件优化及蛋白纯化
张磊,唐永凯,2,李红霞,2,徐逾鑫,李迎宾,俞菊华,2*
(1.南京农业大学无锡渔业学院,江苏 无锡 214128;2.中国水产科学研究院淡水渔业研究中心,江苏 无锡 214128)
白细胞介素17(interleukin-17,IL-17)家族是一类促炎因子,在宿主防御及各种自身免疫性疾病中有重要作用[1]。哺乳动物IL-17 家族成员包括IL-17A、IL-17B、IL-17C、IL-17D、IL-17E 和IL-17F[2]。GUNIMALADEVI 等[3]于2006 年在斑马鱼上克隆到IL-17,开启了鱼类IL-17 基因鉴定及其功能的研究。在鱼类中,除IL-17E 外的IL-17家族其他基因已被分离和鉴定。IL-17N 只在硬骨鱼类中被发现[4]。目前,对硬骨鱼类IL-17N 的研究主要集中在基因结构、基因克隆等方面,对其功能研究相对较少。
通过原核表达获得可溶的鲤鱼IL-17N 重组蛋白,可为进一步揭示鲤鱼IL-17N 的功能提供研究材料。目前,真核基因在原核中的表达多采用大肠埃希菌原核表达系统。但原核细胞缺少真核蛋白折叠所需的酶,导致外源蛋白在原核表达中常以无生物活性的包涵体形式表达[5-6]。大量研究[7-8]表明,促溶标签的应用及表达条件的优化能提高外源蛋白的可溶性表达。本研究中,通过对鲤鱼IL-17N重组蛋白表达条件的优化及促溶标签的选择,获得可溶的鲤鱼IL-17N 重组蛋白,旨在为鲤鱼IL-17N的功能研究提供依据。
1 材料与方法
1.1 材料
大肠埃希菌(Escherichia coli) DH5α 及Transetta (DE3)购自TransGen Biotech;原核表达质粒pGEX- GST、pCold-SUMO、pMAL-c2X 购自杭州研真生物科技有限公司;限制性核酸内切酶BamH Ⅰ、SalⅠ及DNA Marker 购自TaKaRa;DNA 胶回收试剂盒、质粒提取试剂盒购自上海博彩生物科技有限公司;蛋白质Marker 购自赛默飞世尔科技。镍柱购自无锡天演生物技术有限公司。
1.2 原核重组表达质粒的构建
将质粒pGEX-GST 双酶切获得的GST 片段插入到质粒pCold-SUMO 的SUMO 融合标签之后,转化到E. coilDH5α 感受态细胞中,37 ℃过夜培养。利用菌液PCR 和双酶切鉴定,筛选阳性单克隆菌落,送至苏州金唯智生物科技有限公司进行序列测定,将测序准确的原核重组表达质粒,标记为pCold-SUMO-GST。
以CcIL–17N基因的T-克隆质粒为模板,根据已有鲤鱼cDNA 序列,设计引物,即IL-17N-R,5′-ACGCGTCGACCTAGTGGTGGTGGTGGTGGT GATTCTGTCTGGATGTGG-3′;IL-17N-F,5′-CGG GATCCAGTCCGATCATGGCCCAGTG-3′。在正、反向引物的5′端分别添加BamH Ⅰ和SalⅠ酶切位点及保护碱基,引物由苏州金唯智生物科技有限公司合成。以鲤鱼IL–17N基因的T-克隆质粒为模板,进行PCR 扩增,用1%的琼脂糖凝胶电泳检测PCR产物。使用胶回收试剂盒回收PCR 产物,经BamH Ⅰ和SalⅠ酶切后,与被同样酶切过的pGEX-GST、pCold-SUMO-GST、pMAL-c2X 连接,将连接产物转化至E. coilDH5α 感受态细胞中,在氨苄抗性平板上涂布,37 ℃过夜培养。经过菌液PCR 和双酶切鉴定,筛选阳性单克隆菌落,送至苏州金唯智生物科技有限公司进行序列测定,将测序准确的原核重组表达质粒分别标记为GST-17N、SUMO-GST- 17N、MBP-17N。
1.3 重组蛋白融合标签的选择和诱导表达条件的优化
将测序准确的重组质粒(GST-17N、SUMO- GST-17N、MBP-17N)分别转入Transetta(DE3)感受态细胞,挑取单克隆于10 mL 含氨苄抗生素的LB液体培养基中,37 ℃,200 r/min 培养过夜。次日,以1∶100 在含氨苄抗生素的LB 液体培养基中扩大培养,37 ℃,200 r/min 培养至吸光度为0.5~0.8 时,分别加入终浓度为0.1、0.5、1.0 mmol/L 的诱导剂异丙基-β-D-硫代半乳糖苷(IPTG)于20、25 ℃诱导2、4、6、8、12 h。离心收集细菌,并超声裂解细菌后,取总菌和上清进行SDS-PAGE 电泳检测。以相同培养条件,但没有添加诱导剂的总菌为对照。
1.4 重组蛋白纯化及浓度测定
预试验发现SUMO-GST-17N 不能与GST 亲和层柱结合,因此,上清裂解液用镍柱亲和层析,使用SCGTMUV-VIS Detector 分离纯化,收集200 mmol/L 咪唑洗脱液洗脱产生峰值时的液体,收集液用SDS-PAGE 电泳检测。将收集液超滤浓缩于PBS中,考虑到镍柱纯化蛋白存在杂蛋白,参照王钦等[9]的方法,使用已知浓度的牛血清白蛋白(BSA)标准品进行SDS-PAGE 电泳,根据目的带与BSA 条带灰度(Tanon GIS imagine),计算纯化后重组蛋白的质量浓度、蛋白质量和摩尔数。
2 结果与分析
2.1 鲤鱼IL–17N 重组表达质粒的构建结果
菌液PCR 扩增出的DNA 片段大小符合预期结果(342 bp,图1);重组表达质粒(GST-17N、SUMO- GST-17N、MBP-17N)分别双酶切后,获得与目的基因(IL–17N)大小一致的DNA 片段(图2)。
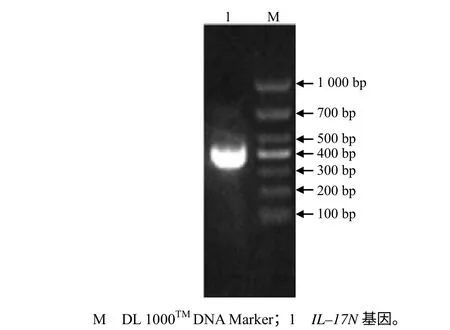
图1 鲤鱼IL–17N 基因的扩增产物 Fig.1 The amplification products of IL-17N of Cyprinus carpio
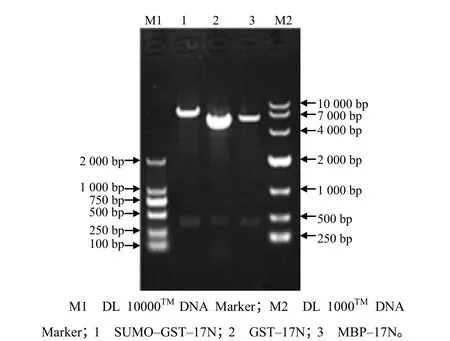
图2 鲤鱼原核重组表达质粒双酶切鉴定结果 Fig.2 The result of identification of recombinant prokaryotic expression plasmid
2.2 融合标签的促溶效果
如图3 和图4 所示,重组蛋白GST-17N(相对分子质量为4.25×104)、SUMO-GST-17N(相对分子质量为 5.54×104)、MBP-17N(相对分子质量为6.08×104)的总菌均有表达,且大小与预测一致;重组蛋白MBP-17N、SUMO-GST-17N、GST-17N的可溶表达量依次降低,GST-17N 几乎都是包涵体表达,SUMO-GST-17N、MBP-17N 上清蛋白占总蛋白比例分别为47.4%、87.0%。综合考虑单位菌中可溶蛋白获得量及试验需求,选择MBP-17N 重组表达质粒进行进一步研究。
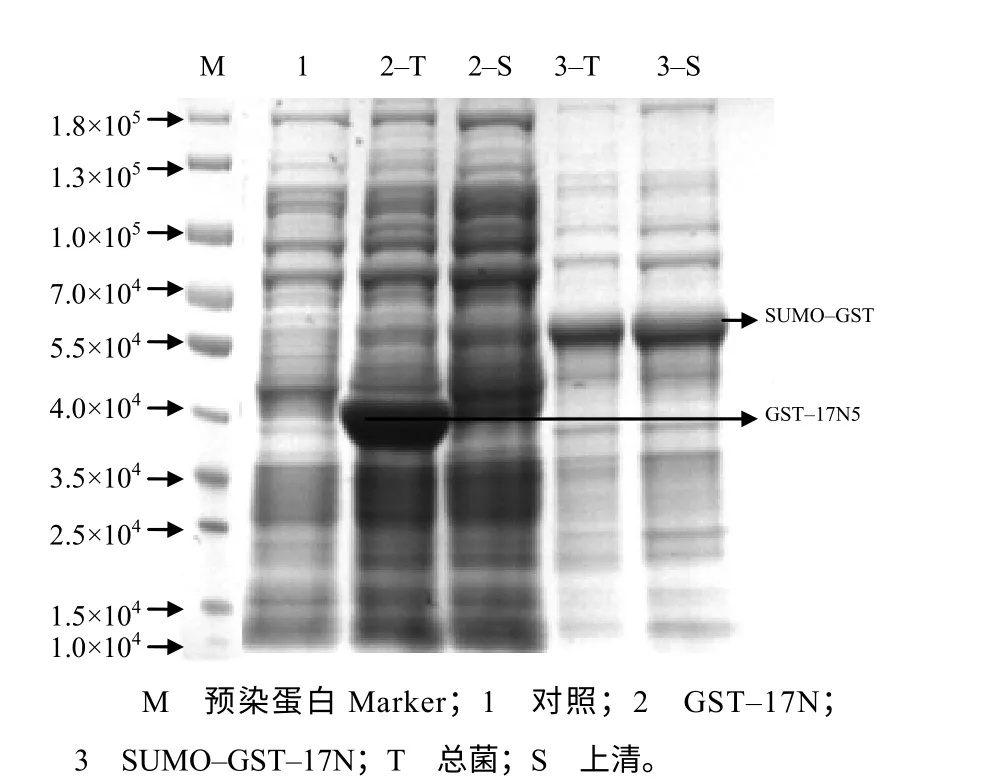
图3 GST–17N 和SUMO–GST–17N 的表达结果 Fig.3 The result of expression of GST-17N and SUMO-GST-17N
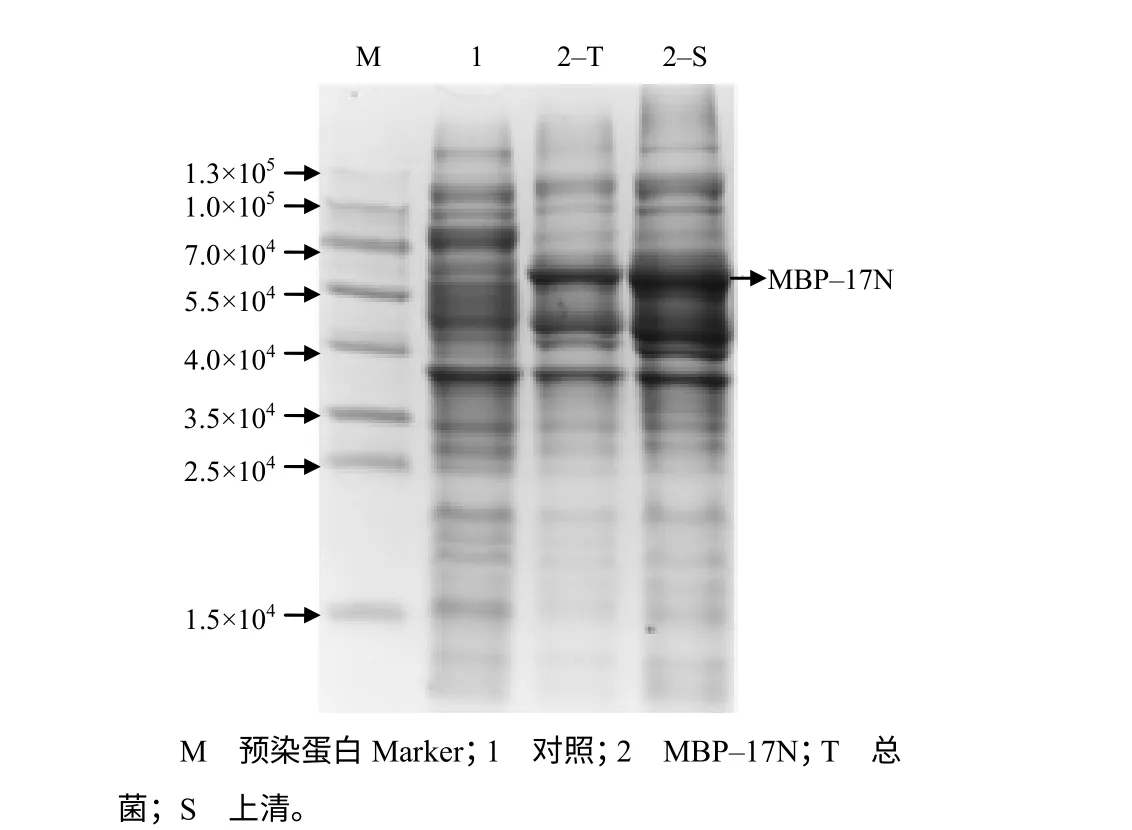
图4 MBP–17N 的表达结果 Fig.4 The result of expression of MBP-17N
2.3 MBP–17N 蛋白的表达条件和表达量
如图5 所示,IPTG 终浓度为0.1、0.5、1.0 mmol/L 时,MBP-17N 重组蛋白总菌表达量没有明显差异,但可溶表达量有明显差异,0.5 mmol/L 时可溶表达量最高;相同诱导条件下,25 ℃时MBP-17N 的总菌表达量高于20 ℃的。如图6 所示,总菌表达量随着时间延长逐渐增加,在8 h 时达到最大后趋于稳定。可见,IPTG 浓度为0.5 mmol/L,25 ℃诱导8~12 h 时,重组蛋白MBP-17N 可溶表达量最高。
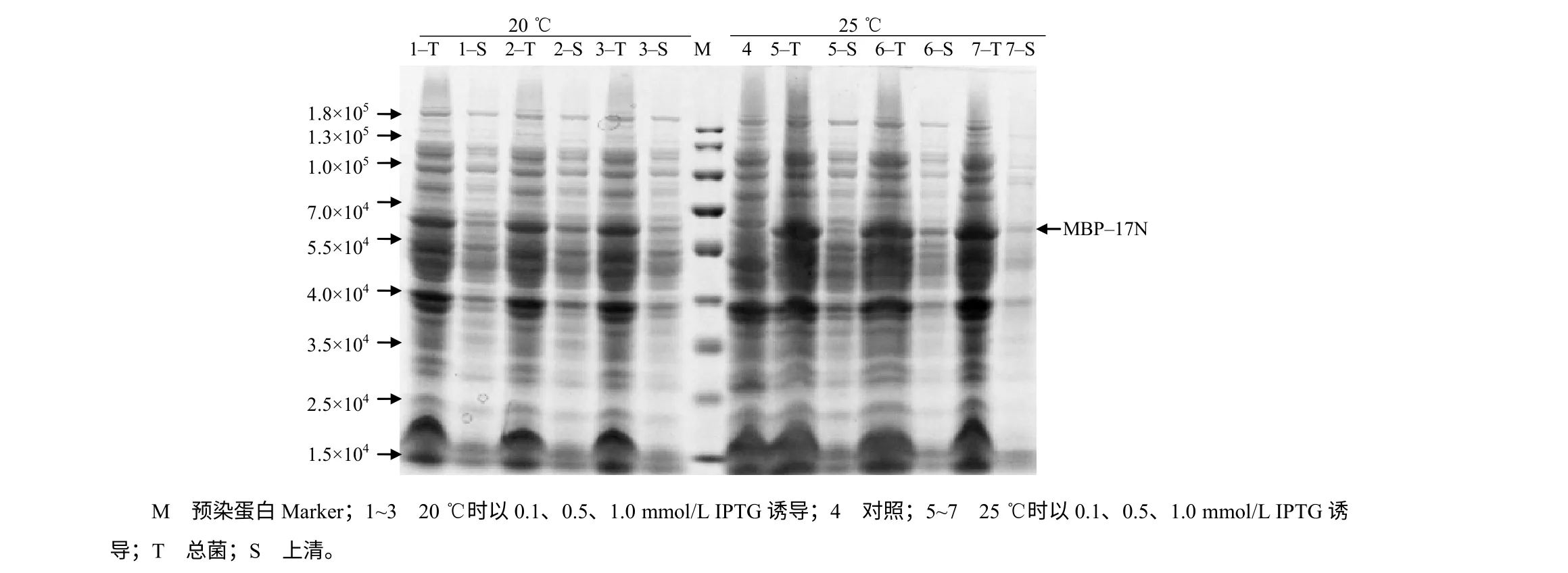
图5 不同诱导温度下不同浓度IPTG 诱导MBP-17N 的表达结果 Fig.5 The result of expression of MBP-17N with different concentrations of IPTG and different induction temperatures

图6 不同诱导时间下MBP-17N 总蛋白的表达结果 Fig.6 SDS-PAGE result of protein expression of MBP–17N with different induction time
2.4 MBP–17N 蛋白的质量浓度
经过镍柱纯化,得到MBP-17N 蛋白单一条带与预期结果一致,说明经亲和层析纯化后得到较高纯度的融合蛋白;质量浓度为0.88 mg/mL,即1 g总菌获得0.09 mg 蛋白,融合蛋白摩尔数为1.61 nmol(图7)。
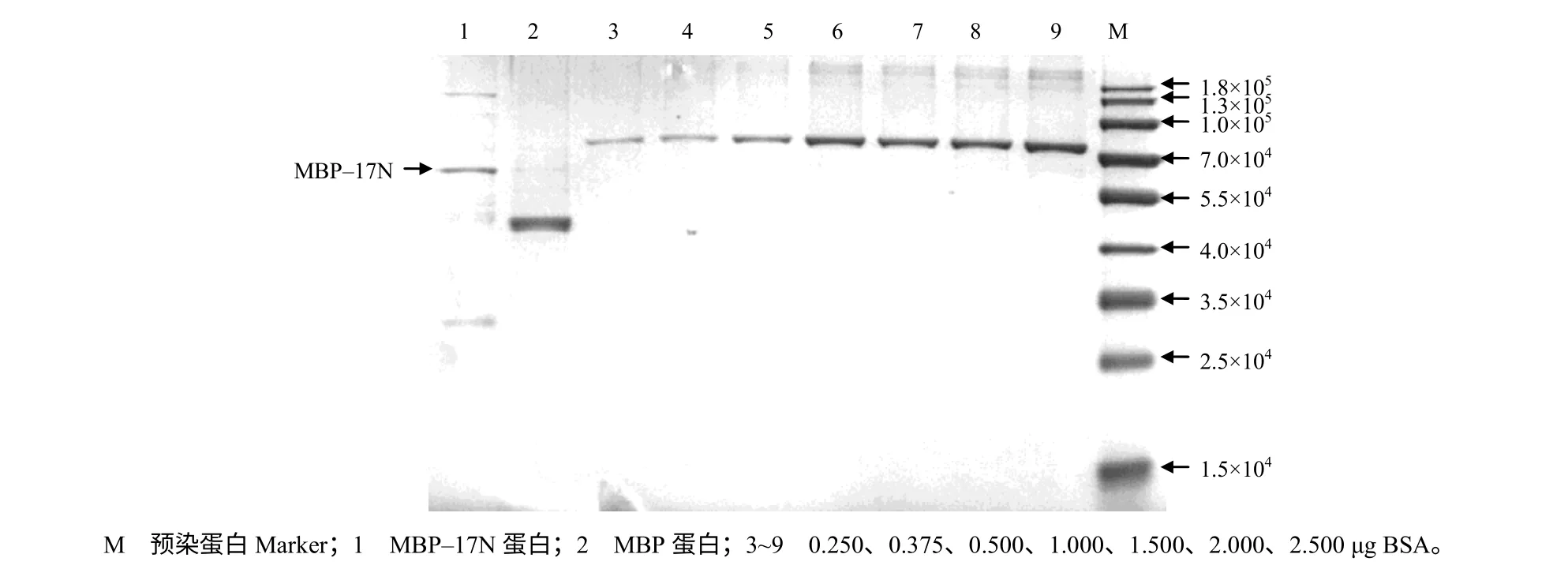
图7 MBP–17N 蛋白浓度的测定结果 Fig.7 The result of determination of MBP-17N protein concentration
3 结论与讨论
姜媛媛等[10]利用SUMO 融合表达获得了高纯度的、有活性的鼠成纤维细胞生长因子FGF-21、人FGF-21 和人白细胞介素IL-1β。RABHI-ESSAFI等[11]将人干扰素蛋白和GST 融合表达,获得70%的可溶蛋白。在大肠埃希菌中以包涵体表达的95个哺乳动物蛋白中,MBP 对其中的63 个有促溶效果[12]。本研究中,构建GST-17N、SUMO-GST-17N和 MBP-17N 原核重组表达质粒,结果表明,SUMO-GST、MBP 对目的蛋白均有明显促溶作用,而GST 几乎没有促溶作用。这与RABHI-ESSAFI等[11]的研究结果有明显差异,说明同一融合标签对不同蛋白的促溶效果不同。预试验发现SUMO- GST-17N 不能与GST 亲和层柱结合,推测可能是SUMO-GST 融合标签组合改变了GST 标签蛋白的构象,降低了GST 标签蛋白的结合能力。
诱导剂(IPTG)浓度、诱导时间和温度均是影响重组蛋白的可溶表达的重要因素[7]。柴政斌等[13]在优化融合蛋白GST-PADI4(glutathione-peptidylarginine deiminase )Ⅳ表达条件中发现,温度、IPTG 浓度对融合蛋白表达量无明显影响,但可溶重组蛋白比例在16 ℃时明显比37 ℃时高,IPTG 使用量在0.1~1.0 mmol/L 范围内,随着IPTG 量的减少,可溶目的蛋白的比例随之增加。在GST-CRH(corticotropinre- leasing hormone,CRH)的表达条件优化中发现,0.1 mmol/L IPTG 诱导的可溶蛋白含量明显高于其他浓度的[14]。为获得MBP-17N 的高可溶性表达,本研究对MBP-17N 的表达条件进行了优化。结果显示,随着IPTG 浓度的变化,MBP-17N 总蛋白表达量没有明显差异,但可溶表达量随IPTG 浓度的升高,在0.5 mmol/L 时达到峰值后逐渐降低,这可能是由于IPTG 有细胞毒性,高浓度的IPTG 可能会导致融合蛋白快速、大量表达而形成包涵体[15]。低温下大肠埃希菌生长缓慢,一般选择通过延长诱导表达时间来增加融合蛋白的表达量,但随着营养物质的消耗,菌体的生长会趋于停滞,融合蛋白的表达不会再明显增加[13]。本研究中,MBP-17N 的总蛋白表达量随着诱导时间的延长增加至一定程度后趋于稳定。通过对表达条件的摸索,最终确定MBP-17N 的最佳可溶表达条件为0.5 mmol /L IPTG,25 ℃诱导8~12 h。
由于MBP 与直链淀粉树脂结合效率较低,蛋白回收率的效率过低;因此,选用镍柱对重组MBP-17N 进行纯化,结果发现收集到的蛋白或多或少都存在杂蛋白,推测可能是总蛋白中有类似His 标签(多个组氨酸并列)结构的非目的蛋白在纯化过程中与Ni-NTA 结合[16-18]。鉴于此,BCA 法测定的蛋白浓度要大于实际获得的目的蛋白浓度,相比之下,使用已知量的标准蛋白(BSA)SDS-PAGE电泳确定目的蛋白会更可靠。
——一道江苏高考题的奥秘解读和拓展

