外源性GDF11对SD大鼠动脉血管钙化的影响
张宸铭,刘 宇,盛 瑛,徐佰达,靳天慧,刘叶红,马 涛,王 倩,徐红波,宗刚军,
血管钙化 (vascular calcification, VC)是动脉粥样硬化、高血压、糖尿病血管病变、血管损伤、慢性肾病和衰老等普遍存在的共同病理表现。主要表现为血管壁僵硬、顺应性降低,是心脑血管疾病高发病率和高死亡率的重要因素之一,也是动脉粥样硬化心血管事件、脑卒中和外周血管病发生的重要标志病变[1]。 由于VC机制复杂,目前还没有针对性的治疗手段。
近年来,有研究[1-2]发现,生长转化因子11(growth differentiation factor 11,GDF11)作为转化生长因子β(transforming growth factor-β,TGF-β)超家族的新成员,具有逆转小鼠因高龄化导致的心、脑血管疾病,保护血管内皮的作用。VC虽发生机制复杂,但其发生机制之一为血管内皮损伤,由此猜测GDF11或可影响VC进程。该研究拟建立SD大鼠VC模型,探讨GDF11对VC的作用,旨在寻找新的VC干预靶点,为治疗VC提供新的可能。
1 材料与方法
1.1 动物30只6月龄雄性SD大鼠,400~500 g,购自南京市江宁区青龙山动物繁殖场。动物分笼饲养,自由摄食和饮水,室温控制在(24±2) ℃,湿度<60%,光照时间为8:00~20:00。实验前禁食12 h,不禁水。
1.2 仪器与试剂大鼠固定板、注射器、动物灌胃器、动物解剖器材、离心机、水浴锅、琼脂凝胶电泳系统、分光光度仪、病理包埋机及切片、大鼠源r-GDF11(武汉EIAAB公司);骨形态发生蛋白4(bone morphogenetic protein-4,BMP4)、GDF11 ELISA试剂盒(武汉EIAAB公司);GDF11蛋白溶媒(武汉EIAAB公司;组分:NaH2PO4、NaCl、咪唑、10%甘油、pH 8.0);BMP4(100 μg)、成骨特异性转录因子2(runt-related transcription factor 2,RUNX2)(100 μg)、GDF11(100 μg)抗体(英国abcam公司);β-actin抗体(50 μl,上海absin公司);山羊抗小鼠HRP标记二抗、羊抗兔HRP标记二抗(1 ml,上海碧云天公司);蛋白marker(上海Thermofisher分公司);生理盐水、花生油、尼古丁(上海碧云天公司);维生素D3(vitaminD3,VD3)(上海碧云天公司);无水乙醇、组织标本包埋盒(武汉伊艾博公司)等。
1.3 方法
1.3.1实验动物的分组及模型制备 30只6月龄SD大鼠随机均分为5组。在适应性饲养1周后进行实验。钙化组予以生理盐水(1 ml/kg),溶媒组溶媒液(1 ml/kg),低浓度组(5% GDF11 1 ml/kg)、中浓度组(10% GDF11 1 ml/kg)、高浓度组(20% GDF11 1 ml/kg)进行腹腔注射,每日1次,持续7周[3]。实验第7周末,配置尼古丁·花生油悬浊液10 mg/ml(1g尼古丁搅拌融入100 ml花生油),VD3·无水乙醇6×106U/ml,分别在实验第7周末最后一天8:00、18:00将配置好的尼古丁·花生油悬浊液搅拌均匀,并按25ml/kg对大鼠灌胃;取冷藏的VD3·无水乙醇溶液,按0.5 ml/kg对大鼠肌注一次[4],继续饲养7周。实验第14周末,每组SD大鼠均予以10%水合氯醛·溶液2 ml/kg腹腔注射麻醉。心脏采血获取大鼠血液。取血之后,备皮、剖开胸腔腹腔,分离升主动脉至腹主动脉分叉处的主动脉血管。
1.3.2血液ELISA检测 每组提取的血液放入抗凝管中,3 000 r/min离心10 min,取离心后上清液,按实验分组顺序分别加入BMP4、GDF11 ELISA试剂盒中。具体操作步骤按照试剂盒说明进行。
1.3.3钙化病理学检测 取每组3根主动脉,在生理盐水中去除附着的结缔组织、周围脂肪及管腔内的残余血液。用滤纸吸干后取主动脉弓部行横切,弓部至胸主动脉纵切,将切好的组织放入病理组织包埋盒,常规脱水、包蜡。使用石蜡切片机将动脉蜡块切成4 μm薄片,毛笔蘸至温水中轻展,载玻片捞出,烘烤载玻片至石蜡溶解,依次放入二甲苯、二甲苯、无水乙醇、无水乙醇脱蜡,烘箱烘干后,在紫外灯照射下Von kossa试剂染色10 min,之后HE染色复染,具体操作步骤按照试剂盒说明进行,光学显微镜下观察各组动脉钙化程度。
1.3.4Western blot检测 将每组剩下3根主动脉分别放入EP管中,在碎冰中使用眼科剪将组织剪成泥状,低温提取主动脉总蛋白,检测BMP4(一抗1 ∶1 000),RUNX2(一抗1 ∶1 000),GDF11(一抗1 ∶2 000)及内参蛋白β-actin(一抗1 ∶3 000)。于80 V恒压电泳40 min左右待marker分开后,调至120 V恒压电泳至上样缓冲液脱落,350 mA恒流转膜80 min,5% BSA封闭1 h,孵育一抗4 ℃过夜,TBST洗膜5 min’5次,二抗(1 ∶1 000)室温孵育1 h,洗膜5 min’5次,滴加ECL曝光液进行显影,采用Image J软件分析条带灰度,以目的蛋白与β-actin比值表示相应蛋白表达水平。
1.3.5免疫组化检测 1.3.3步骤中蜡块相同切片、脱蜡、水化、抗原修复、阻断、封闭、洗涤孵育过夜,复染、脱水、透明封片(抗体稀释度分别为:BMP4 1 ∶250,RUNX2 1 ∶150,GDF11 1 ∶50,羊抗兔HRP标记二抗1 ∶50,山羊抗小鼠HRP标记二抗1 ∶50)。光学显微镜200倍下观察目的蛋白BMP4、RUNX2、GDF11的免疫组化。

2 结果
2.1 Von kossa-HE染色观察5组主动脉VC程度通过Von Kossa切片可见,钙化组及溶媒组动脉中膜处有大量黑褐色钙盐沉积,中膜弹力纤维断裂,纵向钙化延伸及整根动脉标本;低、中、高浓度组中膜钙盐沉积,弹力纤维断裂情况较钙化组及溶媒组明显减轻,钙盐沉积量按低、中、高浓度依次减少,弹力纤维断裂程度依次减弱。见图1。
2.2 5组大鼠血清中BMP4、GDF11含量测定钙箭头处:钙化组及溶媒组钙盐大量沉积,弹性纤维断裂;低浓度组钙盐沉积,弹性纤维完整;中浓度组及高浓度组钙盐几乎无沉积,弹力纤维光滑完整。
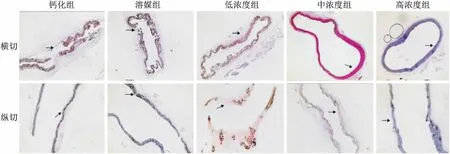
图1 5组大鼠主动脉切片 Von kossa-HE染色 ×20
化组与溶媒组之间的血清BMP4、GDF11含量差异无统计学意义(P>0.05);钙化组与低、中、高浓度组,溶媒组与低、中、高浓度组及低、中、高浓度组各组间血清BMP4、GDF11含量差异均有统计学意义(P<0.05);随r-GDF11剂量增加,血清GDF11含量越低(见表1,因RUNX2为核蛋白,血清中无法测得,故不采用ELISA法测定)。
2.3 钙化标志蛋白的表达Western blot显示,随r-GDF11浓度增加,钙化标志蛋白表达降低,各组间差异有统计学意义(P<0.05,见图2)。免疫组化法检测5组大鼠主动脉BMP4、RUNX2的表达:BMP4、RUNX2在钙化组及溶媒组表达最明显,呈棕红色,在r-GDF11 3组则表达较少,低、中、高浓度依次表达减少,见图3。
2.4 GDF11的表达免疫组化法检测5组大鼠主动脉GDF11的表达:在钙化组及溶媒组,GDF11表达微弱,在r-GDF11 3组中表达较高,低、中、高浓度组表达依次升高,呈棕红色。Western blot显示,随r-GDF11剂量的增加,血管中GDF11含量升高。
3 讨论
VC是一种十分普遍的血管损伤现象,在包含了6 814个社区的白种人、美国黑人、西班牙人、中国人等动脉硬化研究中[2],男性的发病率分别是70.4%、52.0%、56.6%、59.2%,女性的发病率分别是44.7%、37.0%、34.8%、41.9%,而在当时没有发生动脉钙化的人里,后3年随访内有18%的人相继发生钙化。尽管进行了大量的VC研究,目前仍没有针对VC的有效干预靶点。

表1 ELISA法测5组血清GDF11、BMP4含量比较
与钙化组比较:□P<0.05;与溶媒组比较:#P<0.05;与低浓度组比较:△P<0.05;与中浓度组比较:☆P<0.05

图3 不同浓度r-GDF11的钙化标志蛋白及GDF11的免疫组化 ×200
随着TGF-β超家族的不断深入研究,已有实验[3]证实GDF11具有减轻动脉内膜的损伤,维持粥样斑块稳定、抑制骨质形成的作用。动脉钙化与粥样硬化在致病因素、发病机制、形成过程中具有诸多相似之处。Mei et al[3]的研究发现,外源性注射r-GDF11或腺相关病毒(adeno-associated virus,AAV)上调GDF11的表达能够抑制血管内皮去分化,减少内皮细胞的凋亡及炎症反应,稳定粥样硬化的脂质池以及维持弹力纤维的形态;在Lu et al[5]的研究中显示,r-GDF11可以在骨髓间充质干细胞内通过活化Smad2/3来抑制骨的形成。本实验在对大鼠腹腔注射不同剂量的r-GDF11的基础上,通过肌注VD3和尼古丁灌胃诱导SD大鼠钙化显示,r-GDF11组较钙化组及溶媒组的动脉钙盐沉积减少,动脉中膜弹力纤维保持完整,钙化标志蛋白表达降低,r-GDF11组与钙化组及溶媒组之间差异具有统计学意义,说明r-GDF11在一定程度上减弱的VC的程度,但其机制并没有完全阐明。VC的形成是多因素参与的结果,包括细胞的凋亡与自噬、炎症细胞的活化与迁移、平滑肌细胞向成骨细胞转化等。有研究[6]发现通过抑制Caspase-3可以减轻细胞钙化;Mei et al[3]已发现GDF11可以通过活化TGF-β/Smad2/3,AMPK/eNOS信号通路,抑制JNK和NF-κB信号通路来抑制动脉粥样硬化的进展。可以推测GDF11的作用机制之一可能是通过活化Smad2/3信号通路来抑制Caspase-3。
在研究[7]调查中显示,中国人血清中GDF11的含量随年龄增长而增加,女性的血清GDF11含量要高于男性,且血清中GDF11的含量与骨质密度呈负相关[8];在动物研究[9]中发现,多种哺乳动物血清中GDF11的含量随年龄的增大而升高;而Glass[10]的研究证实,血清GDF11的升高是评估人类疾病的风险因素。本实验通过ELISA检测血清GDF11显示,血清中GDF11的含量与钙化程度有关,钙化组及溶媒组的血清GDF11含量较r-GDF11组明显升高,各组间差异有统计学差异,可以说明钙化程度越严重,血清GDF11含量越高。然而本实验通过外源性注射r-GDF11减轻血管钙化,血清中GDF11含量却随r-GDF11剂量的增加而减少,推测注射的r-GDF11可能集中于血管损伤处活化相关通路,参与内皮及中膜的修复,导致血清中游离的GDF11含量下降。
GDF11目前在心血管领域中已有多个成果,但没有与血管钙化有所相关的动物或细胞实验。而本实验在动物上探究了外源性予以r-GDF11与动脉血管钙化之间的关系,完善了GDF11在心血管领域的作用,为临床的VC治疗提供了一个新的方向。而如想将GDF11作为干预或治疗VC的手段,需要更进一步分子机制研究。

