响应面法优化苹果渣中果胶的柠檬酸提取工艺
傅锡鹏,朱秀灵,戴清源,潘 超,董 勇,盛伊健,贾坤鹏,陈廷然
(安徽工程大学 生物与化学工程学院,安徽 芜湖 241000)
果胶是植物细胞壁多糖家族中结构最为复杂的一种成分,属于水溶性膳食纤维,不会被小肠消化酶如α-淀粉酶和α-葡萄糖苷酶降解[1],具有优良的胶凝性和乳化性[2]以及降血糖[3]、增强免疫力[4]、抗菌[5]、保护胃肠道[6]等多种特性和生理功能。由于这些功能特性,果胶已经成为食品和医药行业中最受欢迎的原料之一。商品果胶的来源主要是苹果渣及柑橘皮[2,7]。苹果渣是苹果汁加工的主要副产物,苹果渣水分含量高(约80%)并且富含碳水合化物、有机酸、维生素和矿物质,尤其是富含果胶类物质[8]。如果不进行处理,大量苹果渣堆积不仅占用土地,而且由于其富营养化及产生异味,将会严重污染环境。从苹果渣中提取果胶是增加经济效益和减少环境污染的一种有效途径。
果胶提取方法主要有水提[9-10]、酸提[11-12]、碱提[13-14]、酶法[15]及超声波或微波辅助提取法[16-18],其中最常用的方法为酸提法,它是利用稀酸将植物细胞壁中非水溶性果胶转化为水溶性果胶[19-20]。常用的酸主要为硫酸、盐酸、硝酸[12,21],其他还包括酒石酸[1]、苹果酸[1,21]以及柠檬酸[22]等。与盐酸及硝酸相比,柠檬酸对果胶的提取效率和产量较高[23],硫酸可以很好地将原果胶转化为可溶性果胶,但水解后硫酸根离子的去除非常困难[20],硝酸提取的果胶得率不稳定[21]。酶法提取果胶,条件温和,可避免强酸的腐蚀及污染问题,但是酶法提取果胶价格昂贵[1];考虑到经济成本,目前工业上多以价格较低的无机酸如盐酸作为果胶的提取溶剂。酸法提取果胶,提取液的pH值是关键因素,当提取液的pH值相同时,果胶提取得率和酸的种类没有关系,降低提取液的pH值可以使更多的水不溶性果胶转化为可溶性果胶从而提高果胶的提取率,但是较低pH值的强酸(如盐酸和硝酸),不仅会腐蚀设备及造成水体污染,而且容易导致果胶水解从而降低果胶的得率[20]。与无机酸相比,有机酸的解离常数较低,其水解能力也比无机酸低,如果采用有机酸提取果胶可能不会引起质子催化的果胶解聚[24]。食品级有机酸如柠檬酸和苹果酸,已被美国食品药品监督管理局(FDA)批准为不受任何限制的安全材料,主要用作抑制微生物生长的食品防腐剂[1]。与酒石酸、苹果酸等有机酸相比,柠檬酸价格较低,并且对环境友好,以柠檬酸为溶剂提取果胶已引起了众多研究者的关注[16,22,24-25]。
响应面法是一种应用较为广泛的试验优化方法,采用较为合理的试验设计对实验进行全面研究,可以有效地确定多因素试验的最佳条件[26]。然而,利用响应面法优化柠檬酸提取果胶技术是否能够有效地提高苹果渣中果胶的提取率鲜见报道。研究首先以苹果渣为原料,以食品级柠檬酸为提取溶剂,以果胶得率为指标,在单因素试验的基础上,利用响应面法优化果胶提取工艺,确定其最佳提取条件;其次以乳化性和乳化稳定性为考察指标,评价其乳化特性,旨在为苹果渣中果胶的环保制备及性能研究提供参考。
1 材料与方法
1.1 材料与试剂
苹果(芜湖市水果销售店提供,主要为畸形、碰损且无霉烂的果实);食品级柠檬酸(芜湖市瑞德食品添加剂经营部);无水乙醇、氢氧化钠(分析纯,国药集团试剂有限公司);咔唑(化学纯,国药集团试剂有限公司);标准品D-半乳糖醛酸、酚酞指示剂(上海瑞永生物科技有限公司)。
1.2 仪器与设备
QS-100万能粉碎机(鹤壁市恒鑫仪器仪表有限公司);JY1002电子天平(上海良平仪表有限公司);HH-6恒温水浴锅(金坛式杰瑞尔电器有限公司);L-550台式低速大容量离心机(湖南湘仪实验室仪器开发有限公司);ZFD-A5140鼓风干燥箱(上海智城分析仪器制造公司);RE-85Z旋转蒸发仪(上海青浦沪西仪器厂);L3S紫外可见分光光度计(上海仪电分析仪器有限公司)。
1.3 实验方法
(1)原料处理。将外观畸形或者破损的苹果切成约3 cm小块,用打浆机打碎,两层纱布挤压去汁,将果渣置于干燥箱中70 ℃干燥至恒重,粉碎、过60目筛。然后按料液比1∶20(g/mL)加入70%(v/v)乙醇,室温搅拌1 h,离心(4 500 r/min,10 min),弃上清,沉淀部分按料液比1∶20(g/mL)加入无水乙醇,按相同方法洗涤1次。最后将沉淀物于70 ℃干燥至恒重,冷却至室温,即得到苹果渣,自封袋分装,4 ℃冰箱存放。
(2)果胶提取单因素试验。准确称取苹果渣若干份,每份2 g,采用30 g/100 mL柠檬酸溶液将蒸馏水调至不同的pH值,即为不同pH值的柠檬酸溶液,以不同pH值的柠檬酸溶液为提取剂,分别考察料液比、提取温度、提取时间及pH值4个因素对苹果渣果胶得率的影响。具体方法如下:
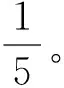
②提取温度。称取4份各2 g苹果渣,按照料液比1∶25(g/mL)分别加入pH 2.0的柠檬酸溶液,分别置于70 ℃、80 ℃、90 ℃、100 ℃的恒温水浴浸提90 min。后续操作同①料液比。
③提取时间。称取4份各2 g苹果渣,按照料液比1∶25(g/mL)分别加入pH 2.0的柠檬酸溶液,于90 ℃水浴浸提60 min、90 min、120 min、150 min。后续操作同①料液比。
④pH。称取4份各2 g苹果渣,按照料液比1∶25(g/mL)分别加入pH 1.0、2.0、3.0、4.0的柠檬酸溶液,于90 ℃水浴浸提90 min。后续操作同①料液比。
上述各浓缩液,分别加入3倍体积无水乙醇,搅拌5 min,室温静置过夜,使果胶沉淀析出,离心(4 500 r/min,10 min),收集沉淀,分别用70%(v/v)乙醇、无水乙醇依次洗涤,每次洗涤时均搅拌20 min,将洗涤后的沉淀热风干燥(60 ℃,2 h),粉碎即得果胶。
(3)响应面法优化苹果渣果胶提取工艺。在单因素试验基础上,选择提取温度、提取时间和pH值为影响因素,各设置3个水平(见表1),料液比为1∶25(g/mL),运用Deign Expert 8.0.6软件中的Box-Behnken设计试验方案(见表2),共17个实验,包括5个中心点,以果胶得率为响应值,作响应面与等高线图,优化最佳提取工艺条件。

表1 因素水平表
(4)果胶得率的计算。果胶得率[11]以每克苹果渣提取的果胶的质量百分比表示,如式(1)所示:
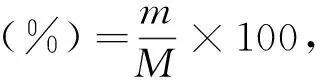
(1)
式中,M为苹果渣质量(以干基计,g);m为提取的果胶的质量(以干基计,g)。
(5)半乳糖醛酸含量的测定。半乳糖醛酸含量采用氨基磺酸盐/间羟基二苯基法测定[27],简述如下:称取20 mg果胶样品,采用蒸馏水溶解并定容至100 mL;量取该溶液400 μL与40 μL 4 M氨基磺酸溶液充分混合,再加入含有75 mM四硼酸钠的浓硫酸2.4 mL,混匀,100 ℃水浴水解20 min,冰浴冷却;再加入80 μL 0.15%(w/v)间羟基二苯溶液(由0.05%(w/v)NaOH溶液配制而成),混匀,于525 nm测定吸光度,以不含间羟基二苯的NaOH溶液作为空白。以标准品D-半乳糖醛酸溶液(0~100 μg/mL)绘制标准曲线。则样品中半乳糖醛酸含量按式(2)计算:
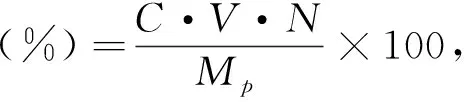
(2)
式中,C为从标准曲线中查得的半乳糖醛酸质量浓度(μg/mL);V为待测液的体积(mL);N为稀释倍数;Mp为果胶样品质量(g)。
(6)果胶酯化度。果胶的酯化度采用滴定法测定,参照文献[28]并修改如下:称取0.2 g果胶,加入100 mL蒸馏水,40 ℃水浴溶解果胶,然后加入2~3滴1%酚酞-乙醇溶液,采用0.1 mol/L NaOH溶液滴定,记录滴定终点时消耗的NaOH溶液体积(V1);然后继续滴加0.5 moL/L NaOH溶液20 mL,室温下皂化2.5 h;向皂化后的溶液中加入20 mL 0.5 mol/L HCL溶液,再用0.1 mol/L NaOH溶液进行滴定,记录消耗的NaOH体积为V2。根据式(3)计算果胶的酯化度:
(3)
式中,DE为果胶酯化度(%);V1为初次消耗NaOH溶液的体积(mL);V2为皂化后的溶液消耗NaOH溶液的体积(mL)。
(7)乳化性和乳化稳定性。果胶的乳化性和乳化稳定性测定参照文献[29],方法简述如下:将3 mL 0.5%(w/w)果胶样品与3 mL植物油用涡旋混合器以最大速度混合3 min,离心(10 000 r/min,5 min),分别记录溶液总体积(VT)和乳化层体积(VE),则果胶的乳化性(EA,%)由式(4)计算得出:
(4)
采用相同的方法制备乳液,分成等量若干份,取一份乳液,离心(10 000 r/min,5 min)并分别记录初始乳化层体积(VEi),剩余的乳液均在23 ℃存放30 d,分别于第1 d和第30 d取样、离心(10 000 r/min,5 min)、记录乳化层体积(VEr)。则乳化稳定性(ES,%)可由式(5)计算得出:
(5)
1.4 数据处理
2 结果与分析
2.1 苹果渣中果胶提取单因素试验
(1)料液比对果胶得率的影响。料液比对柠檬酸提取苹果渣果胶得率的影响如图1所示。由图1可以看出,随着料液比的增加,果胶得率呈上升趋势,当料液比为1∶25 g/mL时,果胶得率最大为12.5±0.87(%),再增大料液比,果胶得率几乎不变。
(2)提取温度对果胶得率的影响。提取温度对柠檬酸提取苹果渣果胶得率的影响如图2所示。由图2可知,当提取温度低于90 ℃时,随着温度的升高,果胶得率显著增加,在90 ℃时果胶得率为13.13±0.50(%);当温度高于90 ℃时,果胶得率增加不显著。果胶作为一种高分子有机物,萃取温度过高会导致果胶本身结构的破坏;萃取温度过低,水解速度又会太慢,故选择合适的提取温度为90 ℃。
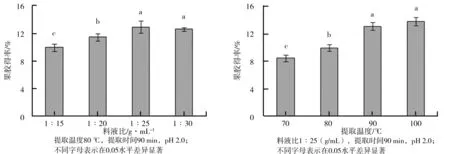
图1 料液比对柠檬酸提取苹果渣果胶得率的影响 图2 提取温度对柠檬酸提取苹果渣果胶得率的影响
(3)提取时间对果胶得率的影响。提取时间对果胶得率的影响如图3所示,在其他条件固定不变的情况下,随着提取时间的延长,果胶得率逐渐增大,至提取时间120 min时果胶得率最大为(13.27±0.40)%;当提取时间超过120 min,再进一步延长提取时间,果胶得率反而下降,其原因可能是热酸溶液长时间作用,导致果胶物质分子部分降解,故而果胶得率下降。由图3还可以看出,提取时间在90 min和120 min时,果胶得率差异不显著,因此,选择90 min为合适的提取时间。
(4)pH对果胶得率的影响。pH对柠檬酸提取苹果渣果胶得率的影响如图4所示。由图4可以看出,pH 1.0~2.0范围内,随着pH值的升高,果胶得率逐渐增大,pH 2.0时果胶得率最大为(13.17±0.61)%;当pH值大于2.0时,随着pH值增大果胶得率反而下降。可能是随着pH值的升高,溶剂中酸含量不断减少,苹果渣中原果胶与细胞内纤维素等结构的连接不易被破坏,果胶物质无法有效溶解,果胶得率降低。所以,选择pH 2.0为合适的pH值。
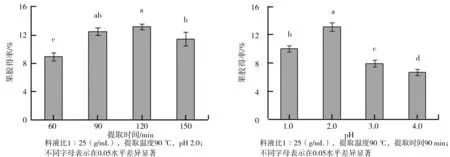
图3 提取时间对柠檬酸提取苹果渣果胶得率的影响 图4 pH对柠檬酸提取苹果渣果胶得率的影响
2.2 响应面法优化果胶提取工艺
在单因素试验基础上,采用Box-Behnken设计方案进一步优化果胶提取条件,结果如表2所示。在设计实验条件下,果胶得率范围为8.25%~14.05%,其最高值出现在中心点实验条件下,即提取温度为90 ℃,提取时间为90 min,pH值为2.0。不同的实验组合,果胶得率之间存在明显的差异。运用Design-Expert 8.0.6软件对表2数据进行多元回归分析,得到果胶得率的预测值(Y)与提取温度(X1)、提取时间(X2)、pH(X3)之间的二次多元回归方程:
式中,X1、X2、X3分别是被测变量提取温度、提取时间及pH的编码值。
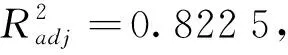
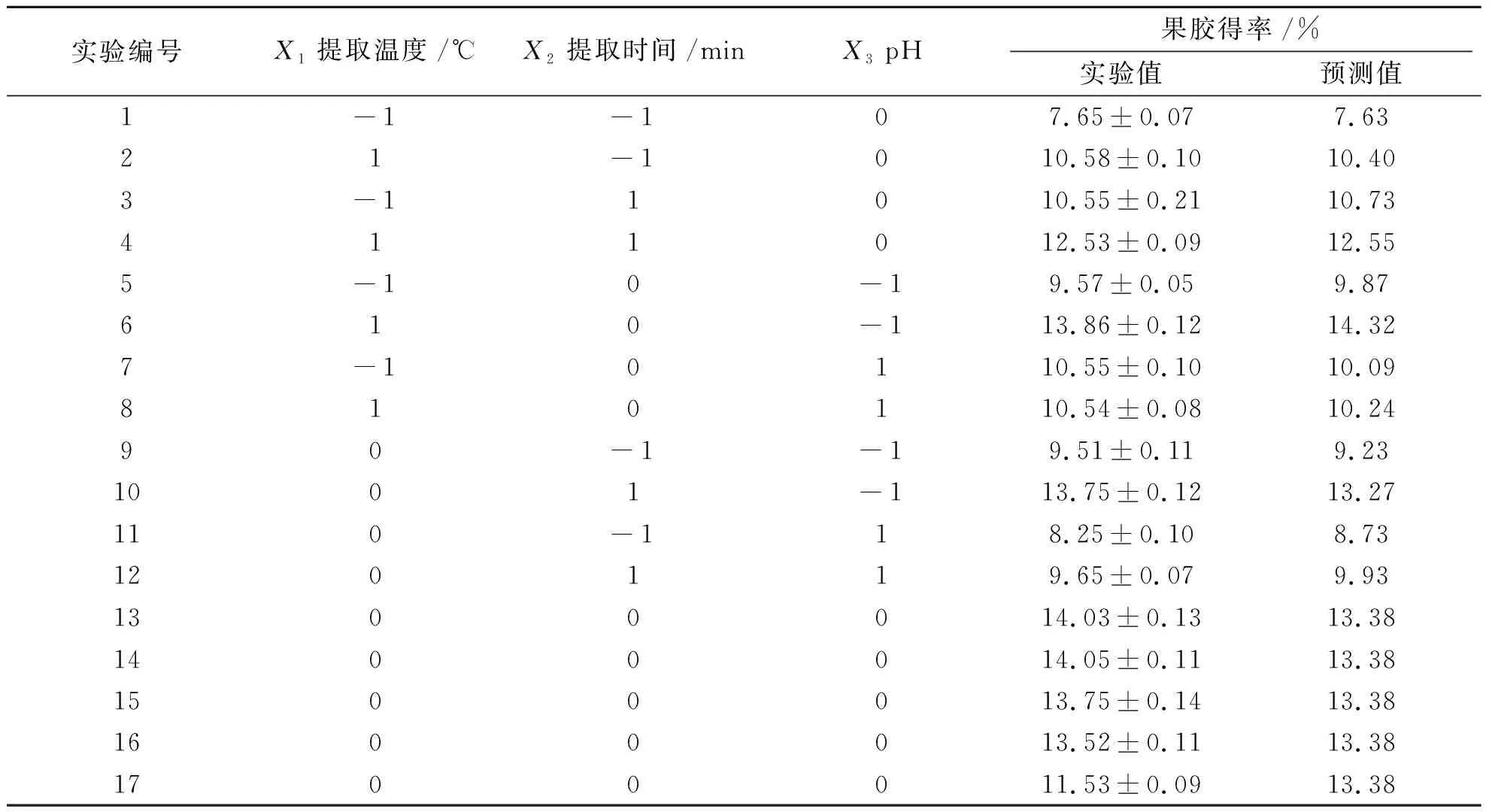
表2 响应面试验设计方案及结果
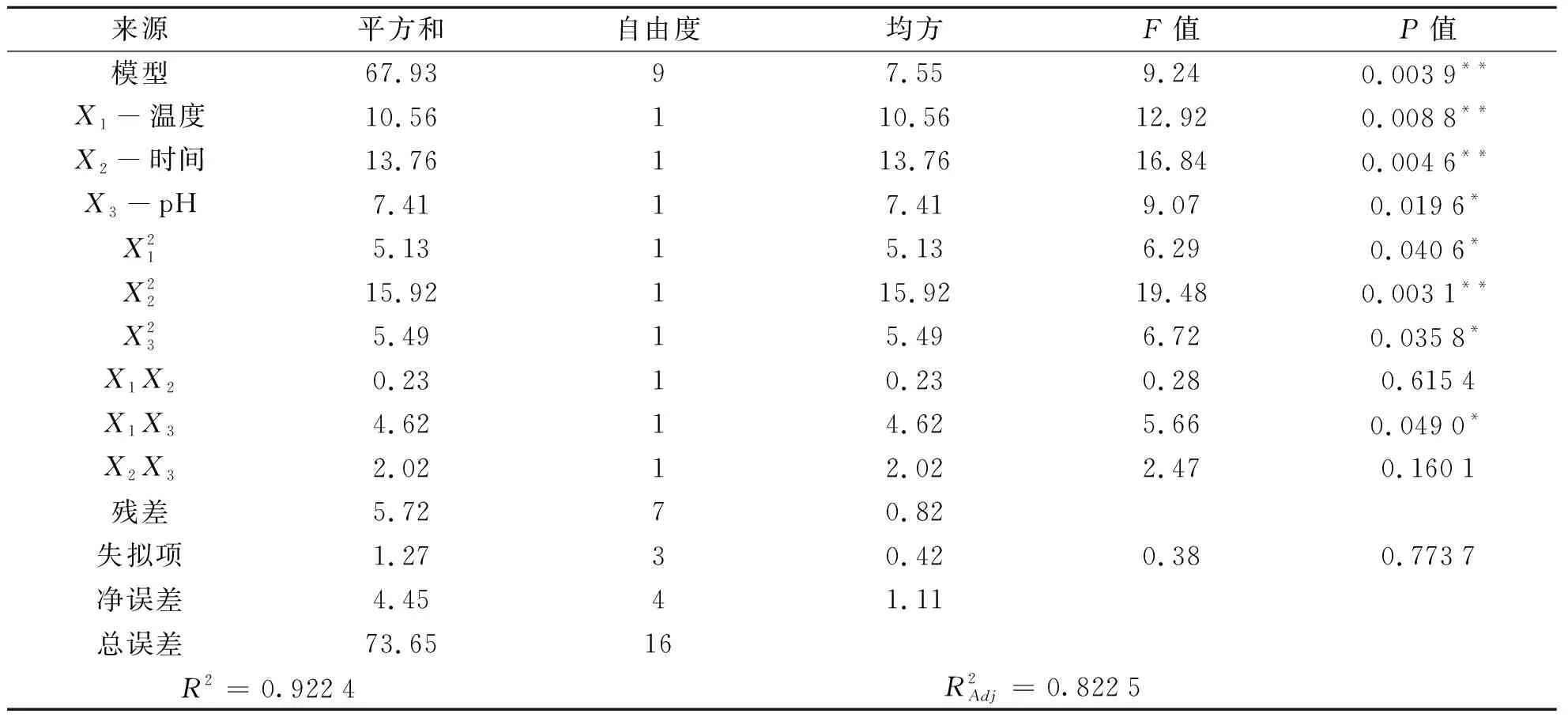
表3 回归模型方差分析及显著性检验
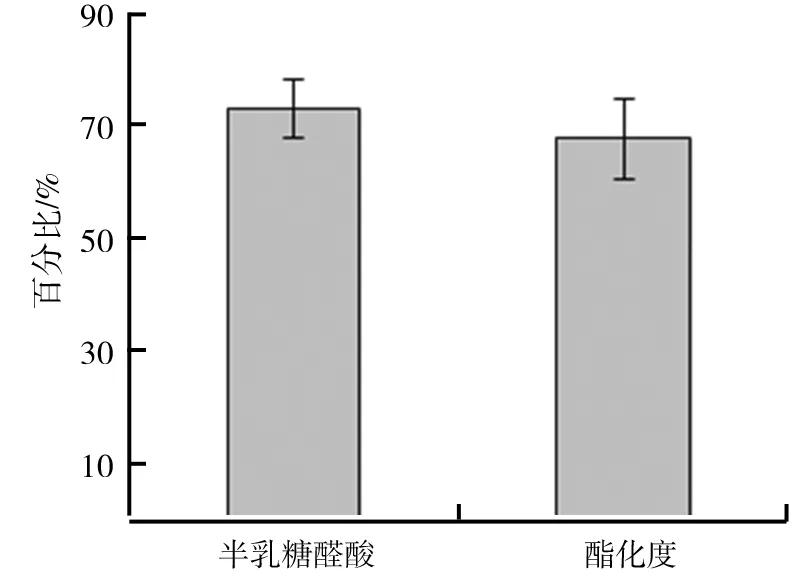
注:*差异显著(0.01 为了更直观地观察和了解自变量和响应值之间关系以及自变量间的交互作用,运用Deign Expert 8.0.6软件对实验结果绘制响应面图如图5所示,并优化最佳提取工艺条件。 提取温度和提取时间交互作用对果胶得率的影响如图5a所示响应曲面及等高线均呈圆形,说明提取温度和提取时间交互作用对结果影响不显著。响应曲面及等高线均呈椭圆型如图5b所示,说明提取温度和pH交互作用对果胶得率影响显著。响应曲面及等高线介于椭圆和圆之间如图5c所示,说明提取时间和pH交互作用对果胶得率有一定的影响。由图5可知,响应面图和等高线图反应了自变量之间的交互作用,这与表3方差分析及显著性检验的结果一致。 图5 各因素交互作用影响果胶得率的响应面图 此外,运用Design Expert 8.0.6软件对实验数据进行处理,在各因素水平设定范围内,得出被测变量的最优值,即提取温度94.78 ℃、提取时间94.61 min、pH 1.5,在此最优工艺条件下,果胶得率的预测值为14.72%。为了便于实际操作,将最优提取工艺参数修订为提取温度95 ℃、提取时间95 min、pH 1.5。 为了验证回归模型的可靠性,对修订的提取工艺即提取温度95 ℃、提取时间95 min、pH 1.5,以及实验设计中果胶得率最大的实验组即提取温度90 ℃、提取时间90 min、pH 2.0,分别进行3次重复实验,结果以平均值±SD表示。结果表明,前者果胶得率为14.45±0.20(%),后者为14.10±0.11(%),前者中果胶得率明显高于后者。由此得出,前者即提取温度95 ℃、提取时间95 min、pH 1.5为果胶的最佳提取工艺。 通过单因素及响应面优化实验,可以得到柠檬酸提取苹果渣果胶的最优工艺为提取温度95 ℃、提取时间95 min、pH 1.5、料液比1∶25(g/mL)、提取2次,在此条件下,果胶得率为14.45±0.20(%),与理论预测值的相对误差为-1.83%,说明用响应面法对苹果渣中果胶的提取进行工艺优化具有实际可操作性。研究采用柠檬酸提取果胶,其得率明显低于内切木聚糖酶和内切纤维素酶辅助提取法(19.8%)[15],但却显著高于超声波辅助提取法(9.183%)[27]。 (1)果胶的半乳糖醛酸含量和酯化度。在最佳工艺条件下提取的果胶,其半乳糖醛酸含量及酯化度如图6所示。由图6可知,半乳糖醛酸含量为73.31±5.14(%),与文献[11]报道基本一致。果胶的酯化度是其在工业中应用的重要参数,它与果胶的溶解度、乳化能力和多糖形成凝胶的能力等技术特征有关[27]。研究中提取的果胶酯化度为68.03±7.11(%),说明提取的果胶为高甲氧基果胶。 图6 果胶半乳糖醛酸含量及其酯化度 (2)乳化性和乳化稳定性。果胶的乳化性受到多种因素的影响,如会降低表面张力的较低的分子量,提取条件如温度和时间、较高的酯化度、果胶中蛋白质及酚类物质的亲水疏水性等[29]。研究中所提取的果胶乳化性为38.51±6.13(%),与文献[29]报道一致。 乳化稳定性是由于水合层对聚集体的空间排斥效应。果胶分子通过在颗粒周围形成乳液层来稳定界面处的乳液。乳液的稳定能力取决于带电分子(果胶)与蛋白质之间的联系以及果胶的低分子量[29]。研究提取的果胶,其乳化稳定性在23 ℃第1 d为83.55±3.07(%),第30 d为80.91±6.52(%),说明柠檬酸提取的苹果果胶具有较好的乳化稳定性。 研究从农产品加工副产物的开发利用及果胶的环保制备的角度,通过单因素试验与响应面设计试验,对柠檬酸提取苹果渣中果胶的工艺条件进行优化,其最佳提取工艺条件为提取温度95 ℃、提取时间95 min、pH 1.5、料液比1∶25(g/mL)、提取2次,在此条件下果胶平均得率为14.45±0.20(%),与理论预测值的相对误差为-1.83%。由此可知,采用响应面法优化柠檬酸提取苹果渣中果胶,果胶得率较高,提取工艺参数可靠,具有实际可操作性。试验中采用食品级柠檬酸溶液为提取溶剂,具有环保、安全等特点[30]。在最佳提取条件下所得的果胶的半乳糖醛酸含量为73.31±5.14(%),说明果胶纯度较高,酯化度为68.03±7.11(%),说明该果胶属于高酯果胶;其乳化性为38.51±6.13(%),乳化稳定性在30 d内保持在80%以上,表明该果胶具有良好的乳化性和乳化稳定性。 试验中发现不同批次、不同来源的苹果渣原料,果胶得率可能有较大差异,说明果胶含量高低与原料品种、原料来源密切相关。研究仅是对柠檬酸最佳提取条件下得到的苹果渣果胶的乳化特性做了初步探讨,在后期的研究中,还可深入探讨不同果胶质量浓度、油相体积分数及pH值对苹果果胶乳化特性的影响规律。研究未对提取出的果胶进行分离纯化、主要结构组成、流变与凝胶特性及其在食品中的应用进行研究,后续试验中将对其进行探究。
2.3 苹果果胶的性质分析
3 结论

