溪黄草水提物和醇提物体外抗肿瘤活性研究
孔 艺 蒋永和 刘 媛 林莉莉 陈阿丽
1. 广东药科大学附属第一医院药学部,广东 广州 510080;2.广州市东升医院药剂科,广东 广州 510140;3.南方医科大学南方医院药学部,广东 广州 510515;4.广东药科大学医药化工学院,广东 广州 510006
溪黄草为2015年版《中华人民共和国药典》中记载的唇形科植物线纹香茶菜Isodonstriatus(Benth.)Kudo或溪黄草Isodonsorra(Maxim.)Kudo的干燥地上部分[1]。溪黄草具有清热解毒、凉血散瘀、利湿退黄等功效[2],主要应用于治疗湿热泻痢,跌打瘀肿,急性黄疸型肝炎,急性胆囊炎等疾病,临床疗效确切[3]。
近年来,关于溪黄草体外抗肿瘤活性研究较多[4-12]。溪黄草水提物以时间依赖的方式抑制肝癌细胞HepG2的体外增殖[4],溪黄草醇提物在体外可分别抑制结肠癌HCT116细胞增殖、迁移和侵袭[11],但尚未见关于两者抗肿瘤活性差异的研究。另一方面,中医理论认为溪黄草具有保肝利胆的作用,研究也表明溪黄草提取物可抑制肝癌和结肠癌细胞的增殖。目前尚未见关于溪黄草不同提取物对人肝癌HepG2、胃癌 MKN-45和食管癌TE-1细胞株增殖影响的对比研究,其提取物对其他消化道肿瘤是否也具有体外抗肿瘤活性有待研究。本研究采用水和乙醇两种不同的溶剂对溪黄草进行提取,比较其水提物和醇提物的色谱图差异,并在体外检测其对HepG2、MKN-45和TE-1细胞株增殖的影响,旨在为进一步研究溪黄草在肝癌、胃癌和食管癌中具有体外抗肿瘤活性的物质基础提供依据。
1 材料与方法
1.1 实验材料 溪黄草(批号171001、171002、171003)由广州白云山和记黄埔中药有限公司溪黄草基地提供,经广东药科大学医药化工学院田素英高级实验师鉴定为溪黄草R.serra(Maxim)Hara。人肝癌细胞HepG2和人胃癌细胞MKN-45由广东药科大学附属第一医院蔡祥胜博士馈赠,人食管癌细胞株TE-1由广东药科大学附属第一医院刘乃华博士馈赠。甲醇和甲酸(色谱纯,Fisher公司)。DMEM培养基、青霉素和链霉素、胎牛血清和胰蛋白酶均购自美国Gibco公司。DMSO(细胞用无菌级)和噻唑蓝粉末(Methylthiazolyldiphenyl-Terazolium Bromide,MTT)购自sigma公司。
1.2 实验仪器 Waters 2695型高效液相色谱仪(包括Waters2695分离单元、2996型二极管阵列检测器、2420蒸发光散射检测器、自动进样器、柱温箱,美国Waters公司)。sartorius电子天平(广州靓恒科学仪器有限公司);N-1000型旋转蒸发仪(东京理化器械株式会社);二氧化碳培养箱(美国A-sheville NC公司);GB-Ⅱ超净工作台;Multiscan-GO全波长酶标仪(Thermo公司)。
1.3 实验方法
1.3.1 溪黄草水提物的制备 称取溪黄草粗粉100 g,加入10倍量的蒸馏水浸泡1 h,水煎提取1 h,趁热过滤药液,再重复提取3次,合并滤液,60 ℃恒温减压浓缩至50 mL。将浓缩后的溪黄草提取物放于-80 ℃冰箱中预冻12 h,置于真空冷冻干燥机低温升华干燥48 h后,密封保存于-20 ℃。使用时,40 mg溪黄草冻干粉加入细胞高糖培养基,超声至完全溶解并定容为10 mL,0.22 μm微孔滤膜过滤除菌,存于4 ℃备用。
1.3.2 溪黄草乙醇提取物的制备 称取溪黄草粗粉100 g,加入10倍量60%乙醇浸泡1 h,回流提取1 h,趁热过滤药液,再重复提取3次,合并滤液,60 ℃恒温减压浓缩至50 mL。将浓缩后的溪黄草提取物放于-80 ℃冰箱中预冻12 h,置于真空冷冻干燥机低温升华干燥48 h后,密封保存于-20 ℃。使用时,400 g溪黄草冻干粉加入DMSO,超声至完全溶解并定容为1 mL,存于4 ℃备用。
1.3.3 高效液相色谱条件 Waters C18色谱柱(250 mm×4.60 mm,5 μm);流动相:甲醇(A)-0.1%甲酸(B)梯度洗脱(0~38 min,40%A;38~42 min,40%~55%A;42~63 min,55%~60%A);流速:0.7 mL/min;波长:254 nm;柱温:35 ℃;进样量:10 μL。各取溪黄草水提物和醇提物50.0 mg,置10 mL容量瓶,加60%乙醇,超声30 min,补足60%乙醇至刻度。
1.3.4 细胞培养 人肝癌细胞株HepG2,人胃癌细胞株MKN-45和人食管癌细胞株TE-1细胞用含10 %胎牛血清和1 %青霉素-链霉素溶液的DMEM完全培养基培养,置于含5% CO2、温度为37 ℃的恒温培养箱,隔天换液。
1.3.5 MTT检测细胞存活率 取对数期生长状态良好的HepG2、MKN-45和TE-1细胞以5×103个/孔的密度接种于96孔板内,过夜培养后细胞贴壁且生长状态良好时开始实验。实验分为溪黄草水提物和醇提物两组,分别向三种细胞株加入不同质量浓度的溪黄草水提物溶液(0.1、0.2、0.5、1、1.5、2、2.5和3 mg/mL)或溪黄草醇提物溶液(0.1、0.2、0.4、0.6、0.8、1、1.5和2 mg/mL)进行培养,每个浓度设置6个复孔。同时设置空白调零孔(向未接种细胞的培养孔中加入200 μL/孔 DMEM完全培养基)、阴性对照组(向含有细胞的培养孔中加入200 μL/每孔 DMEM完全培养基)和溶剂对照组(向含有细胞的培养孔中加入200 μL/每孔 含0.05 % DMSO的DMEM完全培养基,仅用于醇提物组)。培养48 h后,弃去原有含药培养基,每孔加入100 μL 0.5 mg/mL 的MTT溶液,放置于恒温培养箱中,继续培养4 h。弃去MTT溶液,每孔加入150 μL DMSO,放置于摇床上,避光震荡10 min。在多功能酶标仪上测定吸光度(A)值(测定波长为570 nm)。本实验独立重复三次,计算细胞增殖抑制率,采用图表分析软件GraphPad Prism 5.0计算分析各组IC50值。
细胞增殖抑制率(%)=(1-实验组OD570/对照组OD570)×100%
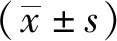
2 结果
2.1 溪黄草水提物和醇提物色谱图比较 采用“中药色谱指纹图谱相似度评价系统2004A 版”,对溪黄草水提取物与醇提取物色谱图进行比较,结果如图1所示。醇提物与水提物相比,新增6个峰,分别为图1中的3号峰(27.0 min)、6号峰(45.6 min)、10号峰(50.3 min)、11号峰(52.6 min)、12号峰(56.3 min)和13号峰(59.6 min)。缺失4个峰,分别为2号峰(20.2 min)、4号峰(28.7 min)、8号峰(46.9 min)和9号峰(48.8 min)。
溪黄草不同提取物色谱图除色谱峰数目不同外,峰面积也不同(见表1)。这充分说明不同的提取溶剂使溪黄草的化学成分在质和量上发生明显的变化。
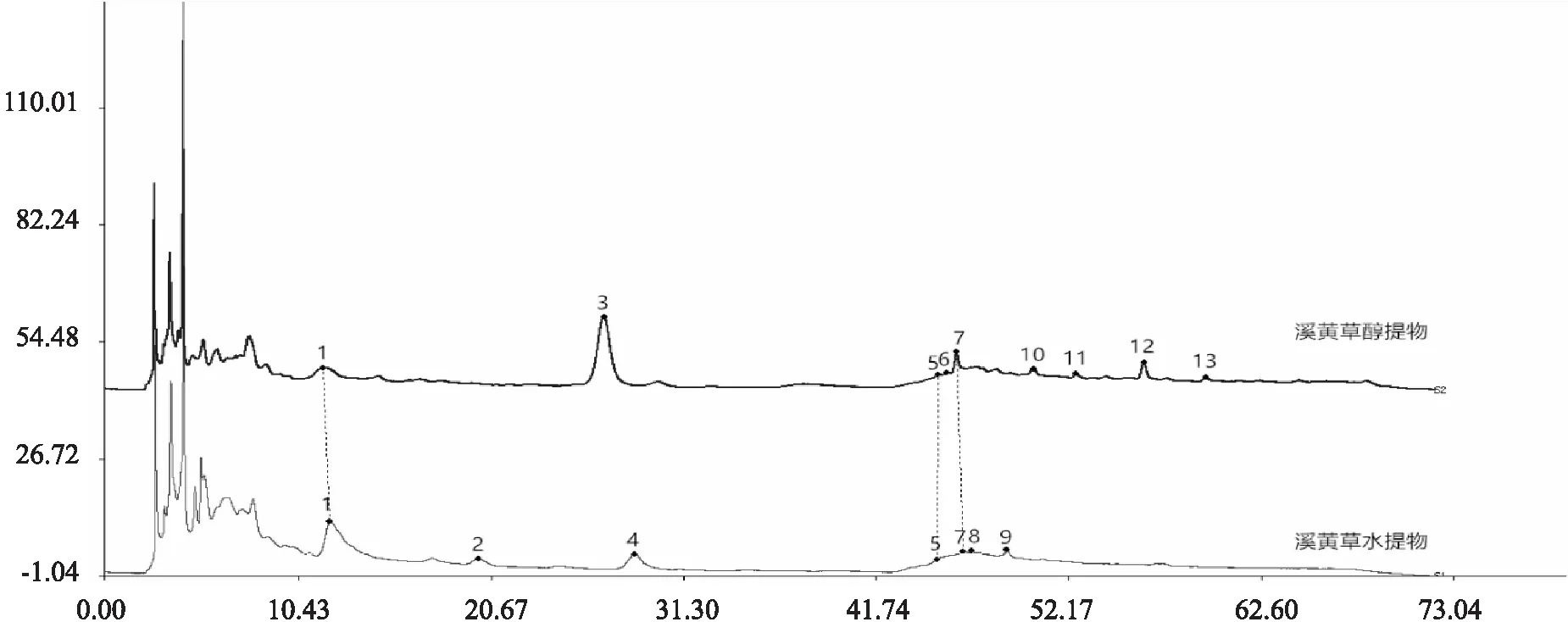
图1 溪黄草不同提取物色谱图

表1 溪黄草水提物和醇提物色谱图峰结果
2.2 溪黄草水提物和醇提物均可抑制细胞的增殖 溪黄草水提物和醇提物在HepG2、MKN-45和TE-1细胞株中的IC50值见表2。溪黄草水提物可抑制HepG2、MKN-45和TE-1的细胞增殖,且抑制作用在上述3株细胞之间差异无统计学意义。同样,溪黄草醇提物对以上3种细胞株的增殖也具有抑制作用,且差异无统计学意义。但重要的是,溪黄草水提物和醇提物对每种细胞株的增殖抑制作用均存在统计学差异,且溪黄草醇提物的IC50值显著小于水提物,说明溪黄草醇提物对3种不同细胞株的增殖抑制作用显著强于水提物。

表2 溪黄草不同提取物对不同细胞的细胞毒作用
4 讨论
溪黄草的化学成分较多,药效成分复杂。截止到2016年,从溪黄草各基源植物中已分离鉴定了近300种化合物,主要为挥发油类、萜类、多酚类、黄酮类、神经酰胺类化合物及木脂素、甾醇、活性多糖等成分[13-19]。近来,国内学者研究发现溪黄草水煎剂具有抗肝癌活性[4,20],并证实溪黄草黄酮是溪黄草重要的药理活性成分之一,存在于溪黄草水溶性总黄酮部位[20]。此外,张慕垚等[11]发现溪黄草乙醇提取物通过下调结肠癌细胞对促癌性小RNA miR-1290的表达和分泌,抑制结肠癌细胞增殖、迁移和侵袭。林恋竹[12]对比溪黄草叶和茎乙醇提取物的HPLC图谱,得出全草入药的科学性,并揭示二萜类化合物是溪黄草乙醇提取物呈现抑菌及抗肿瘤活性的重要物质基础。本研究采用水和乙醇对溪黄草全草进行提取,发现其水提物和醇提物可分别抑制HepG2、MKN-45和TE-1细胞株的增殖。
本研究中溪黄草水提物抑制肝癌细胞HepG2增殖的IC50值为(2.05±0.19)mg/mL。冯传平等[20]的研究表明当加入0.5 mg/mL溪黄草水溶性总黄酮作用HepG2细胞株48后h,对细胞增殖抑制率为(34.92±2.31)%,与本研究结果相近。同时水提物也可抑制MKN-45和TE-1细胞株的增殖,且抑制作用在三株细胞之间无统计学差异。本课题组采用醇提物进行研究也得出相同的结论。但值得注意的是,醇提物对HepG2、MKN-45和TE-1细胞株的增殖抑制作用显著强于水提物。在我国,中药药的服用方法多以水煎为主。实验结果初步证实溪黄草醇提物具有良好的体外抗肿瘤活性,为进一步探寻其在HepG2、MKN-45和TE-1细胞株中具有抑制细胞增殖活性的化合物提供研究方向。
本研究仍有不足之处,如尚未研究溪黄草提取物对细胞凋亡的影响及可能的机制,以及是否具有体内抗肿瘤活性。其次,未检测溪黄草不同提取物不同批次之间的色谱图差异。课题组后续将继续深入研究,并进一步揭示不同的提取方法对溪黄草抗肿瘤物质基础的提取效率,阐明物质组成差异,寻找溪黄草醇提物中抗肿瘤活性较强的化学成分。

