几种纳米荧光能量受体的比较
周国华*,叶明强,吴腾育
(清洁能源材料化学广东普通高校重点实验室,岭南师范学院化学化工学院,广东湛江 524048)
基于荧光共振能量转移(Förster Resonance Energy Transfer,FRET)的荧光传感器,由于其高分辨率、高选择性、可操作性强等优势,吸引了众多科研工作者的兴趣,已经被研发并应用于重金属离子[1]、DNA甲基化[2]、真菌毒素[3]、蛋白质[4]和酶活[2,3,5,6]等的不同检测中。FRET荧光传感器包含了荧光能量供体和能量受体。荧光能量供体是荧光传感器研究的重点之一,目前主要为有机荧光分子和新型荧光纳米材料,如量子点[7,8]、碳点[9]、金属团簇[10]等。事实上,荧光能量受体的选择和研究对于FRET传感器亦是至关重要。合适的能量受体能使荧光背景更低,从而带来更高的检测灵敏度。传统的能量受体主要为有机小分子,包括各荧光分子和不发荧光的猝灭剂,如BHQ系列猝灭剂。当使用两个荧光分子构成荧光能量供-受体对时,能量受体所发射的荧光会进入供体的检测通道,形成背景信号,限制了方法的灵敏度。BHQ的使用有效解决了该问题,使FRET荧光探针的灵敏度有所提高[11]。近十几年来,研究者们发现一些具有特殊光学性质的纳米材料也能够充当性能优异的荧光能量受体。相比有机小分子,纳米材料具有更宽的吸收光谱和更高的摩尔吸光系数[12],更容易与荧光光谱匹配,具有更高的能量转移效率和猝灭效率。以纳米材料和荧光小分子组成能量供-受体对,其Stern-Volmer猝灭常数(KSV)达到107~1011L/mol,是小分子能量供-受体对KSV的5~6个数量级[13],从而带来更低的背景和更高的检测灵敏度。同时,纳米材料可以通过不同配体的修饰实现各种功能化,满足不同的应用[14,15]。当纳米材料同时兼具载体和能量受体的功能时,能更方便地将传感器应用于体外和体内生物分子和生命过程的监测和成像[5,14 - 16];当纳米材料具备治疗功能时,则能同时实现肿瘤的成像和治疗[17],拓展了FRET荧光传感器的应用。相比而言,小分子构成的FRET荧光探针一般很难进入细胞,通常需要使用转染试剂辅助,或者采用微注射来实现细胞内的应用[14]。因此,纳米荧光能量受体得到越来越多的关注和研究。目前受研究者们重点关注并已得到充分研究的纳米能量受体主要有石墨烯[18,19]、氧化石墨烯[3,5]、Au纳米颗粒[7,20]等。除此之外,近几年的研究发现,一些具有类石墨烯结构的二维纳米材料,如MoS2[21]、WS2[22],以及其它贵金属纳米材料如纳米Pd[23,24]等,也具有高猝灭能力,从而构建了一些新型的荧光传感器。然而,如今各种纳米材料层出不穷,种类繁多,哪一种才是最合适的能量受体,让人难以抉择。就此问题,本文对还原型氧化石墨烯(Reduced Graphite Oxide,rGO)、氧化石墨烯(Graphite Oxide,GO)、纳米二硫化钨(WS2)、纳米二硫化钼(MoS2)、金纳米粒子(Gold Nanoparticles,AuNPs)和钯纳米粒子(Palladium Nanoparticles,PdNPs)这6种纳米材料进行系统比较,旨在选出最优的荧光能量受体,为FRET荧光传感器的研究提供参考数据。
本研究选择荧光素(FAM)作为荧光能量供体,以核酸为作用媒介,实现FRET并进行研究。核酸作为研究工具具有一定优势。首先,核酸与6种纳米材料都能相互作用[3,18,22,23,25,26],使研究条件统一,消除其它影响因素;第二,核酸可通过巧妙的设计,实现人为控制的杂交,获得所需的二级结构,从而调控供-受体距离;第三,目前核酸人工合成技术成熟,所有设计的FAM标记和非标记序列都可以直接采购,方便研究的开展。我们的研究结果表明,FAM标记的单链核酸与纳米材料相互作用都能使FAM被猝灭,但猝灭效率有所不同,其中以rGO的猝灭效率最高。进一步的研究表明,6种纳米材料中,rGO与AuNPs具有长距离FRET的作用,在生物大分子荧光传感器的构建中具有重要意义。而且,具体的实验条件将影响纳米材料与DNA的相互作用,从而影响FRET,故在实际应用中需要注意控制实验条件。
1 实验部分
1.1 试剂
小片径单层WS2分散液、GO溶液、小片径单层MoS2分散液(南京先丰纳米材料科技有限公司);琼脂糖、Green-DNA Dye核苷酸胶体染料、DNA上样缓冲溶液(生工生物工程(上海)股份有限公司);Au和Pd标准溶液(GSB04-1715-2004)(国家有色金属及电子材料分析测试中心);其它所有化学试剂均为分析纯(上海麦克林生化科技有限(中国公司)。实验中使用的所有单链DNA(Single-stranded DNA,ssDNA)均由生工生物工程(上海)股份有限公司合成纯化,DNA序列如表1所示。不同长度的双链DNA(Double-stranded DNA,dsDNA)由表2列举的组合杂交形成。

表1 研究中所用的DNA序列

表2 不同长度的dsDNA杂交组合
1.2 仪器
Infinite M200 pro型多功能酶标仪(瑞士,Tecan);Tecnai G2F30透射电子显微镜(美国,FEI);3K15冷冻高速离心机(德国,Sigma);JY600C型垂直式电泳系统,JY-ZY3半干式转移电泳槽(北京君意东方电泳设备有限公司);Tanon 1600凝胶成像仪(上海天能科技有限公司);HK-9600等离子体发射光谱仪(北京华科天成科技有限公司);Master-D超纯水机(上海和泰仪器有限公司)。
1.3 实验方法
1.3.1 DNA的琼脂糖凝胶电泳称取0.6 g琼脂糖,加入15 mL缓冲溶液(0.5×TBE:0.45 mol/L Tris-H2BO3,0.01 mol/L EDTA,pH=8.0的TBE缓冲液稀释10倍)和1 μL Green-DNA Dye核苷酸胶体染料,加热溶解。稍微冷却后倒模制胶。根据表2的组合制备不同长度的dsDNA(1 μmol/L),90 ℃水浴加热5 min,冷却后加入DNA上样缓冲溶液,同时配制DNA Marker。上样后在0.5×TBE缓冲溶液中,以100 V电压电泳1 h。电泳结果在凝胶成像分析系统上进行荧光成像分析。
1.3.2 Au纳米粒子(AuNPs)的制备与表征AuNPs的制备参考文献方法[27]。用透射电子显微镜(TEM)对制备好的AuNPs形貌进行表征。AuNPs的浓度采用发射光谱法进行表征。往30 mL聚四氟乙烯内衬反应釜中加入1 mL AuNPs、10 mL王水,混匀后放入微波消解炉中,按照120 ℃、150 ℃、180 ℃分别保持3 min、3 min、5 min的程序进行消解。冷却后转至100 mL烧杯中,加热至近干,再加入大约10 mL HCl(2 mol/L)继续加热进行赶酸,重复3次。最后用4%HCl定容至10.00 mL,以Au标准贮备溶液配制标准溶液,用发射光谱法制作标准曲线并计算AuNPs的浓度。
1.3.3 Pd纳米粒子(PdNPs)的制备与表征PdNPs的制备参考文献报道[28]。对PdNPs的表征与AuNPs相似,但PdNPs的浓度较低,在测定浓度前先离心进行浓缩,以Pd标准贮备溶液配制标准溶液来制作标准曲线。
1.3.4 还原型氧化石墨烯(rGO)的制备rGO的制备参考文献方法[29]。纯化后将溶液转移至干净的已知质量的离心管中,置于真空干燥箱中于70 ℃干燥,称量干燥rGO固体的质量,再用超纯水配制成2 mg/mL的rGO溶液。
1.3.5 WS2/MoS2的纯化将LiOH稳定的单层WS2/MoS2分散液(1 mg/mL)超声5 min,取10 mL分散液于透析袋中,在1 L水中透析,每4 h换1次水,换3次水,以除去溶液中多余的Li+。透析结束后收集WS2/MoS2分散液,用25.00 mL的容量瓶定容,使其浓度为400 μg/mL。
1.3.6 荧光猝灭测定按照表2的组合合成不同长度的荧光DNA,将荧光DNA(30 nmol/L)与不同浓度的纳米荧光能量受体混合,避光反应10 min后,取200 μL混合溶液于96孔板中,用Infinite M200 pro酶标仪检测其荧光强度(激发波长:490 nm,发射波长:520 nm)。
2 结果与讨论
2.1 实验设计
众多的研究表明,纳米材料与ssDNA、dsDNA的相互作用力存在差异。GO和rGO与ssDNA裸露的碱基通过π-π堆积相互作用,而金属纳米材料则通过范德华力和碱基的配位作用与ssDNA相互作用。当DNA杂交形成双链结构后,碱基被磷酸骨架保护在内,阻碍了材料与dsDNA的作用。据此,研究者们利用各种纳米材料构建了众多的核酸传感器[18,22,25,26]。另外,Pei等人的研究发现,当ssDNA上有连续A碱基时,利用连续A碱基与AuNPs的强相互作用,将ssDNA用作AuNPs的稳定配体,提高DNA功能化AuNPs的杂交效率[30]。因此,本文以FAM标记的DNA为工具,研究不同纳米材料通过与ssDNA的相互作用,与FAM发生FRET而猝灭荧光的能力(图1a)。同时,FRET与荧光供-受体对之间的距离密切相关,研究中通过设计,使荧光标记的DNA杂交形成不同长度的刚性双螺旋结构,并在末端带有一段能与纳米材料相互作用的连续A碱基片段,从而调控荧光基团FAM与纳米材料之间的距离,研究和比较不同纳米材料作为荧光能量受体在不同距离下对FAM的猝灭作用(图1b)。而当荧光标记的DNA完全互补配对时,将失去与纳米材料的相互作用而不发生FRET(图1c)。
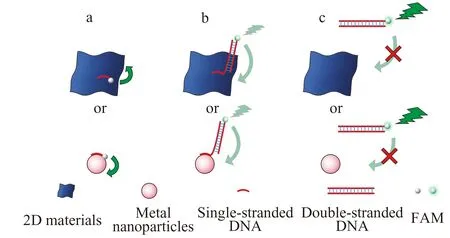
图1 (a)ssDNA、(b)末端带连续A碱基片段的dsDNA和(c)完全互补配对的dsDNA分别与不同纳米材料相互作用示意图Fig.1 Illustration of the interaction between ssDNA (a),dsDNA with unhybridized terminal single-stranded fragment (b),and completely complementary paired dsDNA (c) and different nanomaterials
2.2 材料制备与表征
研究开展前,我们先对DNA的设计进行了验证。按表2设计的序列组合杂交后,用琼脂糖凝胶电泳对不同长度的dsDNA进行分析,结果如图2所示。从图中可见,除了L1 ssDNA不能被双链特异性荧光染料SYBR Green I显示外,不同组合杂交形成的dsDNA都显示出了明显的荧光条带,表明我们的设计成功杂交形成了dsDNA。而且图中显示不同的dsDNA迁移率不同,表明各个组合基本按照我们的设计形成了不同长度的dsDNA。但对比DNA marker,各条带的碱基数与设计的dsDNA结构不一致(dsDNA每10 bp约为3 nm),可能是由于结构中末端连续A碱基片段造成迁移率的变化。
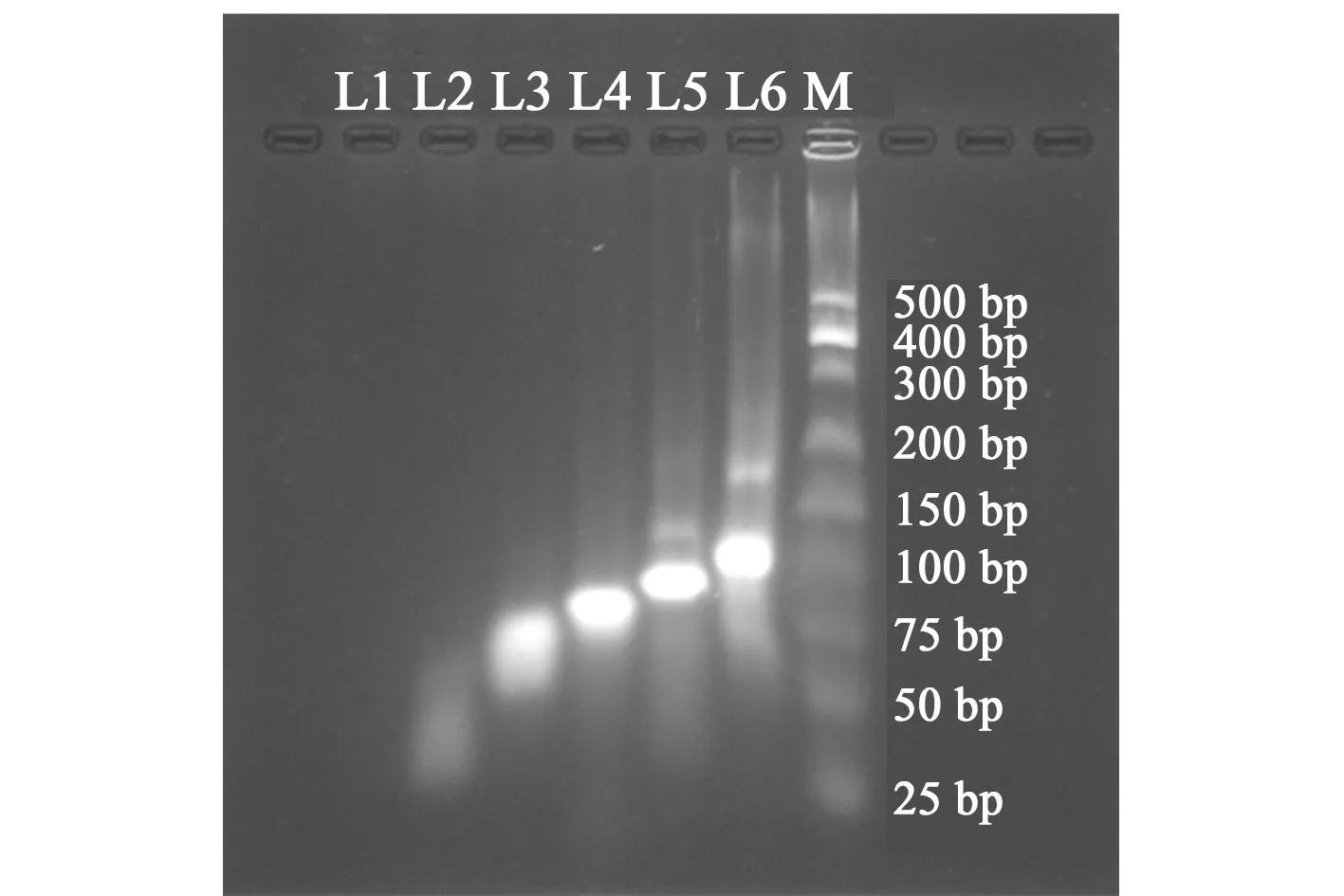
图2 不同结构DNA的琼脂糖凝胶电泳Fig.2 Agarose gel electrophoresis of different DNAL1:ssDNA;L2:4.5 nm;L3:10 nm;L4:15 nm;L5:20 nm;L6:30 nm;M:DNA marker.
在纳米材料方面,rGO、AuNPs和PdNPs都有了较为成熟的制备方法。对于rGO,为了提高其水溶性,便于水体系的实验研究,我们选择将rGO磺酸化[31]。对于AuNPs和PdNPs,我们从多种方法中选择了柠檬酸钠为还原剂和稳定剂制备AuNPs[27],以及抗坏血酸钠为还原剂、柠檬酸钠为稳定剂制备PdNPs的方法[28]。这两种方法制备的都是柠檬酸钠稳定的球形纳米溶胶,且可通过还原剂的用量在一定程度上调控纳米颗粒的粒径。透射电镜(TEM)结果(图3)表明,我们制备的AuNPs和PdNPs粒径、形貌均一,粒径都在15 nm左右,从而在一定程度上消除了金属纳米颗粒粒径不同引起相互作用和吸光系数差异[12,24]所带来的实验影响。

图3 AuNPs(a)和PdNPs(b)的透射电镜(TEM)图Fig.3 TEM images of AuNPs(a) and PdNPs(b)
2.3 荧光能量受体的理论比较
FRET发生的前提是荧光能量供体的发射光谱与荧光能量受体的吸收光谱存在重叠,并且可通过光谱重叠的程度计算FRET的效率[32]。因此,我们首先对FAM的发射光谱和6种纳米材料的吸收光谱进行了分析,从理论上比较了6种纳米材料对FAM的荧光猝灭(图4)。从图中可见,以FAM为荧光能量供体,与6种能量受体的吸收光谱均有重叠,表明理论上6种纳米材料都能通过FRET猝灭FAM的荧光。在相同条件下,光谱重叠程度越高,则FRET效率越高,对荧光的猝灭越显著[32]。比较图中的重叠面积可见,理论上6种材料对FAM的猝灭能力大小顺序为:rGO>PdNPs>AuNPs>WS2>GO>MoS2。根据文献方法[32]对重叠面积进行积分计算,可更明显比较6种材料对FAM的猝灭能力(表3)。从表中可见,理论上6种材料的猝灭能力有很大的差异。以重叠面积为基础,可进一步计算FRET发生的距离限制——Förster半径。但在计算过程中,需要能量受体的摩尔消光系数(ε,单位L·mol-1·cm-1)。而在我们研究的6种纳米材料中,只有AuNPs和PdNPs可计算其摩尔消光系数,其余的二维纳米材料目前仍无法获得其物质的量浓度。因此,为统一比较,我们使用了材料的消光系数(k,单位L·g-1·cm-1)计算其重叠面积,无法进一步在理论上比较各能量受体的Förster半径。
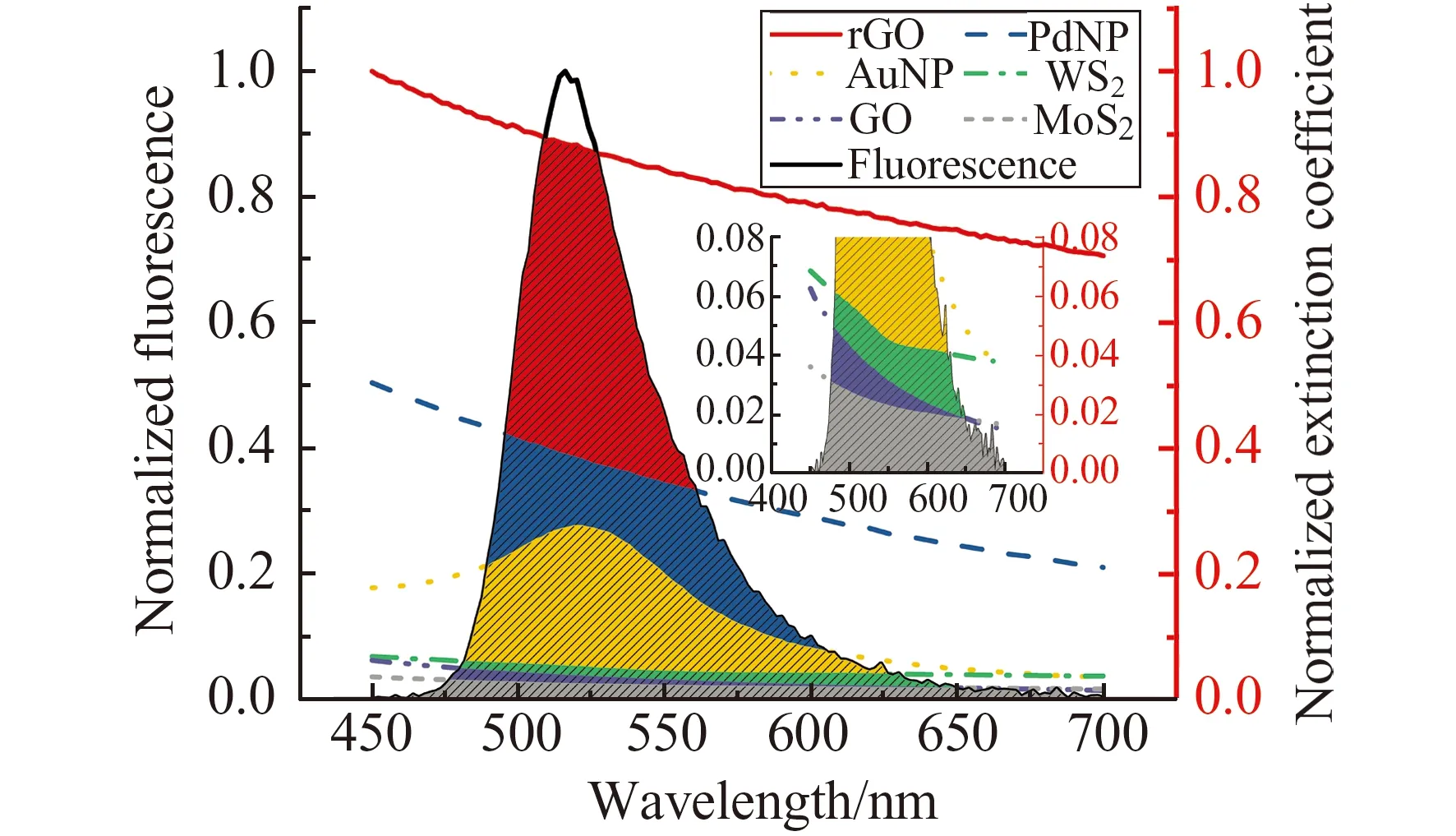
图4 6种纳米材料紫外可见吸收光谱与FAM发射光谱重叠(插图:纵坐标小于0.1范围内的局部放大图)Fig.4 Emission spectrum of FAM and UV-vis absorption spectra of 6 nanomaterials,showing the spectral overlap integral(Inset:Y-axis amplification of the spectra in the range of 0-0.08)

表3 6种纳米材料与FAM的光谱重叠面积
2.4 FAM荧光猝灭比较
在用6种纳米材料做能量受体猝灭标记在DNA上的FAM时,结果出乎意料。我们用每一种材料分别猝灭不同长度的dsDNA和ssDNA,以分析各种材料在不同距离下对FAM的猝灭效果。实验中我们考虑到溶液体系能量受体自身内滤作用所引起的荧光猝灭,以完全互补的dsDNA作为对照实验。从结果(图5)可见,其中以rGO的猝灭效果最优,只需要3 μg/mL的浓度便能猝灭ssDNA达到95%以上,其次是GO,10 μg/mL的浓度同样能猝灭ssDNA 90%以上。PdNPs、AuNPs、WS2都能达到80%左右的猝灭率,但相对而言AuNPs用了60 μg/mL,PdNPs和WS2分别用了150 μg/mL和200 μg/mL。MoS2的猝灭效率最低,200 μg/mL只产生了50%的猝灭。
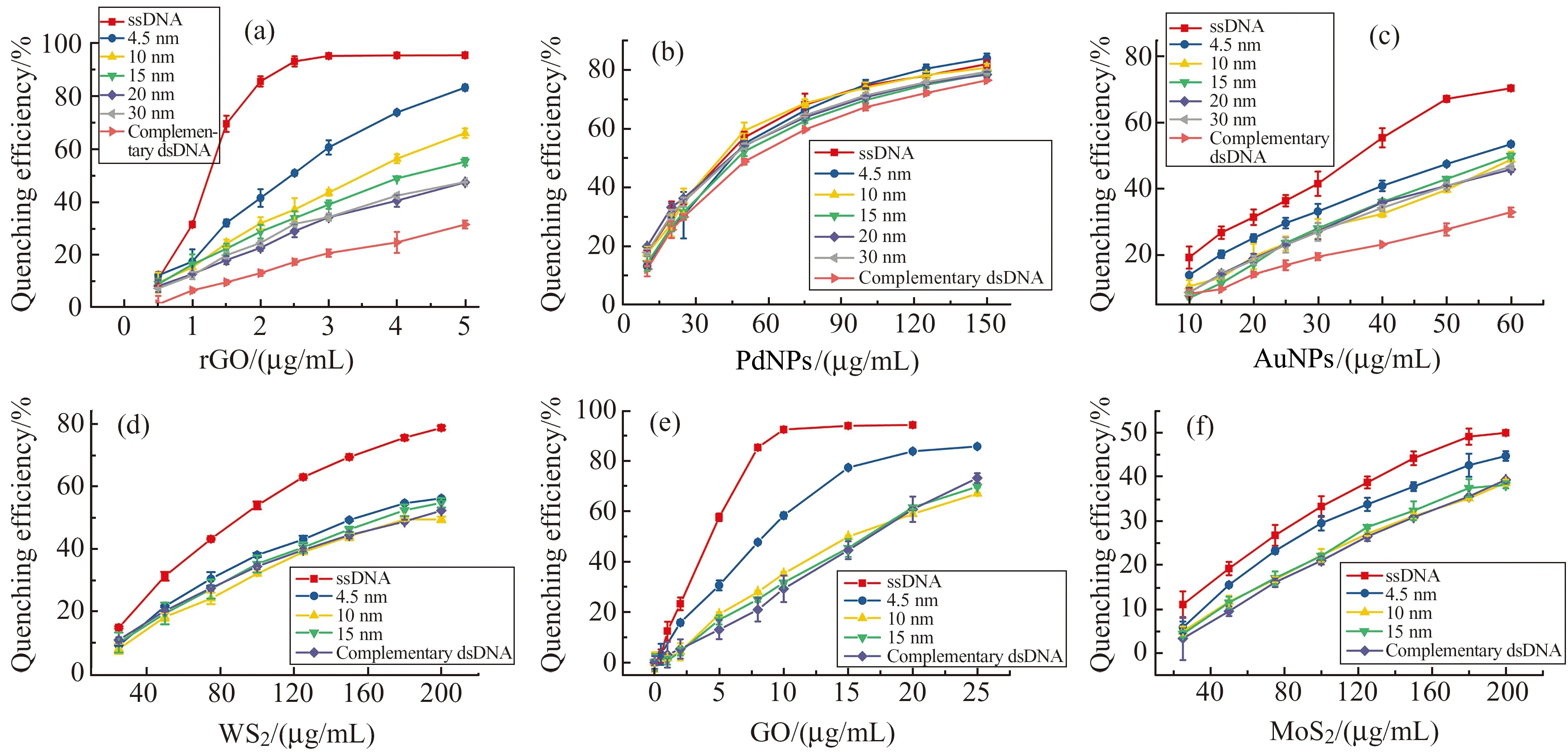
图5 rGO(a)、PdNPs(b)、AuNPs(c)、WS2(d)、GO(e)和MoS2(f)在不同浓度下对不同DNA的荧光猝灭效率Fig.5 Fluorescence quenching of FAM in the presence of different concentrations of rGO(a),PdNPs(b),AuNPs(c),WS2(d),GO(e) and MoS2(f)
另一方面,FRET是受距离限制的,虽然我们无法从理论上计算各种材料的Förster半径,但通过实验可以初步了解不同材料与FAM组成FRET对时的距离限制。比较每一种材料对不同长度DNA的荧光猝灭率,我们发现,除PdNPs外的5种材料都表现出了距离相关的猝灭情况。WS2作为能量受体的距离要求较高,4.5 nm长的双链结构已经限制了FRET的发生,表现出来的荧光猝灭与完全互补的dsDNA一样,即都是WS2的内滤作用引起的猝灭。GO和MoS2的FRET距离限制与一般的有机荧光能量受体差不多,4.5 nm时还有一半左右的FRET效率,距离大于10 nm时则限制了FRET的发生。相对的,rGO和AuNPs则能发生长距离的FRET,即使使用了30 nm的dsDNA,仍表现出比完全互补dsDNA更高的猝灭效率,结果与文献报道相一致[7,19,20]。这长距离FRET已经被研究者们用于构建基于FRET的荧光传感器[19,20]。
当我们把6种纳米材料对ssDNA的猝灭效率扣除由内滤效应引起的猝灭,便可获到6种材料实际通过FRET猝灭FAM的能力(图6)。由结果可知,rGO依旧是最优的荧光能量受体,其次是GO、AuNPs、WS2和MoS2,PdNPs 在该实验条件下几乎不表现出FRET,FRET效率与理论分析大相径庭;且WS2和MoS2只有不高于30%的FRET猝灭效率,与文献报道[22,25]相去甚远。这是由于不同的实验条件影响了纳米材料与DNA相互作用,从而影响了FRET的发生。

图6 6种纳米材料对ssDNA的FRET猝灭效率比较Fig.6 Comparison of FRET-based quenching of FAM labeled on ssDNA by 6 nanomaterials。EFRET:FRET efficiencyEFRET = EssDNA-EdsDNA;EssDNA:quenching efficiency to single-stranded DNA;EdsDNA:quenching efficiency to completely complementary paired double-stranded DNA.
图7中的结果说明了实验条件对FRET的影响。从图中可见,透析处理除去多余Li+的WS2和MoS2以完全互补的dsDNA为对照,能明显地猝灭ssDNA。但相对的,含有大量Li+的WS2和MoS2猝灭率与完全互补的dsDNA一样,完全只是由内滤作用猝灭了ssDNA。另外,我们还设计了一个实验来验证PdNPs与DNA之间是由于没有相互作用而不发生FRET(图8a)。当DNA与PdNPs混合,若DNA与PdNPs不发生相互作用,则经过离心后,PdNPs沉淀下来,上清液不存在PdNPs而失去内滤作用引起的荧光猝灭,恢复了DNA上FAM的荧光;相反,若DNA与PdNPs相互作用而被吸附于PdNPs表面,则经过离心后,被吸附的DNA与PdNPs 一同沉淀下来,上清液则由于DNA 浓度降低而荧光强度有所下降。据此,我们可知道DNA与PdNPs之间是否发生相互作用。实验结果如图8b(上层)所示,虽然ssDNA和不同长度的dsDNA与PdNP混合都会使荧光猝灭,但离心后,上清液的荧光强度分别恢复到了与ssDNA和dsDNA对照一致。相对的,用作对照实验的AuNPs离心后,上清液的荧光强度明显低于ssDNA和dsDNA对照(图8b,下层)。需要说明的是,ssDNA和dsDNA对照的荧光强度差异是来自于G碱基对荧光基团的猝灭[33,34],杂交成双链后G与C互补配对,削弱了G碱基对荧光基团的各种猝灭作用[34],从而使荧光增强。由结果表明,PdNPs的确没有与DNA相互作用,而Li+使WS2/MoS2与FAM标记的ssDNA之间失去FRET。因此,在实际应用中,我们需要注意控制实验条件,以确保FRET的发生,并获得最大的FRET效率。
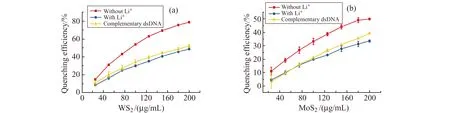
图7 不同浓度的含有LiOH稳定剂(未透析处理)与不含LiOH(透析处理)的WS2(a)和MoS2(b)对ssDNA的荧光猝灭效率。实验中以材料对完全互补的dsDNA猝灭率为参比Fig.7 Comparison of fluorescence quenching by WS2(a) and MoS2(b) with and without Li+.The quenching of complementary dsDNA was set as control
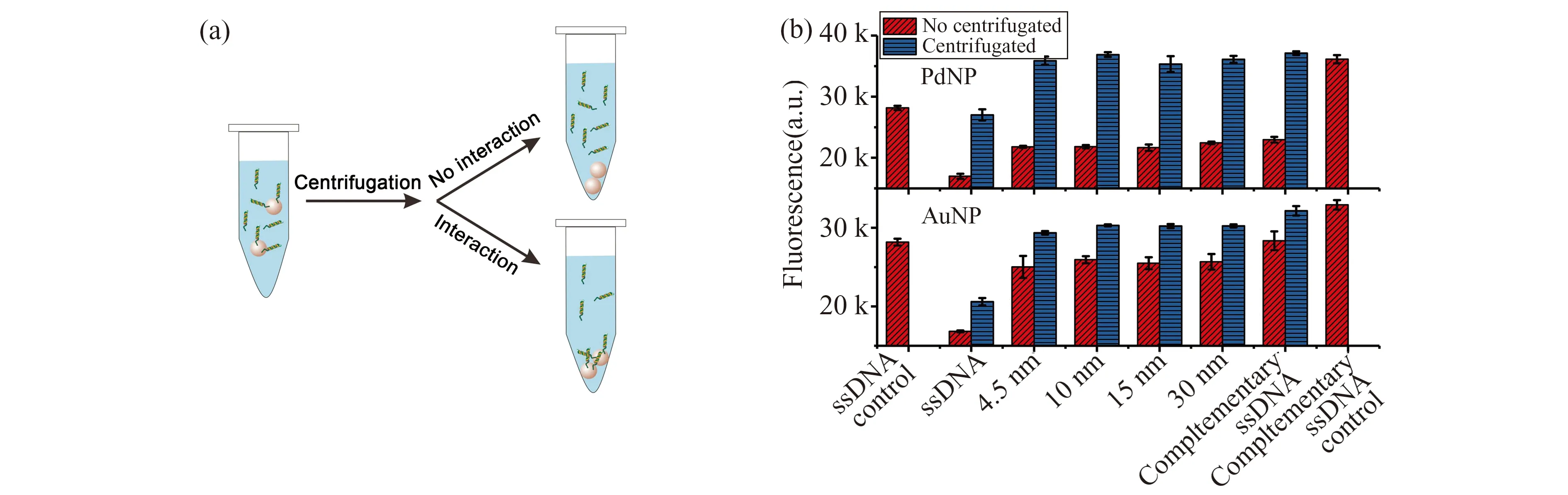
图8 (a)验证DNA与纳米材料相互作用示意图;(b) 75 μg/mL PdNPs(上层)和35 μg/mL AuNPs(下层)与不同DNA混合,离心前后的荧光强度Fig.8 (a) Scheme of the validation of DNA-nanomaterials interactions;(b) Fluorescence intensities of the tests for 75 μg/mL PdNPs(upper) and 35 μg/mL AuNPs(lower) with different DNA
3 结论
本文以标记在DNA上的FAM为荧光能量供体,从理论上和实验上比较了rGO、GO、PdNPs、AuNPs、WS2和MoS2这6种纳米材料作为荧光能量受体,通过FRET猝灭FAM荧光的能力。理论上6种材料都能作为FAM的荧光能量受体,其中以rGO最优,PdNPs次之。但实验结果表明,横向比较6种材料,rGO的FRET效率最高,只需3 μg/mL的浓度可将ssDNA上的FAM猝灭达到95%,其次是GO,AuNPs,WS2和MoS2,PdNPs则由于在此研究条件下与ssDNA没有相互作用而不表现出FRET猝灭。当纵向比较同一材料对不同长度DNA的猝灭时,我们发现6种材料作为荧光能量受体所受到的距离限制不一样,rGO和AuNPs表现出长距离的FRET,与文献报道的结论相一致;GO和MoS2与其它荧光能量受体一样,当供-受体距离小于10 nm时才发生FRET;WS2则对距离的要求相对较高,供-受体距离为4.5 nm时已限制了FRET。另外,我们还发现WS2和MoS2溶液中加入LiOH做稳定剂时,材料失去了与ssDNA的相互作用。
综上所述,在以FAM标记的DNA为能量供体的FRET研究中,rGO在理论上和实验上都是最佳的能量受体。在实际应用中,当使用纳米材料做荧光能量受体时要注意控制实验条件,这对材料与DNA的相互作用有很大影响,从而影响FRET效率。

