HOXA-AS2靶向miR-17对人脐静脉内皮细胞生物学功能以及炎症因子的影响
王磊 艾文 方叶青 陈之杰 邱小燕 李华英 谢培益
心脑血管疾病已成为当今社会最主要的致死和致残疾病,严重危害人类健康和生活质量,动脉粥样硬化(atherosclerosis,AS)是血管系统疾病的主要病理基础,其发生机制复杂,内皮细胞损伤和炎症因子均与其发生发展有关[1],研究AS 发生发展的分子机制,制定有效的预防和治疗措施,对提高AS整体防治水平具有重要意义[2]。研究发现长链非编码RNA(long non-coding RNA,lncRNA)与血管炎症、内皮细胞和血管平滑肌细胞密切相关,在AS发生发展中发挥重要作用[3]。HOXA 反义RNA 2(HOXA cluster antisense RNA 2,HOXA-AS2)是一种lncRNA,研究显示HOXA-AS2可抑制恶性神经胶质瘤行为和血管拟态形成[4],HOXA-AS2 敲低可抑制非小细胞肺癌细胞增殖,诱导细胞凋亡并抑制迁移和侵袭[5],HOXA-AS2通过抑制NF-κB信号传导的激活抑制内皮炎症[6],然而HOXA-AS2对AS模型细胞生物学功能、炎症因子的影响及其机制尚不清楚。miRNA 也参与调控AS形成、发展的病理生理过程,在AS 中也起重要作用[7],研究显示miR-17 在AS患者的血液中高表达,通过靶向自噬相关基因7(autophagy related gene 7,ATG7)促进巨噬细胞凋亡和炎症因子的表达[8],miR-17 高表达于冠心病患者血清,与患者冠状动脉病变程度、侧支循环形成及血清氧化型低密度脂蛋白(oxidized lowdensity lipoprotein,ox-LDL)水平密切相关[9],抑制miR-17-5p通过上调ATP 结合盒转运蛋白A1(ATPbinding cassette transporterA1,ABCA1)减少巨噬细胞RAW264.7 中炎症因子的产生和脂质积聚[10],但miR-17对AS模型细胞生物学功能以及炎症因子的影响尚未清楚。本实验旨在研究HOXA-AS2靶向miR-17对AS模型细胞生物学功能、炎症因子的影响及其机制。
材料与方法
一、材料
人脐静脉内皮细胞株EA.hy926(上海莼试生物技术有限公司);胎牛血清、DMEM培养基(美国Sigma公司);氧化型低密度脂蛋白(oxidized lowdensity lipoprotein,ox-LDL)(广州奕源生物科技有限公司);Trizol试剂、反转录试剂盒、荧光定量试剂盒(美国Progema公司);蛋白提取试剂盒、二辛可宁酸(bicinchoninic acid,BCA)试剂盒、RIPA蛋白裂解液、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)试剂盒、四甲基偶氮唑盐比色法(MTT)试剂盒、膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和碘化丙锭(PI)试剂盒(碧云天生物技术研究所);双荧光素酶报告基因检测试剂盒(北京Solarbio公司);抗体(武汉维诺赛生物技术有限公司);酶联免疫吸附试剂盒(ELISA)(上海继锦化学科技有限公司);LipofectamineTM2000转染试剂(美国Invitrogen公司);CO2孵育箱、Thermo FC酶标仪(美国Thermo公司);FACSCanto Ⅱ流式细胞仪(美国Bio-Rad公司)。
二、方法
1.细胞培养:EA.hy926细胞用含10﹪胎牛血清的DMEM培养液在37℃、5﹪ CO2条件下培养,2 d换液1次,取对数生长期细胞进行实验。
2.细胞处理与分组:按照参考文献[11]的处理方法对细胞进行处理分组;一共分为4个实验;实验1:用100μg/mL的ox-LDL处理EA.hy926细胞作为ox-LDL组,正常培养的细胞作为对照组;实验2:将pcDNA3.1、pcDNA3.1-HOXA-AS2转染至EA.hy926细胞中再用100μg/mL的ox-LDL处理,记为ox-LDL+pcDNA3.1组、ox-LDL+pcDNA3.1-HOXA-AS2组;实验3:将pcDNA3.1、pcDNA3.1-HOXA-AS2、si-NC、si-HOXA-AS2分别转染组、pcDNA3.1-HOXA-AS2组、si-NC组、si-HOXA-AS2组;实验4:将pcDNA3.1-HOXA-AS2 与miR-NC、miR-17分别共转染至EA.hy926细胞中再用100μg/mL的ox-LDL处理,记为ox-LDL+pcDNA3.1-HOXAAS2+miR-NC组、ox-LDL+pcDNA3.1-HOXAAS2+miR-17组。
3.实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)检测HOXA-AS2和miR-17的表达水平:各组细胞培养48 h,提取总RNA,将RNA 反转录成cDNA,按照荧光定量试剂盒使用说明进行PCR,每个样品设3个重复,实验重复3次。循环条件为95℃ 5 min,95℃ 30 s,60℃ 30 s;72℃ 30 s,共40个循环;60℃延长5 min。相对表达量用2-△△Ct法计算。HOXA-AS2和miR-17分别以GAPDH和U6为内参。(表1)
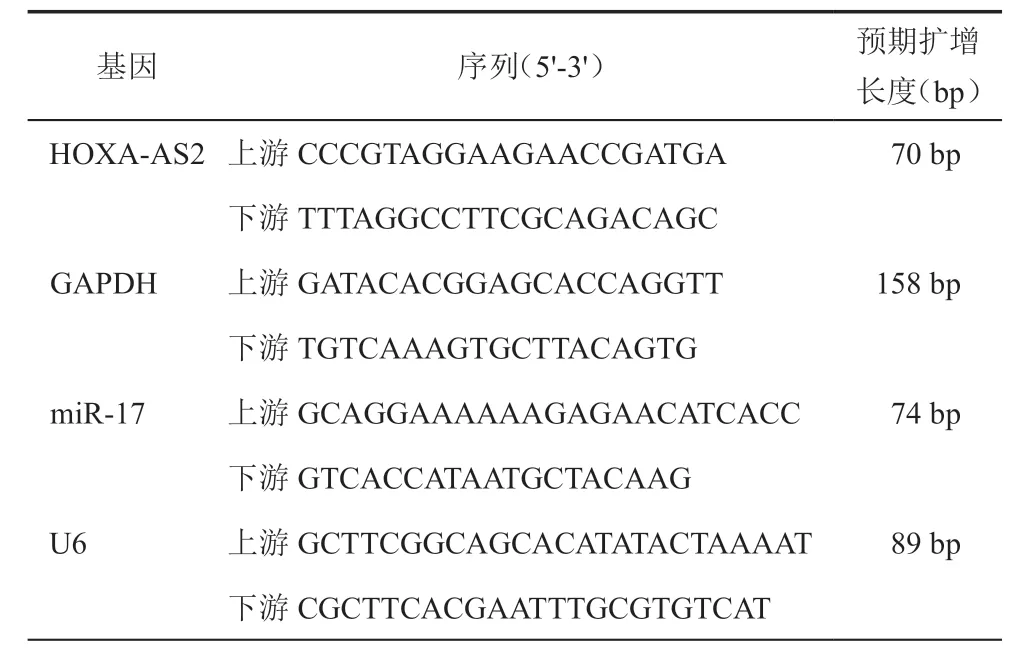
表1 引物序列信息
4.蛋白质印迹(Western blot)法检测P21、cleaved caspase 3、caspase3蛋白表达:提取各组细胞总蛋白,用BCA试剂盒进行蛋白定量。各组蛋白上样量60 μg,SDS-PAGE后,经电转将蛋白转移至PVDF上。用5﹪脱脂牛奶室温封闭90 min,分别加入相应的一抗,4℃孵育过夜,PBS洗涤3次,每次5 min;再加入二抗室温孵育2 h,PBS洗涤3次,每次10 min,后在暗室中曝光显影,再浸入定影液,最后洗去残液,晾干,将胶片用Quantity One 凝胶分析软件处理,测定各组蛋白条带的灰度值,以目的条带和GAPDH条带的比值作为蛋白表达水平。
5.MTT检测细胞增殖情况:在各组细胞培养48 h时,每孔分别加入5 mg/mL的MTT溶液20 μL,于培养箱中继续孵育4 h后弃去上清液,每孔加入DMSO 150 μL,振荡反应10 min,用酶标仪于波长490 nm处检测吸光度(OD)值。细胞增殖率(﹪)=实验组OD值/空白对照组OD值×100﹪。实验重复3次,每次设3个复孔。
6.流式细胞术检测细胞凋亡:各组细胞培养48 h后用预冷的PBS 漂洗2次,与500 μL的结合缓冲液混匀。先加入10 μL的Annexin V-FITC,再加入5 μL的PI,混匀后避光孵育10 min。用流式细胞仪检测细胞凋亡率。每组设3个复孔,实验重复3次。
7.酶联免疫吸附法(ELISA)法检测IL-1、IL-6水平:各组细胞培养48 h后取上清,具体按照试剂盒操作进行检测。每组设3个复孔,实验重复3次。
8.荧光素酶报告实验检测HOXA-AS2对miR-17的靶向调控:构建野生型和突变型基因靶点HOXA-AS2的荧光素酶表达载体WT-HOXA-AS2和MUT-HOXA-AS2,用LipofectamineTM2000 将WT-HOXA-AS2和MUT-HOXA-AS2分别与miRNC、miR-17、anti-miR-NC、anti-miR-17共转染至EA.hy926细胞中。按照说明书检测荧光素酶活性,实验重复3次,每次设3个复孔。
三、统计学分析方法
采用SPSS 20.0统计软件进行统计分析,HOXA-AS2、miR-17、P21、cleaved caspase 3、caspase3 相对表达水平,细胞增殖率,细胞凋亡率,IL-1和IL-6水平用表示,两组间比较采用独立样本t检验,多组间比较采用方差分析,组间两两比较采用LSD-t检验,以P<0.05表示差异有统计学意义。
结 果
一、HOXA-AS2在ox-LDL作用的EA.hy926细胞中的表达
与对照组比较,ox-LDL组EA.hy926细胞中HOXA-AS2表达水平及细胞增殖率降低,P21、cleaved caspase3、caspase3表达水平和细胞凋亡率升高,差异有统计学意义(P<0.05)(图1,表2)。

图1 对照组与ox-LDL组细胞相关指标的差异
二、过表达HOXA-AS2对ox-LDL作用的EA.hy926细胞增殖、凋亡的影响
与ox-LDL+pcDNA3.1组比较,ox-LDL+pcDNA3.1-HOXA-AS2组EA.hy926细胞中HOXAAS2表达水平和细胞增殖率升高,P21、cleaved caspase 3、caspase3表达水平和细胞凋亡率降低(P<0.05,图2,表3)。
三、过表达HOXA-AS2对ox-LDL作用的EA.hy926细胞中IL-1和IL-6表达的影响
与对照组比较,ox-LDL组EA.hy92细胞6中IL-1、IL-6水平升高(t= 11.752、11.675,P均<0.001);与ox-LDL+pcDNA3.1组比较,ox-LDL+pcDNA3.1-HOXA-AS2组EA.hy926细胞中IL-1、IL-6水平降低(t= 8.085、8.911,P<0.001)(表4)。
表2 HOXA-AS2的表达及ox-LDL处理对EA.hy926细胞增殖率、凋亡率及P21、cleaved caspase 3蛋白表达的影响(±s,n = 3)
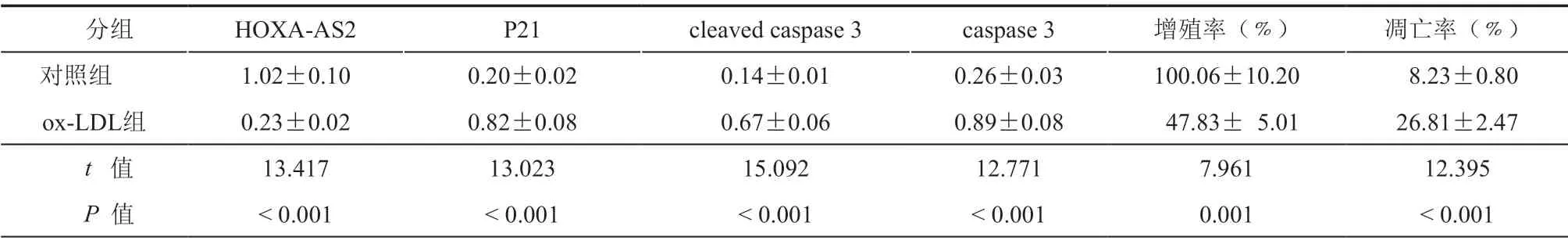
表2 HOXA-AS2的表达及ox-LDL处理对EA.hy926细胞增殖率、凋亡率及P21、cleaved caspase 3蛋白表达的影响(±s,n = 3)
注:n为实验重复次数
分组 HOXA-AS2 P21 cleaved caspase 3 caspase 3增殖率(﹪)凋亡率(﹪)对照组 1.02±0.10 0.20±0.02 0.14±0.01 0.26±0.03 100.06±10.20 8.23±0.80 ox-LDL组 0.23±0.02 0.82±0.08 0.67±0.06 0.89±0.08 47.83± 5.01 26.81±2.47 t 值 13.417 13.023 15.092 12.771 7.961 12.395 P 值<0.001<0.001<0.001<0.001 0.001<0.001

图2 过表达HOXA-AS2对ox-LDL作用的EA.hy926细胞增殖、凋亡的影响
表3 过表达HOXA-AS2对ox-LDL处理的EA.hy926细胞增殖率、凋亡率及P21、cleaved caspase 3、caspase3蛋白表达的影响(±s,n = 3)
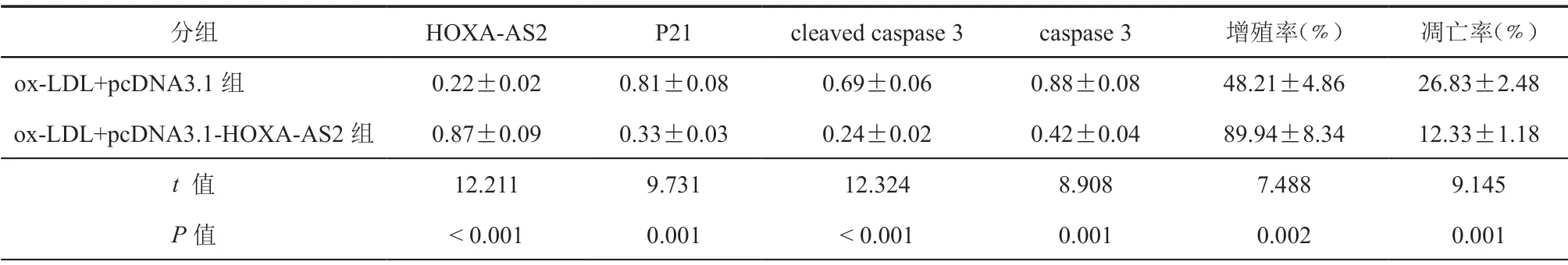
表3 过表达HOXA-AS2对ox-LDL处理的EA.hy926细胞增殖率、凋亡率及P21、cleaved caspase 3、caspase3蛋白表达的影响(±s,n = 3)
注:n为实验重复次数
分组 HOXA-AS2 P21 cleaved caspase 3 caspase 3增殖率(﹪)凋亡率(﹪)ox-LDL+pcDNA3.1组 0.22±0.02 0.81±0.08 0.69±0.06 0.88±0.08 48.21±4.86 26.83±2.48 ox-LDL+pcDNA3.1-HOXA-AS2组 0.87±0.09 0.33±0.03 0.24±0.02 0.42±0.04 89.94±8.34 12.33±1.18 t 值 12.211 9.731 12.324 8.908 7.488 9.145 P值<0.001 0.001<0.001 0.001 0.002 0.001
表4 过表达HOXA-AS2对ox-LDL作用的EA.hy926细胞中IL-1和IL-6表达的影响(±s,n = 3)

表4 过表达HOXA-AS2对ox-LDL作用的EA.hy926细胞中IL-1和IL-6表达的影响(±s,n = 3)
注:与对照组比较,aP <0.05;与ox-LDL组比较,bP <0.05;与ox-LDL+pcDNA3.1组比较,cP <0.05;n为实验重复次数
分组 IL-1(ng/L)IL-6(ng/L)对照组 326.14±34.59 19.25±2.11 ox-LDL组 792.34±59.37a 53.67±4.65a ox-LDL+pcDNA3.1组 802.21±60.18a 55.21±5.10a ox-LDL+pcDNA3.1-HOXA-AS2组 446.25±46.84bc 25.64±2.65bc F值 200.722 212.214 P值<0.001<0.001
四、HOXA-AS2靶向调控miR-17
Starbase数据库预测显示HOXA-AS2 与miR-17存在结合位点(图3)。荧光素酶报告实验显示,与miR-NC组比较,miR-17组中转染野生型表达载体WT-HOXA-AS2的EA.hy926细胞荧光素酶活性降低(t= 11.281,P<0.05),而转染突变型表达载体MUT-HOXA-AS2的EA.hy926细胞荧光素酶活性差异无统计学意义;与anti-miR-NC组比较,anti-miR-17组中转染野生型表达载体WT-HOXAAS2的EA.hy926细胞荧光素酶活性升高(t= 9.606,P<0.05),而转染突变型表达载体MUT-HOXAAS2的EA.hy926细胞荧光素酶活性差异无统计学意义(表5)。miR-17表达水平比较,pcDNA3.1-HOXA-AS2组(0.34±0.03)比pcDNA3.1组(1.04±0.10)降低,si-HOXA-AS2组(2.14±0.22)比si-NC组(0.99±0.10)升高(P均<0.05)。
五、过表达miR-17能逆转HOXA-AS2对ox-LDL作用的EA.hy926细胞增殖、凋亡及IL-1和IL-6表达的影响
与ox-LDL+pcDNA3.1-HOXA-AS2+miR-17组比较,ox-LDL+pcDNA3.1-HOXA-AS2组和ox-LDL+pcDNA3.1-HOXA-AS2+miR-NC组EA.hy926细胞中P21、cleaved caspase 3、caspase 3表达水平和细胞凋亡率降低,IL-1和IL-6水平和细胞增殖率升高(P<0.05),ox-LDL+pcDNA3.1-HOXA-AS2组和ox-LDL+pcDNA3.1-HOXA-AS2+miR-NC组之间各指标差异无统计学意义(图4,表6~7)。

图3 HOXA-AS2靶向miR-17
表5 双荧光素酶报告实验对HOXA-AS2和miR-17靶向关系的验证(±s,n = 3)
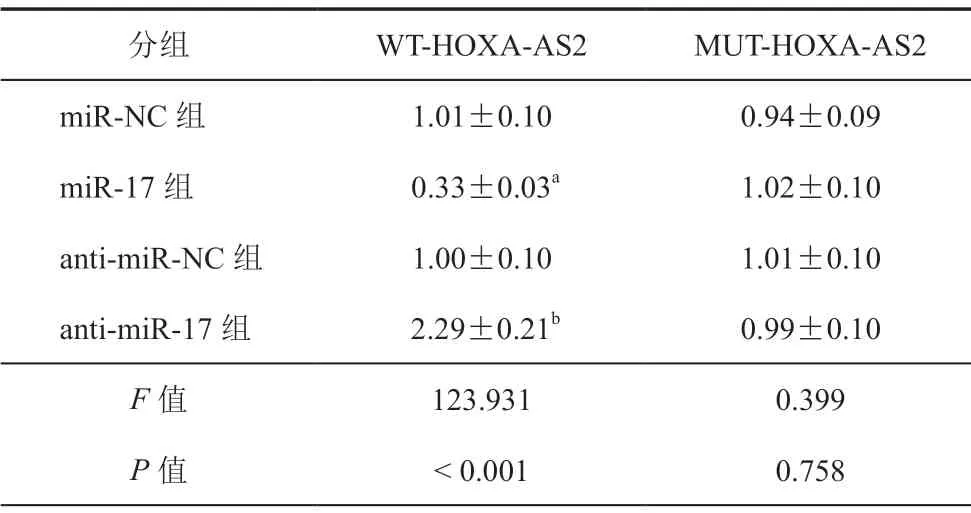
表5 双荧光素酶报告实验对HOXA-AS2和miR-17靶向关系的验证(±s,n = 3)
注:与miR-NC组比较,aP <0.05;与anti-miR-NC组比较,bP <0.05;n为实验重复次数
分组 WT-HOXA-AS2 MUT-HOXA-AS2 miR-NC组 1.01±0.10 0.94±0.09 miR-17组 0.33±0.03a 1.02±0.10 anti-miR-NC组 1.00±0.10 1.01±0.10 anti-miR-17组 2.29±0.21b 0.99±0.10 F值 123.931 0.399 P值<0.001 0.758
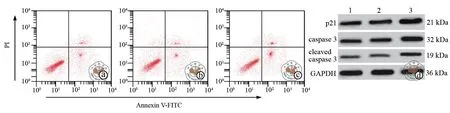
图4 过表达miR-17 在HOXA-AS2对ox-LDL作用的EA.hy926细胞增殖、凋亡中的影响
表6 过表达miR-17能逆转HOXA-AS2对ox-LDL作用的EA.hy926细胞中IL-1和IL-6表达及细胞增殖率的影响(±s,n = 3)

表6 过表达miR-17能逆转HOXA-AS2对ox-LDL作用的EA.hy926细胞中IL-1和IL-6表达及细胞增殖率的影响(±s,n = 3)
注:与ox-LDL+pcDNA3.1-HOXA-AS2组比较,aP <0.05;与ox-LDL+pcDNA3.1-HOXA-AS2+miR-NC组比较,bP <0.05;n为实验重复次数
分组细胞增殖率(﹪)IL-1(ng/L)IL-6(ng/L)ox-LDL+pcDNA3.1-HOXA-AS2组 90.23±9.24 452.01±42.96 26.14±2.42 ox-LDL+pcDNA3.1-HOXA-AS2+miR-NC组 90.21±9.16 451.21±43.58 26.11±2.39 ox-LDL+pcDNA3.1-HOXA-AS2+miR-17组 53.67±5.46ab 684.26±62.38ab 41.29±4.37ab F值 20.130 21.265 22.499 P值 0.002 0.002 0.002
表7 过表达miR-17能逆转HOXA-AS2对ox-LDL作用的EA.hy926细胞中P21、cleaved caspase 3、caspase 3 及凋亡率的影响(±s,n = 3)

表7 过表达miR-17能逆转HOXA-AS2对ox-LDL作用的EA.hy926细胞中P21、cleaved caspase 3、caspase 3 及凋亡率的影响(±s,n = 3)
注:与ox-LDL+pcDNA3.1-HOXA-AS2组比较,aP <0.05;与ox-LDL+pcDNA3.1-HOXA-AS2+miR-NC组比较,bP <0.05;n为实验重复次数
分组 P21 cleaved caspase 3 caspase 3 凋亡率(﹪)ox-LDL+pcDNA3.1-HOXA-AS2组 0.31±0.03 0.26±0.02 0.41±0.04 12.55±1.35 ox-LDL+pcDNA3.1-HOXA-AS2+miR-NC组 0.32±0.03 0.27±0.02 0.42±0.04 12.63±1.42 ox-LDL+pcDNA3.1-HOXA-AS2+miR-17组 0.73±0.07ab 0.56±0.05ab 0.79±0.07ab 23.31±1.95ab F值 77.149 79.182 52.111 45.119 P值<0.001<0.001<0.001<0.001
讨 论
AS属于常见的血管病变,有着较高的发病率与死亡率,尽早诊断与治疗对于改善患者的预后,提高生活质量有着积极的意义[12]。血管炎症、内皮细胞功能损伤与障碍均与AS密切相关,深入研究其相关机制对防治AS以及进一步防治相关疾病意义重大[13]。研究显示,内皮细胞功能损伤可促使多种炎性因子的分泌及粥样斑块形成[14]。炎性相关因子也参与了AS的形成发展过程,AS模型大鼠血清中白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)高表达[15]。本实验用ox-LDL作用人脐静脉内皮细胞株EA.hy926结果显示,细胞增殖率降低,细胞凋亡率、IL-1、IL-6水平升高。说明ox-LDL 可导致内皮细胞损伤和炎症因子的释放,表明AS细胞模型建立成功。
研究发现lncRNA 参与调节AS的发生发展[16]。敲低HOXA-AS2 可通过抑制细胞增殖并加速凋亡来抑制乳头状甲状腺癌的进展[17]。敲低HOXAAS2抑制肝细胞癌增殖,并促进细胞凋亡[18]。本研究结果显示,ox-LDL作用的EA.hy926细胞中HOXA-AS2表达水平降低,然而HOXA-AS2对AS的影响尚未可知。本实验通过转染HOXA-AS2过表达载体至ox-LDL作用的EA.hy926细胞中,研究HOXA-AS2对AS细胞模型的增殖、凋亡和炎性因子的影响,结果显示,ox-LDL作用的EA.hy926细胞中P21、cleaved caspase 3、caspase 3表达水平、细胞凋亡率降低,细胞增殖率升高,IL-1、IL-6水平降低。说明过表达HOXA-AS2 促进EA.hy926细胞增殖,抑制ox-LDL作用的EA.hy926细胞凋亡和炎症因子的产生。
有研究显示,过表达miR-17 可通过靶向胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)促进细胞增殖并抑制ox-LDL诱导的内皮细胞凋亡[19]。抑制miR-17-5p 可以通过减轻AS小鼠主动脉的炎症反应和氧化应激水平缓解AS 病变[20]。说明miR-17具有调节细胞凋亡和炎症反应的作用。此外,还有研究报道LncRNA SNHG16通过miR-17-5p/NF-κB信号通路促进AS患者巨噬细胞的增殖和炎症反应[21]。说明lncRNA可通过调控miR-17影响细胞的生物学行为,本实验用Starbase数据库预测显示HOXA-AS2与miR-17存在结合位点,进一步通过双荧光素酶报告实验验证表明HOXAAS2 可靶向调控miR-17的表达。本实验结果显示,ox-LDL作用的EA.hy926细胞中miR-17高表达,同时过表达miR-17和HOXA-AS2后,P21、cleaved caspase 3、caspase 3表达水平、细胞凋亡率、IL-1和IL-6水平升高,细胞增殖率降低,说明过表达miR-17逆转了HOXA-AS2过表达对ox-LDL作用的EA.hy926细胞增殖、凋亡及炎性因子的影响,提示HOXA-AS2可能通过调控miR-17影响ox-LDL作用的EA.hy926细胞增殖、凋亡及炎性因子水平。
综上所述,过表达HOXA-AS2可促进细胞增殖,抑制ox-LDL作用的细胞凋亡和炎症因子的释放,其机制可能与miR-17有关。

