苏北及周边地区水禽致病性大肠杆菌的分离鉴定及耐药性分析
胡紫萌,王卓昊,吴 坤,徐正军,魏 丹,郭庚霖,李 敏,董永毅,张 炜*
(1. 南京农业大学 动物医学院,江苏 南京 210095;2. 江苏省动物疫病预防控制中心,江苏 南京 210036)
禽致病性大肠杆菌(Avian pathogenic Escherichia coli,APEC)属于肠道外致病性大肠杆菌(Extraintes⁃tinal pathogenic Escherichia coli,ExPEC)[1],可引起禽大肠杆菌病,肝周炎、心包炎、气囊炎等炎症,并可引起禽类的大量死亡。APEC 也常感染鸭鹅等水禽,而江苏省作为水禽养殖大省,感染APEC 水禽的发病和死亡会给养殖业造成重大的经济损失。随着对抗生素的大范围应用甚至滥用,使得大肠杆菌对常用抗生素的耐药性日益严重,给临床治疗带来了严峻的挑战[2]。目前检测细菌耐药表型的传统方法主要有纸片扩散法、肉汤稀释法、E 试验、MIC 值测定法,其中,药敏纸片法是实验室检测和医院临床检测较为常用的方法。另外,也可以根据细菌耐药相关基因的检测,对细菌的耐药性进行评估和分析[3]。
本研究对2018 年~2019 年从苏北及周边地区某水禽养殖场采集的228 份水禽病料中分离鉴定APEC,并对分离的APEC 进行耐药表型以及耐药基因的检测,为探究苏北及周边地区APEC 的耐药性以及耐药机制提供参考依据。
1 材料与方法
1.1 主要实验材料大肠杆菌ATCC25922 质控菌株为本实验室保存;228 份临床样品为本实验室于2018 年12 月~2019 年4 月采集自苏北及周边地区水禽养殖场发病死亡的水禽(鸭头78 份、鸭肝61 份;鹅头55、鹅肝34 份)。
Todd Hewitt Broth 购自美国BD 公司;麦康凯培养基、MH 培养基、LB 培养基购自青岛海博生物技术有限公司;绵羊血购自南京鼎思生物技术有限公司;药敏纸片购自杭州微生物试剂有限公司;ddH2O、2xRapid TaqMaster Mix 购自南京诺唯赞生物科技有限公司。
1.2 临床样品的分离培养与PCR 鉴定采用接种环蘸取采集的鸭鹅脑组织或肝脏样品,涂布在麦康凯琼脂培养基上,置于37 ℃培养24 h,观察菌落生长情况并挑取麦康凯琼脂培养基上的单菌落,置于THB 液体培养基中培养4 h~6 h 后,对细菌进行革兰氏染色镜检。同时采用APEC 特异性检测引物进行菌液PCR 检测,PCR 产物由苏州金唯智公司测序,引物序列:EC-F:GCCTCGCCTGGAGAATGA/EC-R:CCTGAGACTGCGGTGGAA[4],引物由南京擎科生物有限公司合成。
1.3 分离菌株的药敏试验参照CLSI(Clinical and Laboratory Standard Institute,2019)推荐的K-B 纸片扩散法及结果判定,将1.2 分离的菌株进行8 大类,共计11 种药物的药敏试验。包括青霉素类:氨苄西林;头孢类:头孢噻肟;碳青霉烯类:美罗培南;氨基糖苷类:庆大霉素、丁胺卡那霉素、链霉素;四环素类:四环素;氟喹诺酮类:氧氟沙星、恩诺沙星;硝基呋喃类:呋喃妥因;氯霉素类:氟苯尼考,以ATCC25922 为质控菌株。同时分析分离菌株的多重耐药情况。
1.4 分离菌株的耐药基因检测设计包括碳青霉烯类(NDM、KPC、GES、SME、IMI)、β-内酰胺类(TEM、CTX-M、SHV)、氨基糖苷类(aac(3')- Ib、ant(3'')- Ia)、磺胺类(sul I)、粘菌素类(mcr-1)、喹诺酮类(qnrB、parC)、四环素类(tetA、tetB)7 大类共计16 对耐药基因检测引物(如读者需要作者可以提供相关引物信息)。以1.2 THB 液体培养基中培养4 h~6 h 得到的菌液为模板,采用相应引物分别进行PCR 扩增其耐药基因。
1.5 分离APEC 的改良Hoge 试验参照文献[5],采用改良Hoge 试验检测1.3 分离菌株药敏试验中对美罗培南耐药的APEC 菌株是否产碳青霉烯酶:将0.5 号麦氏标准浊度的大肠杆菌ATCC25922 菌悬液用MH 培养基按1:10 稀释后按照常规药敏试验操作要求接种到MH 琼脂(MHA)平板上,于3 min~10 min 后将美罗培南药敏纸片贴于平板中央,以此为指示菌。经1.4 耐药基因检测结果确定的产碳青霉烯酶类耐药基因的APEC 划线接种于血琼脂培养板上过夜培养,分别挑取其3~5 个单菌落,在上述MHA 平板上由平板边缘向中心划线接种,接种线长20 mm~25 mm。将以上平板置于37 ℃孵育16 h~20 h,检查MHA 平板上的APEC 菌株的划线部分与美罗培南纸片抑菌圈边缘交叉部分的ATCC25922 是否出现了类似苹果蒂样形状的增强性生长。
2 结 果
2.1 样品中的细菌分离鉴定结果将采集的鸭或者鹅的脑组织或肝脏组织样品划线接种于麦康凯培养基上,结果可见,在麦康凯培养基上长出红色、圆形、扁平、边缘整齐、表面光滑的菌落。挑取红色菌落经涂片固定后进行革兰氏染色后的细菌呈两端呈钝圆形,蓝紫色的棒状杆菌,与大肠杆菌的形状一致。将上述菌提取基因组后经特异性APEC PCR 鉴定并经测序结果比对,最后确定从228 份水禽样品中分离到了50 株APEC,其中从鸭的肝脏样品中分离到20株,鸭的脑组织样品中分离到7株,从鹅的肝脏样品中分离到12 株,鹅的脑组织样品中分离到11 株。结果表明,在鸭、鹅中均出现了APEC,且在其肝脏、脑组织样品中均有分布。
图1 分离菌株的革兰氏染色结果(1 000×)Fig.1 The gram staining of the bacterial isolate(1 000×)
2.2 分离的APEC 药敏试验结果药敏试验结果显示,分离的APEC 对美罗培南、呋喃妥因、丁胺卡那霉素较敏感,对其耐药的菌株仅占4%(2/50)、4%(2/50)、6%(3/50);对庆大霉素、氧氟沙星、链霉素、恩诺沙星中等耐药,耐药菌株占26%(13/50)、36%(18/50)、58%(29/50)、70%(35/50);对头孢噻肟、氟苯尼考、氨苄西林、四环素的耐药性较高,耐药菌株分别占76%(38/50)、86%(43/50)、96%(48/50)、100%(50/50)(表1)。其中耐9 种抗生素的菌株占6%(3/50),耐8 种抗生素的菌株占6%(3/50),耐7 种抗生素的菌株占12%(6/50),耐6 种抗生素的菌株占28%(14/50),耐5 种抗生素的菌株占22%(11/50),耐4 种抗生素的菌株占16%(8/50),耐3 种抗生素的菌株占2%(1/50),耐2种抗生素的菌株占2%(1/50),耐1种抗生素的菌株占4%(2/50)(图2)。上述结果表明分离到的APEC 耐药性较强,多重耐药现象较严重。
2.3 分离的APEC 耐药基因检测结果对分离菌株的耐药基因进行PCR 检测,结果显示,碳青霉烯类耐药基因NDM 的检出率为4%(2/50),未检出KPC、GES、SME、IMI 基因;β-内酰胺类:TEM的检出率为58%(29/50),CTX-M 的检出率为60%(30/50),SHV 的检出率为20%(10/50);氨基糖苷类:ant(3'')- Ia)的检出率为0,aac(3')- Ib 的检出率为50%(25/50);磺胺类:sul I 的检出率为82%(41/50);粘菌素类:mcr-1的检出率为6%(3/50);喹诺酮类:qnrB的检出率为68%(34/50),parC的检出率为98%(49/50);四环素类:tetA 的检出率为66%(33/50),tetB 的检出率为10%(5/50)。表明分离的APEC对parC、sul I、qnrB、CTX-M 的耐药基因检出率较高,且其对美罗培南、头孢噻肟、四环素的耐药表型与其耐药基因均存在相关性。

表1 分离的APEC 药敏试验结果Table 1 Statistics showing the results of drug susceptibility test on APEC
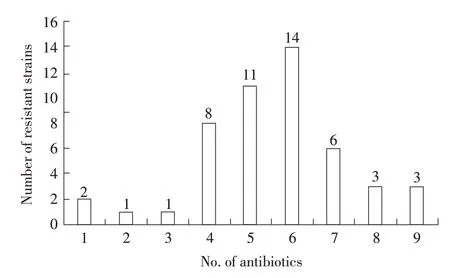
图2 50 株APEC 对11 种抗生素的多重耐药统计结果Fig.2 Statistics showing the results of multiple drug resistance of the 50 APEC isolates to 11 antibiotics
2.4 分离APEC 的改良Hoge 试验结果在2.2 的药敏试验中发现了2 株对碳青霉烯类抗生素美罗培南耐药的APEC,且该两株APEC 均携带碳青霉烯类耐药基因NDM,将其命名为EC162、EC171。经改良Hoge 试验结果显示,平板中的抑菌圈出现了类似苹果蒂样的形状,是由于EC162 和EC171 产生的碳青霉烯酶扩散到了美罗培南产生的抑菌圈区域中水解了该抗生素,使得该该区域中没有足够的美罗培南抑制大肠杆菌ATCC25922,使ATCC25922 出现了类似苹果蒂样形状的增强性生长(图3)。确认2 株菌均产碳青霉烯酶,可以水解碳青霉烯类抗生素,所以其对碳青霉烯类抗生素菌耐药。
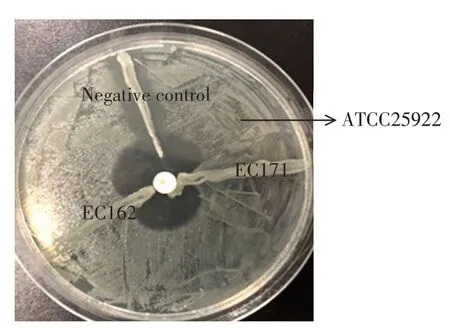
图3 APEC 产碳青霉烯酶的改良Hoge 试验结果Fig.3 Results of modified Hoge test of carbapenems produced by APEC
3 讨 论
抗生素一直是治疗细菌病的主要手段,但是随着对抗生素的不合理用药,导致细菌发生了基因转移或突变等产生了耐药性,给养殖场的临床用药带来了极大的挑战。本研究在苏北及周边地区的水禽养殖场中分离到了50 株APEC,对其进行了耐药表型和耐药基因型的检测。药敏试验结果显示,分离的APEC 对四环素、氨苄西林、氟苯尼考的耐药情况严重,耐药菌株分别高达100%、96%、86%,其中分离菌株对四环素的高耐药性可能是由于四环素长期被加入到畜禽饲料中作为添加剂所致。分离的APEC 对头孢噻肟、恩诺沙星、链霉素、氧氟沙星的耐药较为严重,耐药菌株分别占76%、70%、58%、36%;对美罗培南、呋喃妥因、丁胺卡那霉素的耐药性较低,耐药菌株仅分别占4%、4%、6%。氨基糖苷类的丁胺卡那霉素(敏感菌株占94%)作为畜禽养殖场临床常用药,其抗大肠杆菌效果良好,但是随着其频繁的使用,细菌在该抗生素的选择压力下也将会逐渐对其产生耐药性,因此在临床用药中要规范化的使用该抗生素。分离的APEC 虽然大多数均对硝基呋喃类的呋喃妥因(敏感菌株占82%)敏感,由于其会影响动物性食品安全,已被我国农业部规定禁用于食品动物。Solà-Ginés M 等人于2012 年在西班牙分离到的22 株APEC 中,对氨苄西林、头孢噻肟、丁胺卡那霉素、庆大霉素、氟苯尼考的耐药菌株分别占22%、41%、81%、84%、94%[6]。其中对氟苯尼考的耐药菌株比例与本研究无明显差异,而对氨苄西林、头孢噻肟、丁胺卡那霉素、庆大霉素的耐药情况则与本研究差异较大。Dou X 等人于2016 年在中国东部分离的243 株APEC中,对四环素耐药的菌株占98%,对链霉素的耐药菌株占79%[7],与本研究的APEC 对四环素和链霉素的耐药结果无明显差异。Subedi M 等人于2018 年在印度分离的50 株APEC 中,对氨苄西林、丁胺卡那霉素、呋喃妥因均较敏感,敏感菌株分别占98%、84%、55%[8],除了丁胺卡那霉素外,其分离的APEC 对其他抗生素的耐药性均与本研究存在明显差异。国内外APEC 对同一种抗生素的耐药性间的差异,可能与采样地域、采样时间、采样对象以及用药背景有关,这也从一定角度表明不同地区的APEC 菌株存在遗传多样性。
分离的APEC 菌株的多重耐药现象较严重,耐4、5、6、7 种抗生素的现象较普遍,共占78%。提示了苏北及周边地区水禽源APEC 严峻的耐药情况,这可能与养殖场长期不合理使用抗生素有关。虽然本研究APEC 的耐药结果与国内外的部分研究结果存在一些差异,但大体上与国内外APEC 的耐药趋势相符:随着兽医临床对抗生素的不断使用,耐药的APEC 菌株和多重耐药菌株数均在逐渐增加,耐药情况愈来愈严重。
耐药基因检测结果显示,除了碳青霉烯类和粘菌素类抗生素的耐药基因外,其他每种抗生素都有相关耐药基因的检出。耐药表型和耐药基因之间也存在着一定的关联性,例如50 株APEC 中,仅2 株APEC 对美罗培南耐药,并均检测到其耐药基因NDM,其余48 株APEC 均未检测出与碳青霉烯类抗生素相关的KPC、GES、SME、IMI 耐药基因。表明,由于碳青霉烯类抗生素禁用于动物,分离的APEC 大多对该药物敏感,且与其相关的耐药基因的检出率也较少。β-内酰胺类抗生素中的3 种常见耐药基因:CTX-M、TEM、SHV 的检出率较高,分别为60%、58%、20%。其中的CTX-M 是一种新型的超广谱β-内酰胺酶(Extended Spectrum Beta-lac⁃tamases,ESBLs),具有较强的水解头孢噻肟的能力,已成为亚洲国家流行的主要耐药基因型,这与Bonne R 等人研究的结果相符[9]。CTX-M 型ESBLs 在欧美等发达国家也有流行的趋势,有研究表明食源性动物中长期持续使用头孢噻肟等抗生素作为生长促进剂也会促进含ESBLs 病原菌的传播[10-11]。上述结果表明,不同的国家中均存在β-内酰胺类抗生素耐药性较严重的现象。
碳青霉烯类抗生素和多粘菌素一直被认为是抗革兰阴性菌感染的“最后一道防线”,碳青霉烯类抗生素是抗菌谱最广,抗菌活性最强的非典型β-内酰胺类抗生素,碳青霉烯类药物耐药菌的增加会给临床治疗带来极大的挑战[12]。2013 年,美国疾病控制和预防中心(CDC)发布了一份报告,概述了美国排名前18 位的抗药性威胁:碳青霉烯类耐药肠杆菌科位列其中[13]。目前,在世界范围内均出现了产碳青霉烯酶的细菌,特别是产新德里金属β-内酰胺酶(NDM-1)及其变体的细菌[14]。碳青霉烯类耐药基因NDM 自首次报道以来,便在全球范围内开始流行,虽然碳青霉烯类药物禁用于兽医临床,然而近几年国内外学者却均从食品动物源肠杆菌中检测到NDM基因,给人类健康带来严重威胁[15]。本研究在分离APEC 的药敏试验中发现了2 株APEC 对碳青霉烯类的美罗培南耐药,经PCR 检测出2 株菌均携带碳青霉烯类耐药基因NDM,经改良Hoge 试验检测该两株菌均产碳青霉烯酶,水禽中出现了碳青霉烯类耐药大肠杆菌,这与刘志海等人的研究一致[16]。在动物中检测到了NDM 基因,推测原因可能是通过携带NDM 基因的养殖场工作人员和动物间产生了交叉感染,或者是通过环境传播,例如动物食入了携带NDM 基因的食物,或者是其接触的环境中含有携带NDM 基因的耐药菌株等。
随着近年来对多粘菌素临床使用的增加,对其耐药的相关研究及报道也在增多[12]。Yang 等人于2010 年~2015 年对13 个中国省份鸡的大肠杆菌进行的调查显示,在4%(58/1136)的分离菌株中检测到多粘菌素耐药基因mcr-1[17];张召兴等人于2019 年从河北地区的禽中分离的42 株APEC 中发现32 株携带mcr-1[18];而本研究从50 株水禽源APEC 中仅鉴定出3 株mcr-1 阳性APEC,推测可能是由于不同地区养禽场抗生素使用情况不同或者是采样的随机性等原因导致了较大的耐药性差异。多粘菌素很少用于人医临床,但有研究显示在人的致病性大肠杆菌中出现了大量携带多粘菌素耐药基因mcr-1 的菌株,推测人可以通过接触或者食用携带mcr-1APEC 的动物,从而使得mcr-1 基因从动物传播到人[19]。
本研究对苏北及周边地区的水禽养殖场的鸭源、鹅源APEC 的耐药性进行了详细的分析,为后续APEC 耐药机制的研究奠定基础,为临床治疗相关疾病提供参考。

