载药微球经导管肝动脉化疗栓塞术治疗原发性肝癌患者的疗效及对血清胎盘生长因子、异常凝血酶原水平的影响
杜品清,刘云国,王东,黎庭贵,余建群
乐山市市中区人民医院放射科,四川 乐山614000
原发性肝癌(primary liver cancer,PLC)是临床常见的消化系统恶性肿瘤,中国发病人数占全球发病人数的一半以上[1]。PLC的恶性程度高,病死率位居恶性肿瘤第5位,且逐渐呈上升趋势[2]。目前,PLC的治疗方法主要包括手术切除和介入治疗等,其中,经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)是最主要的介入治疗方式,是中晚期PLC的首选治疗方法,可显著提高患者的生存率,延长患者的生存期[3]。TACE术包括传统TACE、放射性微球TACE和载药微球TACE。载药微球作为一种新型血管栓塞类材料,可缓慢持续地释放抗肿瘤药物,在提高局部有效浓度的同时可降低外周血药浓度,延长药物作用时间,减少不良反应,与传统TACE相比,治疗效果更佳[4]。为了提升肝癌的治疗效果,TACE与其他介入微创手术的联合治疗逐渐得到关注。125I粒子为碘的同位素,放射性强,能够杀死快速分裂的肿瘤细胞。125I放射性粒子植入术已作为一种新的治疗方式应用于PLC的临床治疗中,且疗效较好[5]。新生血管的形成在肝癌的生长、转移和侵袭过程中起重要作用。胎盘生长因子(placental growth factor,PLGF)是促肿瘤血管生成因子,在维持血管结构和诱导血管生成中起重要作用[6]。异常凝血酶原也称维生素K缺乏或拮抗剂Ⅱ诱导蛋白(prothrombin induced by vitamin K absence-Ⅱ,PIVKA-Ⅱ),是一种新的HCC肿瘤特异性标志物,在评估PLC的临床疗效方面具有很高的价值[7]。本研究对载药微球TACE治疗PLC的疗效及其对患者血清PLGF、PIVKA-Ⅱ水平的影响进行探讨,现报道如下。
1 对象与方法
1.1 研究对象
选取2012年1月至2018年1月于乐山市市中区人民医院接受治疗的70例PLC患者。纳入标准:①符合《原发性肝癌诊疗规范(2011年版)》[8]中关于PLC的诊断标准,且均经病理学、活检组织细胞学检查确诊;②巴塞罗那临床肝癌(Barcelona clinic liver cancer,BCLC)分期为B或C期;③肝功能Child-Pugh分级为A或B级;④美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分为0~2分;⑤肝内至少有1个可测量病灶;⑥预计生存时间≥3个月。排除标准:①治疗前曾接受过手术、化疗、微波消融、射频消融等其他治疗;②存在门静脉主干癌栓或远处转移;③合并心、肺、肾等重要脏器严重功能不全或障碍;④合并其他恶性肿瘤。采用随机数字表法将70例PLC患者分为对照组和观察组,每组35例。对照组中,男20例,女15例;年龄36~71岁,平均(53.2±6.1)岁;肿瘤直径2.8~9.3 cm,平均(5.13±2.15)cm;Child-Pugh分级:A级21例,B级14例;有肿瘤子灶10例,无肿瘤子灶25例。观察组中,男19例,女16例;年龄33~69岁,平均(51.3±7.0)岁;肿瘤直径3.0~9.5 cm,平均(5.25±2.32)cm;Child-Pugh分级:A级20例,B级15例;有肿瘤子灶13例,无肿瘤子灶22例。两组患者的性别、年龄、肿瘤直径、Child-Pugh分级和肿瘤子灶情况比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审核批准,所有患者及家属均知情并签署知情同意书。
1.2 治疗方法
对照组给予常规TACE联合125I放射性粒子治疗。将30~50 mg吡柔比星与5~25 ml碘油制成化疗栓塞乳剂进行TACE治疗,具体剂量根据不同患者的肿瘤大小、肝功能情况和体表面积而定。4~6周后复查。计算机断层扫描(CT)和超声造影显示活动性病灶后,于B超引导下植入125I放射性粒子,根据三维治疗计划系统(treatment planning system,TPS)计算植入的粒子剂量和数量。125I放射性粒子半衰期为59.6 d,平均能量为25~35 keV,组织穿透能力为1.7 cm,125I放射性粒子的活性为0.6~0.9 mCi。
观察组给予载药微球TACE联合125I放射性粒子治疗。将30~50 mg吡柔比星溶于50 mg利多卡因中,加入0.5~2 ml微球中,微球直径为300~500 μm,加入比例为1∶(1~2)的造影剂,于注射器内充分混合,微球以悬浮状态为宜。抽取适量的微球混悬液,经导管均匀缓慢注射。行肝动脉造影后,连接导管与靶血管,当靶血管内的血流明显减缓时,暂停注射混悬液,造影后观察肿瘤染色情况,重复以上操作直至肿瘤染色消失,显示栓塞成功。125I放射性粒子治疗方法与对照组相同。
对照组与观察组经介入治疗后均常规给予保肝、预防性抗感染等治疗,若发生不良反应,则给予对症治疗。术后第1天应用单光子发射型计算机断层成像(single-photon emission computerized tomography,SPECT)-CT检查患者体内125I粒子条的辐射分布情况;从术后第3天开始,两组患者均给予华法林口服抗凝治疗,剂量进行个体化调整。
1.3 随访
两组患者术后每30~45天复查一次血常规、肝肾功能和凝血功能。采用美国国立癌症研究所的通用毒性标准[9]对不良事件进行分级,检查患者治疗后的肝内病灶和门静脉栓癌情况,观察粒子条覆盖范围内门静脉的通畅情况,根据对比剂的充盈情况判定门静脉主干的通畅情况。
1.4 观察指标及评价标准
①根据修改版实体瘤疗效评价标准(modified response evaluation criteria in solid tumor,mRECIST)[10]评价临床疗效,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。每4~6周评价疗效一次,观察患者的中位疾病进展时间(median time to progression,mTTP),记录客观缓解率(objective response rate,ORR)和疾病控制率(disease control rate,DCR),其中,ORR=(CR+PR)例数/总例数×100%,DCR=(CR+PR+SD)例数/总例数×100%。②两组患者均于治疗前1个月和治疗2个月后进行肝脏增强CT检查,分析肿瘤最大径的横断面图像,肿瘤坏死面积率=CT图像肿瘤碘化油面积/CT图像肿瘤体显示最大径面积×100%,肿瘤缩小率=(治疗前最大面积-治疗后最大面积)/治疗前最大面积×100%。③根据放射治疗肿瘤组的不良反应评价标准[11]对不良反应进行评价。④分别于治疗前和治疗2个月后抽取两组患者的空腹静脉外周血8 ml,直接抽取入血清分离管,4℃下以3000 r/min的速度离心5 min,取上清液,-80℃冰箱中冻存。采用酶联免疫吸附试验(enzyme-linked immunoadsordent assay,ELISA)检测血清PLGF、PIVKA-Ⅱ水平,试剂盒购自R&D Systems公司,操作步骤严格按照试剂盒说明书进行。
1.5 统计学分析
采用SPSS 13.0软件对数据进行统计分析。符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验。采用Kapla-Meier法绘制生存曲线,组间比较采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者近期疗效的比较
载药微球TACE术后1个月,肝脏增强CT显示观察组患者的肿瘤体积明显缩小(图1)。治疗2个月后,观察组患者的ORR、DCR分别为80.0%(28/35)和94.3%(33/35),均高于对照组的34.3%(12/35)和 71.4%(25/35),差异均有统计学意义(χ2=14.933、6.437,P<0.05)。(表1)
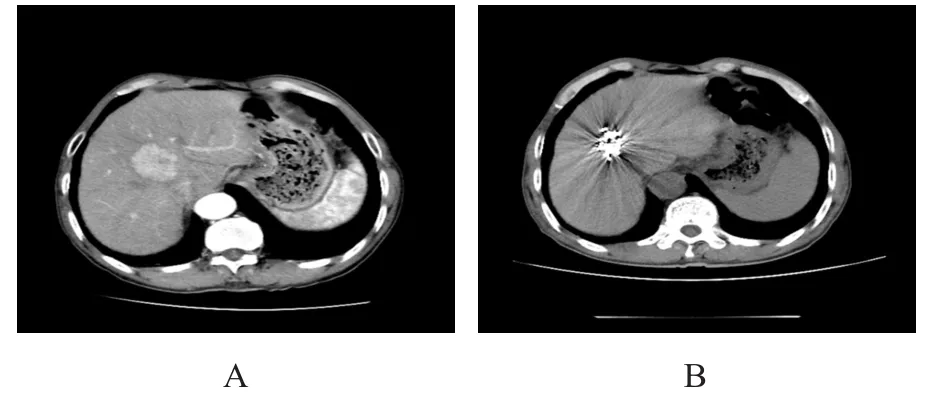
图135 例原发性肝癌患者行载药微球TACE后的CT影像图

表1 两组患者近期疗效的比较[ n(%)]*
2.2 两组患者肿瘤平均缩小率、肿瘤坏死面积率的比较
对照组患者的肿瘤平均缩小率为(42.56±2.61)%、肿瘤坏死面积率为(68.23±3.16)%,分别明显低于观察组患者的(50.13±3.01)%、(77.10±4.01)%,差异均有统计学意义(t=11.241、10.278,P<0.01)。
2.3 两组患者无进展生存时间的比较
对照组患者的中位无进展生存时间为10.5个月(95% CI:9.334~11.666),观察组患者的中位无进展生存时间为 11.9个月(95% CI:10.713~13.087),两组比较,差异有统计学意义(χ2=5.916,P<0.05)。(图 2)
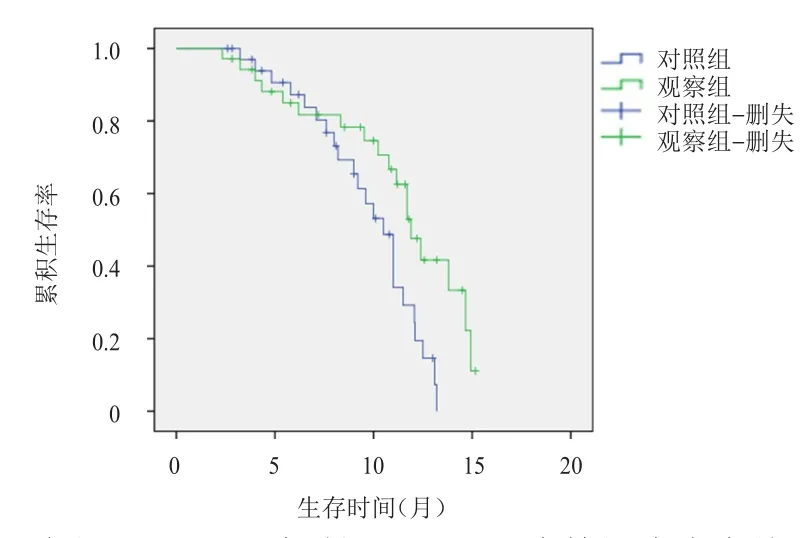
图2 观察组( n=35)和对照组( n=35)原发性肝癌患者的无进展生存曲线
2.4 两组患者不良反应发生情况的比较
对照组出现消化道反应者4例,乏力者10例,肝功能不全者5例,发热者5例;观察组出现消化道反应者1例,乏力者4例,肝功能不全者2例,发热者3例。患者经对症处理后均好转,且未发生肝破裂出血、肝功能衰竭等严重并发症。对照组患者的不良反应总发生率为68.57%(24/35),明显高于观察组患者的28.57%(10/35),差异有统计学意义(χ2=11.209,P<0.01)。
2.5 两组患者血清PLGF、PIVKA-Ⅱ水平的比较
治疗前,两组患者的血清 PLGF、PIVKA-Ⅱ水平比较,差异均无统计学意义(P>0.05);治疗2个月后,两组患者的血清PLGF、PIVKA-Ⅱ水平均低于本组治疗前,差异均有统计学意义(P<0.05)。治疗2个月后,观察组患者的血清PLGF、PIVKA-Ⅱ水平均低于对照组患者,差异均有统计学意义(t=2.480、2.254,P<0.05)。(表2)
表2 两组患者治疗前后血清PLGF、PIVKA-Ⅱ水平的比较(±s)
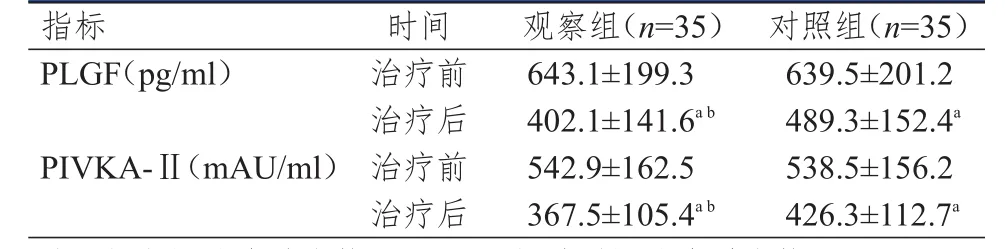
表2 两组患者治疗前后血清PLGF、PIVKA-Ⅱ水平的比较(±s)
注:a与本组治疗前比较,P<0.05;b与对照组治疗后比较,P<0.05
指标PLGF(pg/ml)PIVKA-Ⅱ(mAU/ml)治疗前治疗后治疗前治疗后643.1±199.3 402.1±141.6a b 542.9±162.5 367.5±105.4a b 639.5±201.2 489.3±152.4a 538.5±156.2 426.3±112.7a时间 观察组(n=35) 对照组(n=35)
3 讨论
作为中晚期PLC公认的治疗方法,TACE目前仍然存在诸多的缺点和难点,例如,TACE治疗后仅使部分肿瘤完全坏死,原因可能是经TACE治疗后,肿瘤组织缺氧、缺血,导致肿瘤周围的正常细胞和肿瘤细胞分泌多种促血管生成物质,如碱性成纤维细胞生长因子、血管内皮细胞生长因子等,形成肿瘤血管侧支循环,降低了TACE的疗效[12-13]。同时,由于TACE中的栓塞剂不可避免地进入正常肝组织并发生沉积,引起肝功能障碍进而发生肝脏组织坏死,且反复多次的TACE治疗加重了肝硬化,导致严重的肝功能代偿和肝萎缩[14]。因此,需提高肿瘤完全坏死率,完全阻断肿瘤的供应血液,减少TACE的治疗次数,减少并发症的发生,从而达到提升TACE治疗效果的目的。
吡柔比星作为新一代蒽环类抗肿瘤药物,具有细胞毒性强大、抗肿瘤谱广、代谢及排泄迅速、心脏和骨髓毒性低等特点[15]。ContourSETM微球是一种新型末梢栓塞材料,组织相容性好,颗粒规则且均匀,不易发生黏合,不仅易于通过普通导管和微导管,还能到达目的直径的末梢动脉血管,精确控制栓塞平面[16]。除此之外,该微球对较大的肿瘤肝动脉和肿瘤血管无栓塞作用,使主要血管保持通畅,不影响下一次的介入治疗。本研究采用300~500 μm直径的微球携带吡柔比星,应用此类型微球,一方面可有效阻断侧支循环的形成,提高疗效;另一方面可减少甚至隔绝颗粒进入门静脉或肝静脉,从而减少严重并发症的发生。
除了TACE治疗外,近年来,多采用125I放射性粒子植入治疗门静脉癌栓和实体肿瘤。125I放射性粒子植入的优点:可高剂量集中辐射于癌栓内,减少对周围正常肝组织的损害,且由于其辐射半衰期长,可使电离辐射持续作用于肿瘤细胞,抑制其增殖,诱导其凋亡;可改变肿瘤免疫表型,降低肿瘤细胞转移率。近年来,国内陆续开展了TACE联合腔内植入125I放射性粒子治疗肝癌的一系列研究,并获得了显著的疗效。王巧瑜等[17]研究发现,TACE联合门静脉内125I粒子植入技术治疗PLC合并门静脉癌栓的疗效优于单纯TACE;采用125I粒子植入技术联合TACE治疗的患者的短期远处转移率低于采用单独TACE治疗的患者,且前者的1、2、3年生存率均高于后者(P<0.05),表明TACE联合125I放射性粒子植入治疗可控制肿瘤的转移,提高生存率[18]。本研究将载药微球TACE应用于35例PLC患者的治疗中,结果显示,与应用传统TACE联合放射性粒子治疗的对照组患者相比,观察组患者的肿瘤缩小得更明显,ORR、DCR更高,中位无进展生存期更长,且患者治疗过程中并未出现严重并发症,提示此种治疗方式有效且安全。研究表明,由于肿瘤血管丰富且具有虹吸作用,栓塞剂可优先聚集于肿瘤血管表面,从而使肿瘤组织获得大量的栓塞剂,为肿瘤栓塞治疗的安全实施提供了保障。联合125I放射性粒子则有助于进一步抑制和杀灭TACE治疗后残留的肿瘤组织,即微球栓塞联合放射粒子植入具有协同作用,二者可相互补充,进而获得良好的疗效。
本研究进一步对两组患者治疗前后的血清PLGF、PIVKA-Ⅱ水平进行观察,结果显示,治疗后,两组患者的血清PLGF、PIVKA-Ⅱ水平均较本组治疗前降低,且观察组患者的血清PLGF、PIVKA-Ⅱ水平均低于对照组,提示载药微球TACE有助于促进PLC患者血清PLGF、PIVKA-Ⅱ水平的降低。PLGF为血管内皮细胞生长因子家族成员之一,而VEGF是强大的促血管内皮细胞生长因子,在生理性和病理性血管的生成中起重要作用。PLGF还可诱导肿瘤血管的分化与成熟,其表达水平与肝癌的生长、转移与复发等过程有着密切的联系,是肝癌患者预后评价的重要指标[6]。研究发现,血清中的PIVKA-Ⅱ水平可反映肝癌的病理特征及预后,可用于PLC的临床诊断。国内外研究均表明PIVKA-Ⅱ、AFP水平与肝癌的TNM分期和肿瘤大小均呈正相关[19-20],且在接受短期治疗的肝癌患者中,PIVKA-Ⅱ水平的下降幅度大于甲胎蛋白,表明PIVKA-Ⅱ对肝癌具有较高的诊断价值,本研究的结果也间接证实了此结论,但具体作用机制尚不明确,需进一步研究。
综上所述,载药微球TACE治疗PLC安全有效,可有效提高患者的ORR和DCR,延长患者的无进展生存时间,同时该种联合治疗方式有助于降低患者的血清PLGF、PIVKA-Ⅱ水平。

