酶解法制备条浒苔抗氧化肽工艺优化及其消化稳定性研究
王 熙,刘晓攀,刘 冰,赵 行,赵永慧,盘赛昆,2,3,*
(1.江苏海洋大学海洋生命与水产学院,江苏连云港 222005;2.江苏省海洋生物产业技术协同创新中心,江苏海洋大学,江苏连云港 222005;3.江苏省海洋资源开发研究院,江苏连云港 222005)
浒苔(Enteromorphaspp.)在分类学上属于绿藻门(Chlorophyta)、绿藻纲(Chlorophyceae)、石莼目(Ulvales)、石莼科(Ulvaceae),其广泛的分布在全世界各大海洋中,生长在潮间带岩石上,泥沙的石砾上[1]。浒苔虽无毒,但大量繁殖容易爆发绿潮灾害,影响海底藻类生长,分泌的化学物质可能还会对海洋生物造成不利影响,破化海洋生态系统,严重威胁沿海渔业和旅游业的发展[2]。
吉宏武等[3]研究表明,浒苔是一种具有很高利用价值的藻类,营养成分丰富,蛋白质27%、多糖53.7%、矿物质8.20%、脂肪0.90%,粗纤维10.20%;蛋白质中氨基酸种类齐全,必需氨基酸占氨基酸总量的38%[4];同时还含有丰富的维生素,属于高营养、低脂肪、低能量的理想营养、健康天然食材[5]。浒苔蛋白质水解可以产生含有数个到数十个氨基酸的肽类物质,肽类物质不仅具有营养价值,更有利于人体消化吸收,并可能具有一定的生物学功能,在功能性食品中有重要的应用价值[6]。近年来,因酶解法具有条件温和、安全性高、易控制、成本低、蛋白质肽链断裂位点具有特异性等优点,选择适当的蛋白酶水解动植物蛋白制备活性肽成为研究热点[7]。Wu等[8]利用蛋白酶水解鲭鱼蛋白,获得三种对清除DPPH自由基有明显效果的多肽。目前国内外研究人员对浒苔的研究多集中在多糖的提取、纯化及抗氧化活性等方面,对浒苔蛋白水解物的抗氧化活性研究较少。
本文以产于浙江沿海的条浒苔为原料,以水解度及DPPH清除率为评价指标,在单因素实验的基础上,采用响应面分析法优化中性蛋白酶制备条浒苔抗氧化肽工艺条件。采用膜分离技术将酶解物分离成不同相对分子质量的三个组分,通过体外模拟消化试验测定其消化稳定性,为开发浒苔保健品,提高天然浒苔的利用价值,变“害”为“宝”提供参考。
1 材料与方法
1.1 材料与仪器
条浒苔 产于浙江舟山,用洁净海水清洗干净,30 ℃干燥备用;纤维素酶(5.0×104U/g)、中性蛋白酶(4.3×104U/g) 河南圣斯德实业有限公司;1,1-二苯基-2-三硝基苯肼(DPPH) 分析纯,福州飞净生物科技有限公司;其它试剂 均为国产分析纯试剂。
ZNC-701超微粉碎机 北京华仪高科技电气设备有限公司;CMD2000/4湿法超微粉碎机 切可(上海)机械设备有限公司;Seven Easy S20 pH计 梅特勒-托利多仪器(上海)有限公司;SHA-2数显冷冻水浴恒温振荡器 江苏金坛市亿通电子有限公司;SP-754紫外分光光度计 上海光谱仪器有限公司;DMJ60-3三级膜分离过滤系统 山东博纳生物科技集团有限公司;AS-LGJ-10FG真空冷冻干燥机 郑州宏郎仪器设备有限公司。
1.2 实验方法
1.2.1 工艺流程 条浒苔→干法微粉碎→湿法超微粉碎→纤维素酶酶解→调pH→加中性蛋白酶酶解→灭酶→离心→取上清液→样品
操作要点:干浒苔用超微粉碎机粉碎,过80目筛,按固液比1∶20 g/mL,加蒸馏水,于湿法超微粉碎机中回流粉碎40 min,频率40 Hz,制得浒苔匀浆保存于4 ℃冰箱备用。纤维酶水解浒苔匀浆条件为pH3.0,加酶量5%(W/V),温度25 ℃,振荡酶解6.5 h,于98 ℃水浴锅灭酶10 min,冷却后以10000 r/min离心15 min,取上清备用。
1.2.2 单因素实验设计 以水解度和DPPH自由基清除率为指标,考察酶解时间、pH、酶解温度、加酶量、固液比5个因素对指标的影响[9]。
1.2.2.1 温度的影响 在pH7,酶解时间3.5 h、加酶量1000 U/g pro、固液比1∶20 g/mL的条件下,温度设为25、35、45、55、65 ℃。
1.2.2.2 pH的影响 在酶解时间3.5 h,加酶量1000 U/g pro,固液比1∶20 g/mL,酶解温度45 ℃的条件下,pH设为6.0、6.5、7.0、7.5、8.0、8.5。
1.2.2.3 酶解时间的影响 在酶解温度45 ℃,pH7,加酶量1000 U/g pro,固液比1∶20 g/mL的条件下,时间设为3.0、3.5、4.0、4.5、5.0 h。
1.2.2.4 加酶量的影响 在酶解温度45 ℃,pH7,酶解时间3.5 h,固液比1∶20 g/mL的条件下,加酶量为500、1000、2000、3000、4000、5000 U/g pro。
1.2.2.5 固液比的影响 在酶解温度45 ℃、pH7、酶解时间3.5 h,加酶量1000 U/g pro的条件下,固液比设为1∶20、1∶30、1∶40、1∶50、1∶60 g/mL,把不同固液比的水解物稀释到相同浓度再离心,取上清液。
1.2.3 响应面试验设计 选取单因素试验中对指标水解度和DPPH自由基清除率有显著影响的温度、加酶量、pH和反应时间四个因素作为考察对象,采用Design-Expert的中心组合试验设计方法[10],设计了四因素三水平的实验方案,因素与水平见表1。
10月14日,中国银行昭通市分行副行长岳浩代表中国银行向该行昭通市分行挂钩扶贫点——彝良县树林乡管坝村捐赠10万元,用于援建该村纸厂村民活动广场,助力该村基础设施建设。

表1 响应面试验因素与水平Table 1 Factors and levels of response surface
1.2.4 指标的测定
1.2.4.1 水解度 采用甲醛滴定法[11-12]测定。取条浒苔水解液5 mL于烧杯中,加入25 mL去离子水,磁力搅拌并用精密pH计指示pH,先用0.1 mol/L标准NaOH滴定至pH=8.2时,加入中性甲醛溶液10 mL混匀,再用0.1 mol/L标准NaOH继续滴定至pH=9.2,记录将其pH滴定至9.2时所消耗的NaOH溶液的体积。同时取水30 mL,做试剂空白。
水解度(DH)测定的计算公式如下式(1):
式(1)
式中:X-水解后生成的氨基态氮的含量,g;N-样品总氮含量,g。
其中总氮采用凯氏定氮法参照国标文献GB 5009.5-2016《食品中蛋白质的测定》测定,X按式(2)计算:
式(2)
式中:V1-测定用样品加入甲醛稀释后消耗氢氧化钠标准液的体积(mL);V2-试剂空白试验加入甲醛后消耗氢氧化钠标准的体积(mL);V3-样品稀释液取用量(mL);C-氢氧化钠标准液的浓度(mol/L);14-氮的摩尔质量(g/mol)。
1.2.4.2 DPPH自由基清除率测定 将2 mL样品及2 mL 0.1 mmol/L DPPH溶液加入同一试管中,振荡摇匀,室温条件避光反应30 min后在517 nm处测定吸光值As。同时测定2 mL 0.1 mmol/L DPPH溶液与等体积乙醇混合液的吸光度Ac,以及2 mL样品与等体积乙醇混合液的吸光度A0[13-14]。DPPH自由基清除率按式(3)计算[15]:
式(3)
式中:Ac为未加样品时DPPH溶液的吸光度;As为加样品时DPPH溶液的吸光度;Ao为未加DPPH样品的吸光度。
1.2.5 不同肽段的制备 酶解物用截留分子质量为3、10 kDa的三级膜分离过滤系统分为3个组分,冻干备用,分别命名为条浒苔肽Ⅰ(Mw≤3 kDa)、条浒苔肽Ⅱ(3 kDa
1.3 数据处理
2 结果与分析
2.1 单因素实验结果
2.1.1 温度对水解度和DPPH清除率的影响 图1显示,温度对条浒苔酶解物的水解度及DPPH清除率影响较大,在测定温度范围内,随着温度的上升,水解度和DPPH清除率呈先上升后下降的趋势,在45 ℃时二者均达到最高值:水解度为11.74%±0.36%,DPPH清除率为78.7%±0.81%。当温度高于45 ℃时,可能因为酶的活性受到了抑制,所以水解度和清除率急剧下降[18]。
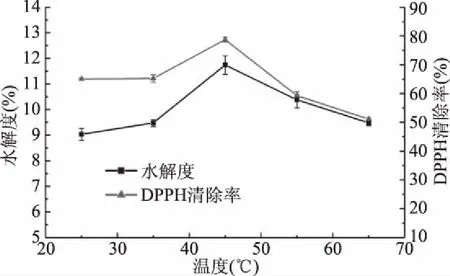
图1 温度对水解度和DPPH清除率的影响Fig.1 Effect of temperature on degree of hydrolysis and DPPH clearance
2.1.2 pH对水解度和DPPH清除率的影响 酶促反应中,酶活力受到pH影响较大。图2表明,pH在6.0~7.5的范围内,水解度和DPPH清除率随着pH的增加而增大,至7.5时二者分别达最大值,水解度为10.83%±0.33%,DPPH清除率为73.83%±1.42%。随着pH的进一步提高,水解度和DPPH清除率呈下降趋势。

图2 pH对水解度和DPPH清除率的影响Fig.2 Effect of pH on degree of hydrolysis and DPPH clearance
2.1.3 酶解时间对水解度和DPPH清除率的影响 由图3可见,酶解初期,水解度随着酶解时间的增加而增大,在酶解时间为3.5 h时趋于稳定,而DPPH清除率先升高后降低,在酶解时间为3.5 h时达到最大值71.70%±0.72%。两者的变化趋势不一样的可能原因是随着酶解时间的增加,一些小分子的多肽水解为氨基酸,从而丧失了抗氧化活性,这结果与冯艳霞[19]等研究结果相似。

图3 时间对水解度和DPPH清除率的影响Fig.3 Effect of time on degree of hydrolysis and DPPH clearance
2.1.4 加酶量对水解度和DPPH清除率的影响 图4显示,加酶量在500~3000 U/g pro范围内,水解度随着加酶量的增加呈上升趋势,3000 U/g pro时达到最大值12.64%±0.23%。水解过程中,随着添加量的增大,大分子蛋白在较短时间内被降解,水解度迅速提高,当添加过大时底物已被酶所饱和,导致酶与酶之间产生竞争,反而导致水解能力下降,水解度明显降低[20]。随着加酶量的增加,DPPH自由基清除率呈先上升后下降的趋势,当加酶量为3000 U/g pro时,DPPH自由基清除率达到最大值81.32%±1.56%,因此,中性蛋白酶水解条浒苔蛋白的适宜加酶量为3000 U/g pro。

图4 加酶量对水解度和DPPH清除率的影响Fig.4 Effect of enzyme amount on degree of hydrolysis and DPPH clearance
2.1.5 固液比对水解度和DPPH清除率的影响 图5显示,随着固液比的不断增大,即条浒苔蛋白浓度的降低,水解度呈降低趋势。说明在水解过程中,条浒苔蛋白浓度的降低,降低了水解的反应速度,从而导致了水解度的降低。DPPH自由基清率随着料液比的上升而下降,但幅度不大几乎处于稳定状态,表明固液比在中性蛋白酶水解中对酶解物的DPPH自由基清率影响较小[21]。在固液比为1∶20 g/mL时酶解液的水解度和DPPH自由基清除率达到最大值,水解度为9.03%±0.036%,DPPH清除率为44.42%±0.247%,故酶解条浒苔蛋白最适固液比为1∶20 g/mL。
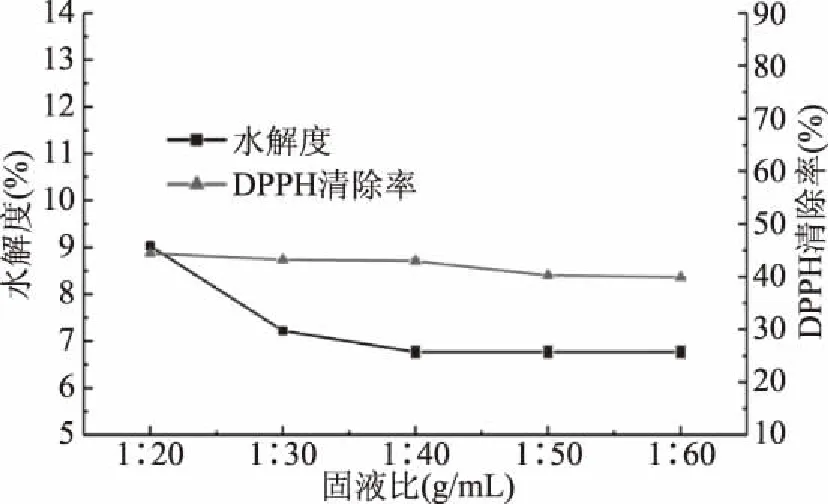
图5 固液比对水解度和DPPH清除率的影响Fig.5 Effect of solid-liquid ratio on degree of hydrolysis and DPPH clearance
2.2 响应面分析结果
2.2.1 响应面试验设计方案及结果 通过对单因素实验结果的方差分析,筛选出对指标有显著影响的因素,并确定其条件范围,采用Design-Expert 8.0的Box-Behnken中心组合法设计响应面实验方案,共有27个试验点,其中2、7、17、19、21号为零点,是区域的中心点,用来估计试验误差。DPPH清除率为响应值,响应面试验设计方案及结果见表2。

表2 响应面试验设计和结果Table 2 Design and results of response surface experiments
2.2.2 回归方程拟合和方差分析 利用Design-Expert 8.0软件对所得实验数据进行二次多项式回归拟合,得到DPPH自由基清除率与各因素变量的二次回归方程模型为:


表3 DPPH清除率试验方差分析表Table 3 Table of variance analysis of DPPH clearance test
2.2.3 响应面分析 图6~图8是根据回归方程绘制出的各因素交互作用的响应面,反映了各因素在制备的过程中对响应值的影响,其投影为等高线图。该组图直观反映了时间、温度、pH、加酶量分别对酶解液水解度和DPPH清除率的影响,而等高线的形状则表示了两因素之间的影响强弱,圆表示两因素交互作用弱,椭圆则较强[23]。
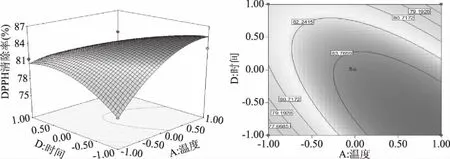
图6 反应温度和反应时间对DPPH清除率的交互作用及等高线Fig.6 Interaction effect and contour between temperature and time on DPPH clearance

图7 pH和加酶量对DPPH清除率的交互作用及等高线Fig.7 Interaction effect and contour between pH and enzyme amount on DPPH clearance
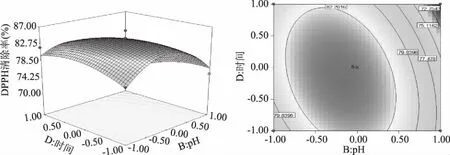
图8 pH和反应时间对DPPH清除率的交互作用及等高线Fig.8 Interaction effect and contour between pH and time on DPPH clearance
由图6可得时间与温度的曲面都较陡,对DPPH清除率影响显著,再根据等高线图可得等高线呈椭圆,说明加酶量和温度两者交互作用较强,影响极显著。
由图7可知,加酶量与pH的曲面都比较陡,对DPPH清除率影响都比较大,作用极显著,再根据等高线图可得等高线呈椭圆,说明加酶量和pH两者交互作用较强,影响显著。
由图8可得,pH对DPPH清除率的影响极显著,曲面较陡,而时间对DPPH清除率影响不大,曲面较缓和。再根据等高线图可得等高线呈椭圆,说明pH和时间两者交互作用较强,影响显著。
2.2.4 工艺条件的优化和验证 运用软件得到酶法制备浒苔抗氧化肽的最佳工艺为:酶解温度为47.55 ℃、pH为7.405、加酶量为3250 U/g pro、酶解时间为3.295 h,在此条件下DPPH清除率为85.53%。实际操作中稍作调整:反应温度为47 ℃、pH为7.4、加酶量为3300 U/g pro、反应时间为3.3 h、固液比为1∶20 g/mL,做三次平行试验,DPPH清除率分别为82.32%、86.66%、84.03%,使用SPSS 16.0进行T检验,由表4可知P>0.05,表明实际值与预测值无显著差异,模型可靠。

表4 浒苔抗氧化肽DPPH清除率检验Table 4 DPPH clearance of enteromorpha antioxidant peptide
2.3 体外消化稳定性
图9表明,Mw≤3 kDa和3 kDa

图9 不同肽段在消化酶作用前后DPPH自由基清除率的比较Fig.9 Comparison of DPPH free radical scavenging rates of different peptides before and after the action of digestive enzymes注:标记相同字母表示无显著性差异(P>0.05), 标记不同字母表示差异显著(P<0.05)。
3 结论
采用酶水解技术水解条浒苔蛋白制备抗氧化肽,通过单因素试验及建立响应面模型优化得到条浒苔抗氧化肽的最佳酶解条件为:酶解温度47 ℃、pH7.4、加酶量3300 U/g pro、反应时间3.3 h、固液比1∶20 mg/mL,在此条件下,抗氧化肽的DPPH清除率为84.33%,具有较高的抗氧化活性。同时将酶解液分离成Mw≤3 kDa、3 kDa

