毛兰素与其潜在靶点蛋白丙酮酸羧化酶的相互作用研究
谢泽宇, 陈水玲, 杨志华, 阮子静, 黄新河
(西南交通大学 生命科学与工程学院, 成都 610031)
毛兰素(Erianin), 2-Methoxy-5-[2-(3,4,5-trimethoxy-phenyl)-ethyl]-phenol,是一种提取自名贵中药材铁皮石斛和鼓槌石斛的天然小分子化合物, 分子量为318.36[1]。除石斛外,在毛兰属植物Eriacarinata中也能分离纯化得到毛兰素[2]。中医临床上常将毛兰素作为解热剂和镇痛剂使用。近期研究表明毛兰素可诱导包括肝癌[3]、胃癌[4]、膀胱癌[5]、结肠癌[6]、白血病[7]、黑色素瘤[3]、骨肉瘤[8]、宫颈癌[9]及鼻咽癌[10]等多种肿瘤细胞的凋亡或自噬和抗血管生成作用[11]。
丙酮酸羧化酶(Pyruvate carboxylase, PC)是生物素依赖性酶家族成员[12]。哺乳动物丙酮酸羧化酶是由4个相同亚基组成的四聚体,每个亚基有1178个氨基酸[13]。丙酮酸羧化酶可通过两步反应催化丙酮酸转化为草酰乙酸[12]。PC催化的丙酮酸羧化将确保TCA循环中间体介导的生物合成在癌症增殖期间不受限制[14]。
敲低PC的表达显著降低细胞天冬氨酸水平,进而影响核苷酸的生物合成并限制肾癌细胞生长[15]。对其抑制能阻断非小细胞肺癌NSCLC细胞在小鼠肺组织中诱导肿瘤形成的能力[16]。
毛兰素处理与PC基因的沉默在抑制癌细胞增殖、改善糖尿病症状和对抗微生物感染方面有十分相似的作用[3-11, 15-22]。因此,我们推测毛兰素可能通过PC对癌细胞增殖,糖尿病和微生物感染等产生影响。
本研究采用计算机分子对接模拟预测了毛兰素与hPC的结合位点及结合强弱,并利用体外线粒体蛋白孵育实验,评价毛兰素对PC酶活性的影响。综合两部分实验内容探索毛兰素是否为丙酮酸羧化酶(PC)底物,以期为深入研究毛兰素的作用机理奠定基础。
1 材料与方法
1.1 材料
1.1.1 序列信息与软件
hPC蛋白的序列信息来自于NCBI数据库;Discovery Studio 2016 v16.1药物发现与生物大分子计算模拟软件购自BIOVIA;Blast数据库为PDB_nr95。
1.1.2 细胞株与试剂
人肝癌HepG2细胞购自美国ATCC(American Type Culture Collection),由西南交通大学衰老与代谢实验室引进与保藏;DMEM高糖培养基,小牛血清,胰蛋白酶,Antibiotic-antimycotic试剂均购自Gibco公司,其中小牛血清经56 ℃水浴灭活30 min,-20 ℃保存;二甲基亚砜,毛兰素购买自百灵威科技有限公司;丙酮酸羧化酶检测试剂购自Solarbio。
1.2 方法
1.2.1 同源建模
通过NCBI数据库查询需要建模的hPC(human pyruvate carboxylase)蛋白的氨基酸序列,在Discovery Studio 2016 v16.1软件中新建hPC的蛋白质序列文件。使用protocol里sequence analysis中的BLAST Search模块,在PDB_nr95数据库中查找hPC的同源蛋白。选择同源性较高的一个或多个蛋白作为模板,将模板序列添加到hPC序列窗口中,使用Align Multiple Sequence protocol进行序列比对。Load模板结构,使用Homology Building protocol进行同源建模。
1.2.2 分子对接
利用Discovery Studio 2016 v16.1 的Clean Protein工具去除蛋白冗余构象,补充非完整的氨基酸残基,为蛋白加氢。利用From Receptor Cavities 模块定义受体hPC蛋白的活性位点。利用Sketching 工具,构建毛兰素小分子的初始结构,Clean Geometry进一步构建毛兰素的几何三维结构。利用Dock Ligands(LibDock)工具执行分子对接计算,Ligand Interactions观察对接pose的非键相互作用。Define Ligand并Show 2D Diagram打开毛兰素-PC蛋白相互作用的二维平面图,更直观的观察二者的相互作用及关键的氨基酸和化学基团。
1.2.3 hPC活性检测
收集5×106个HepG2细胞,使用移液器加入1 mL 提取液,用冰浴研钵匀浆。将细胞匀浆600 r/min,4 ℃离心5 min。弃沉淀,将上清液移至另一离心管中,11 000 r/min,4 ℃离心10 min。使用移液器在沉淀中加入1 mL 提取液,超声波破碎(冰浴,功率200 W,超声3 s,间隔10 s,重复30次)[23]。线粒体提取液与不同浓度的毛兰素37 ℃孵育1 h后,用于PC活性测定。
将丙酮酸、ATP、NaHCO3、苹果酸脱氢酶、NADH和乙酰CoA混合溶解待用;置于37 ℃预热5 min。在1 mL 石英比色皿中使用移液器加入50 μL 样品,950 μL工作液,立即混匀,记录340 nm 处初始吸光值A1 和2 min 后的吸光值A2,计算ΔA=A1-A2。每mg 组织蛋白每分钟消耗1 nmol NADH 定义为一个酶活力单位。按公式PC(U/mg prot)=[ΔA×V反总÷(ε×d)×109]÷(V样×Cpr) ÷T=1608×ΔA÷Cpr(ΔA:吸光值改变,V反总:反应体系总体积,ε:摩尔吸光系数,d:液层厚度,V样:样品体积,Cpr:样品蛋白浓度)计算hPC酶活[24]。
2 结果与分析
2.1 hPC的同源建模
hPC是由1178 个氨基酸残基组成的线粒体代谢酶,由于目前尚未确定hPC的N-末端结构[25],所以我们使用Discovery Studio 2016 v16.1将hPC序列在PDB_nr95数据库中进行了BLAST Search(图1),找到了3个E-value值(越小同源性越高)为0的蛋白质序列(表1),选择其中整体同源性最高的sPC(StaphylococcusAureusPyruvate Carboxylase)为模板,使用homology modeling模块进行同源建模,用Molprobity分析并优化后得到hPC蛋白结构(图2)。
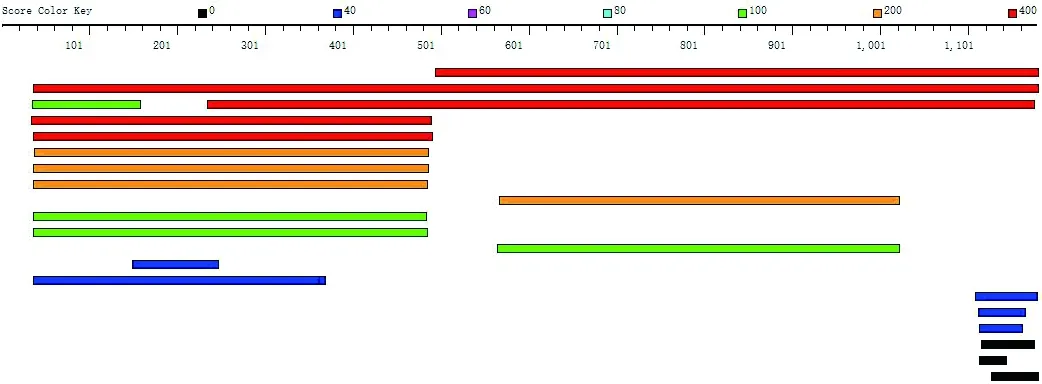
图1 hPC序列的BLAST Search
2.2 hPC的预处理与活性位点定义
将同源建模得到的hPC蛋白结构文件用Discovery Studio 2016 v16.1打开,并去除水分子后,用Macromolecules模块中的工具去除蛋白冗余构象,补充非完整氨基酸残基,并为hPC蛋白加氢。然后使用From Receptor Cavities定义了共116个蛋白活性位点,以寻找毛兰素可能的结合部位。
2.3 hPC蛋白与毛兰素的分子对接
利用LibDock将毛兰素分别与各个活性位点对接,有48个蛋白活性位点能与毛兰素产生较稳定的pose,其中能产生Libdockscore大于75 pose的site有28个,大于100的有6个(图3)。表明毛兰素可能在多个活性位点处与hPC蛋白结合。
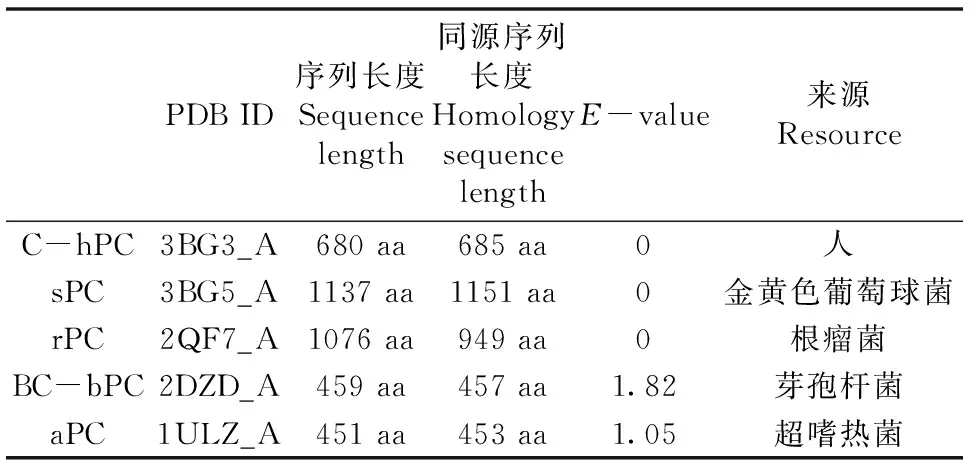
表1 hPC序列的BLAST Search
Libdock score最高的两个site中的毛兰素小分子分别位于四聚体蛋白的BC链和AD链的界面处(图 3),化学环境几乎一样。hPC蛋白通过天冬氨酸残基的常规氢键与π-阴离子互作,甲硫氨酸残基的π-二硫键和π-烷基互作以及天冬氨酸、谷氨酸、丝氨酸和赖氨酸残基的碳氢氢键与毛兰素形成了相对稳定的复合结构(图4)。

图2 hPC蛋白结构的同源模型
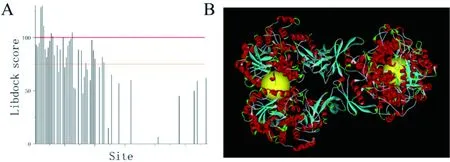
图3 hPC与毛兰素对接Libdockscore分布(A),毛兰素在site 4/5处的pose(B)

图4 hPC与毛兰素的非键作用模型(A:3D; B:2D)
进一步的CDOCKER分析表明,毛兰素在site 4/5处的-CDOCKER INTERACTION ENERGY均大于167.44 kJ/mol,说明毛兰素与hPC蛋白的结合能力较强。这提示我们毛兰素可能与hPC蛋白结合,从而抑制hPC的活性。
2.4 毛兰素体外抑制实验
PC催化丙酮酸、ATP、CO2和水生成草酰乙酸、ADP 和Pi,苹果酸脱氢酶进一步催化草酰乙酸和NADH 生成苹果酸和NAD+,在340 nm下测定NADH 氧化速率,即可反映PC 活性[24]。
将肝癌HepG2细胞的线粒体蛋白提取液分别与不同浓度的毛兰素孵育后,加入反应底物以及激活剂乙酰-CoA,测定340 nm处吸光度的变化。每mg 线粒体蛋白每分钟消耗1 nmol NADH 定义为一个酶活力单位,由公式PC(U/mg prot)=[ΔA×V反总÷(ε×d)×109]÷(V样×Cpr) ÷T计算得到PC活性。结果(图5)显示,毛兰素可在体外显著抑制线粒体提取物中的PC活性,表明毛兰素可能与hPC蛋白非共价结合并影响其活性。
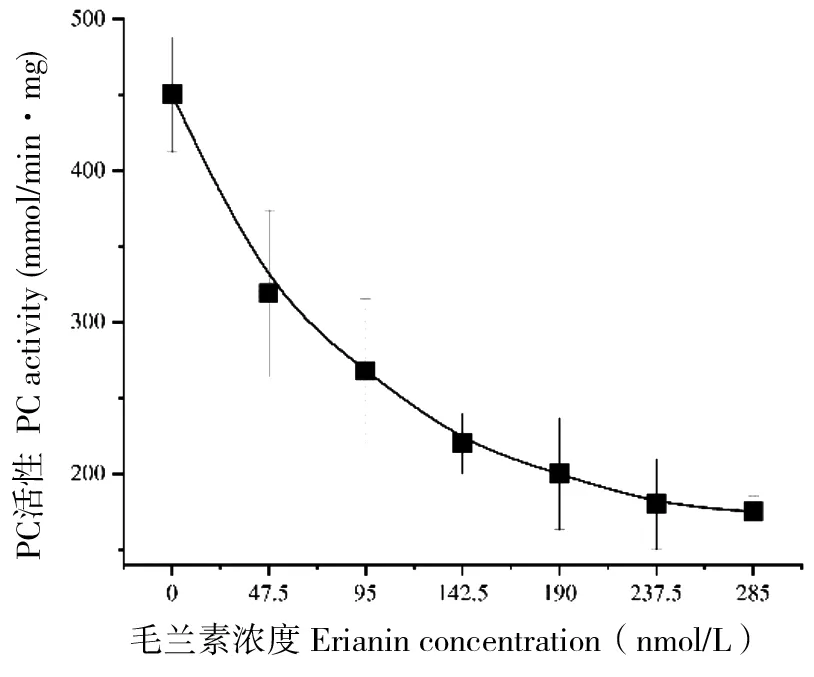
图5 毛兰素对线粒体PC活性的抑制作用
3 讨论与结论
本研究以金黄色葡萄球菌的PC蛋白为模板,对人PC蛋白进行同源建模,模拟hPC蛋白结构,然后将石斛抗癌活性小分子毛兰素与hPC对接。结果显示,毛兰素可在多个活性位点处与hPC蛋白结合,最佳结合位点位于四聚体蛋白的AD链界面与BC链界面上,Libdock score分别为128.51与129.79。在两个化学环境几乎相同的位点上,hPC通过常规氢键、碳氢氢键、π-阴离子互作、π-二硫键互作和π-烷基互作同毛兰素结合,形成相对稳定的结构。CDOKER精准对接结果也表明毛兰素与hPC有较强的结合能力。
丙酮酸羧化酶的催化过程为BC结构域催化生物素转化为羧基生物素,BCCP捕获羧基生物素并使其耦连于四聚体结构中心的空腔中,形成具有活性的PC/羧基生物素催化聚合物,CT结构域则催化羧基生物素上的羧基转移至丙酮酸生成草酰乙酸[26]。
BC与CT都是两个单位的结构域二聚化才具有催化活性,而根据分子对接结果,毛兰素能结合在AD链与BC链形成的CT二聚体结构域之间,可能改变了CT二聚体结构的稳定性,影响其羧基转移酶活性,使其无法完成最重要的一步催化过程,无法将羧基生物素上的羧基转移至丙酮酸生成草酰乙酸,使催化反应停留在生物素羧化这一步。毛兰素的体外抑制实验结果也证实了这一推测,毛兰素可在体外显著抑制HepG2细胞线粒体提取液中的PC蛋白的活性,酶活性半抑制浓度IC50为128.16 nmol/L,与计算机分子对接模拟结果相一致。
毛兰素与PC蛋白的相互作用在一定程度上解释了敲低PC表达与毛兰素处理在癌细胞增殖[3-11, 16, 19-20]和糖尿病[12, 21]中的相似作用。同时,Blast Search结果中,金黄色葡萄球菌来源的PC蛋白与人PC蛋白同源性最高也一定程度上印证了毛兰素对金黄色葡萄球菌感染的抵抗[18, 22]。
毛兰素作为传统中药石斛中提取的小分子抗癌药物,阐明其药理毒理对其作为临床药物的研发与应用有着重要意义。本研究证明了毛兰素与hPC蛋白的相互作用,提示毛兰素可能通过抑制线粒体回补,进而抑制细胞生物合成代谢,影响癌细胞增殖。本研究为进一步深入研究毛兰素药理毒理提供了一定参考和方向。

