粗梗稠李中花色苷的提取及其理化性质和稳定性研究
李晓娇,何健民,韩德仙,何春燕,侯洪波
(保山学院 资源环境学院,云南 保山,678000)
粗梗稠李(Padusnapaulensis)又称胭脂果、山李子和鬼眼睛果,为蔷薇科稠李属植物[1-2]。我国集中分布在云南、陕西、贵州等地,缅甸、尼泊尔等国家也有分布[3]。其果实成熟后呈鲜艳的紫红色,有特殊的香味,在滇西地区的龙陵、德宏、凤庆等地常作为水果、果酱和泡果酒食用。粗梗稠李成熟果肉和果汁呈紫红色,色素丰富,粗梗稠李富含多酚类物质[4],且有一定的抗氧化活性。研究人员研究了粗梗稠李色素的提取和稳定性[5-6],但对粗梗稠李中花色苷类色素的研究还鲜有报道。本课题组采用乙醇浸提法提取粗梗稠李中的色素,并以花色苷含量为指标,优化花色苷的提取工艺,同时考察提取液花色苷的稳定性,以期为滇西地区特色植物粗梗稠李中花色苷类色素的提取、保存以及开发利用提供理论依据和技术支持。
1 材料与方法
1.1 材料与试剂
粗梗稠李,于2018年10月采自云南省德宏州,经保山学院汪建云教授鉴定为蔷薇科稠李属的植物粗梗稠李(Padusnapaulensis)。
无水乙醇、KCl、冰乙酸、石油醚、氨水、无水Na2CO3、Na2SO3、ZnSO4、无水CaCl2、蔗糖,天津市风船化学试剂科技有限公司;浓盐酸、丙酮,重庆川东化工集团有限公司;无水乙酸钠、三氯甲烷、L-(+)-抗坏血酸、苯甲酸钠、NaCl,西陇科学股份有限公司;甲苯、醋酸乙酯、MgCl2、AlCl3、CuSO4、FeCl3,中国医药(集团)上海化学试剂公司。
1.2 仪器与设备
HH-4数显恒温水浴锅,常州国华电器有限公司;UV-2600紫外-可见分光光度计,日本岛津;N-1001旋转蒸发仪,东京理化;V-5100可见分光光度计,上海元析仪器有限公司;FD-1型冷冻干燥机,北京德天佑科技发展有限公司;TDL-4低速台式离心机,上海安亭科学仪器厂;PE30酸度计,梅特勒-托利多集团。
1.3 方法
1.3.1 粗梗稠李预处理
预处理操作如下:
粗梗稠李鲜果洗净→晾干水分→去核→冷冻干燥→粉碎→过80目筛→干燥保存。
1.3.2 花色苷的提取
称取1.00 g粗梗稠李粉末,置于25 mL锥形瓶中,加入一定体积的提取剂(乙醇+HCl),恒温水浴条件下提取花色苷,提取液离心过滤(2 000 r/min,5 min),离心液于4~5 ℃保存,备用。
1.3.3 提取液紫外-可见光谱特征
在波长为200~700 nm,使用紫外-可见分光光度计对粗梗稠李花色苷提取液进行光谱测定,得其紫外-可见特征光谱图。
1.3.4 理化性质测定
参照肖军霞等[7]的方法,通过溶解性和颜色反应等理化性质实验判断粗梗稠李花色苷的理化性质特征。
1.3.4.1 溶解性
分别取水、冰乙酸、体积分数80%乙醇、三氯甲烷、醋酸乙酯、石油醚、丙酮、甲苯各10 mL于8支比色管中,再分别加入粗梗稠李花色苷浓缩液0.5 mL,观察其溶解情况。
1.3.4.2 颜色反应
(1)在滤纸上滴加3~4滴粗梗稠李提取液,然后置于浓氨水上方熏一段时间,观察颜色变化。
(2)在滤纸上滴加3~4滴粗梗稠李提取液,然后滴加饱和Na2CO3溶液4~5滴,将其放置在空气中,观察颜色变化情况。
(3)准确量取1 mL粗梗稠李提取液于比色管中稀释至5 mL,滴加2~3滴质量分数为1% Na2SO3溶液,混匀,记录溶液颜色变化的情况。随后加入1 mol/L的HCl溶液2~3滴,混匀,记录溶液变化情况。
(4)准确量取1 mL粗梗稠李提取液于比色管中稀释至5 mL,滴加3~4滴质量分数为3% FeCl3溶液,摇晃溶液,观察溶液颜色变化情况。
(5)取粗梗稠李提取液14份,每份1 mL,用0.5 mol/L NaOH和0.5 mol/L HCl将14份粗梗稠李提取液配制为pH 1.0~14.0的溶液,观察溶液颜色变化情况。
1.3.5 花色苷含量测定
花色苷含量的测定采用pH 示差法[8],在2支比色管中分别加入0.5 mL花色苷提取液,用pH 1.0的KCl缓冲溶液和pH 4.5的乙酸钠缓冲溶液将其稀释至10 mL,室温下平衡30 min,分别在521 nm和700 nm处测定吸光度[9]。按公式(1)计算吸光度值:
A=(A521-A700)pH 1.0-(A521-A700)pH 4.5
(1)
花色苷提取量按公式(2)计算:
(2)
式中:MW=449.2(MW为样品中主要花色苷的相对分子质量);DF,稀释倍数;V,提取液体积,mL;ε,样品中花色苷的摩尔吸收系数,ε=26,900;m,粗梗稠李样品质量,g;l,比色皿的厚度,cm。
1.3.6 单因素试验
以粗梗稠李花色苷的提取量为指标,分别考察乙醇体积分数、料液比、pH值、提取时间和温度5个因素对提取量的影响。设定乙醇体积分数为60%,料液比为1∶20(g∶mL),提取液pH为2,提取温度40 ℃,提取时间60 min,固定其他条件,分别考察乙醇体积分数(20%、40%、60%、80%、100%),提取液pH值(0.5、1、2、3、4),料液比[1∶20、1∶30、1∶40、1∶50、1∶60(g∶mL)],提取温度(30、40、50、60、70 ℃),提取时间(30、60、90、120、150 min),对提取量的影响。
1.3.7 正交试验
依据单因素实验结果,选择对花色苷提取量影响较大的提取温度(A)、提取时间(B)、提取液pH值(C)、料液比(D)4个因素进行L9(34)正交实验,对粗梗稠李花色苷的提取工艺进行优化(表1)。

表1 正交因素水平Table 1 Factors and levels in orthogonal experiment
1.3.8 粗梗稠李花色苷稳定性试验
1.3.8.1 温度对粗梗稠李花色苷稳定性的影响
参考刘敬华等[10]的方法略作修改,取0.1 mL粗梗稠李花色苷浓缩液(最优条件下提取的粗梗稠李花色苷提取液,于50 ℃下减压蒸馏至无溶剂馏出),加蒸馏水稀释至25 mL,在不同的水浴温度(20、40、60、80 ℃)中加热,每隔30 min取样,用冰水快速冷却后,用蒸馏水定容至25 mL,测定λ531 nm处的吸光度,按公式(3)计算其保存率:

(3)
式中:At,在t时的吸光度;A0,在0时的吸光度。
1.3.8.2 光照对粗梗稠李花色苷稳定性的影响
参照张弘等[11]的方法并稍作改动,分别取0.1 mL粗梗稠李花色苷浓缩液,加蒸馏水稀释至25 mL,置于3个比色管中,并分别于室内避光处、室外自然光(室外晴天,每日光照时间至少6 h)、室内自然光处保存,每隔5 d测定λ531 nm处的吸光度,计算其保存率。
1.3.8.3 金属离子对粗梗稠李花色苷稳定性的影响
参照焦岩等[12]的方法稍作修改,分别取0.1 mL粗梗稠李花色苷浓缩液于比色管中,分别加入不同浓度的金属离子溶液Mg2+、Al3+、Zn2+、Cu2+、Fe3+、Ca2+溶液至25 mL,保存于室内避光处,每隔5 d测定λ531 nm处的吸光度,计算其保存率(对照组均为未添加金属离子的实验组)。
1.3.8.4 食品添加剂对粗梗稠李花色苷稳定性影响
参照李颖畅等[13]的方法稍加修改,分别取0.1 mL粗梗稠李花色苷浓缩液于比色管中,分别加入不同浓度的食品添加剂(蔗糖、苯甲酸钠、抗坏血酸)溶液至25 mL,保存于室内避光处,每隔5 d测定λ531 nm处的吸光度,计算其保存率(对照组均未添加食品添加剂)。
2 结果与分析
2.1 粗梗稠李花色苷紫外-可见光谱特征
由图1可知,提取液在紫外光区280~285 nm处有较强的吸收峰,这主要是花色苷酰基结构的特征峰[14]。同时在531 nm处也有花色苷的特征吸收峰[15],以往文献报道,500~550 nm是花色苷的最大吸收区[16],而在275~350 nm也会出现一个最大吸收区[17-18]。而本研究提取得到的粗梗稠李色素的最大吸收波长分别在285~288和529~532 nm,符合花色苷的最大吸收波长范围,由此可判断提取的粗梗稠李色素属于花色苷类色素。另外,由于531 nm为粗梗稠李花色苷在可见光范围内的最大吸收波长,故本实验均取531 nm处的测定结果。

图1 粗梗稠李花色苷的紫外可见扫描图谱Fig.1 Absorption spectrum of anthocyanin from fruit ofPadus napaulensis
2.2 粗梗稠李花色苷的理化性质
2.2.1 粗梗稠李花色苷的溶解性
由表2可见,粗梗稠李花色苷易溶于水、冰乙酸、乙醇等极性溶剂,不溶于氯仿、醋酸乙酯、石油醚、丙酮、甲苯等非极性溶剂。所以该色素属于水溶性色素,符合花色苷色素的性质特征。

表2 粗梗稠李花色苷在不同溶剂中的溶解情况Table 2 The dissolution of anthocyanin from fruit ofP. napaulensis in different solvents
2.2.2 粗梗稠李花色苷的颜色反应


表3 粗梗稠李花色苷的颜色反应Table 3 The color reaction of anthocyanin from fruitof P. napaulensis
如表4所示,随pH的变化粗梗稠李色素的颜色也随之变化。在pH 2以下的强酸溶液中,色素溶液为深红色;当pH为3~8之间时,红色逐渐变浅;在pH为9时,开始有绿色出现;pH 10~14时,绿色逐渐加深,并有蓝色出现。这与花色苷在酸碱环境中的呈色反应规律相似[20-21],故粗梗稠李花色苷可根据需要调节为不同的颜色,特别适用于酸性食品。

表4 粗梗稠李花色苷在不同pH值下的颜色Table 4 Color of anthocyanin from fruit of P. napaulensis at different pH
2.3 单因素试验结果
2.3.1 乙醇体积分数对粗梗稠李花色苷提取量影响
随着乙醇体积分数的增大,粗梗稠李花色苷的提取量也随之增大,当乙醇体积分数为60%时,花色苷提取量达到最大值,为0.519 mg/g(图2)。
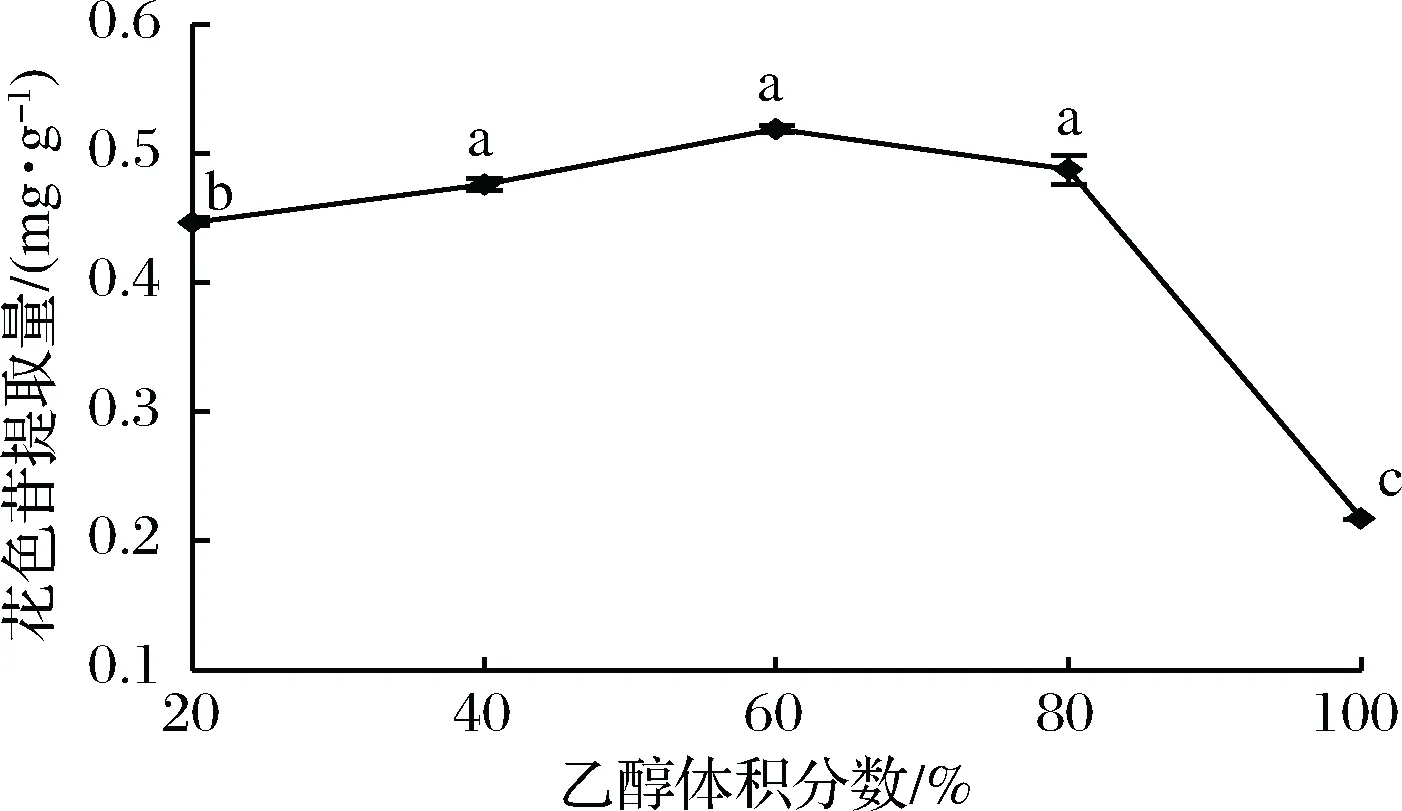
图2 乙醇体积分数对花色苷提取率的影响Fig.2 Effect of ethanol volume fraction on extractionrate of anthocyanin注:不同小写字母表示差异显著(P<0.05)(下同)
继续增加乙醇体积分数(80%~100%),花色苷的提取量开始降低,且乙醇体积分数大于80%时,花色苷提取量急剧下降。这可能是因为溶剂的渗透能力会随乙醇体积分数的增加而增大,利于花色苷的溶出。而乙醇体积分数过高时,提取液极性会减小,从而降低花色苷的溶出率[22]。因此,选择乙醇体积分数为40%~80%为最佳,但由于在该范围内乙醇体积分数对花色苷提取量无显著差异(P>0.05),因而乙醇体积分数不作为正交实验设计的考察因素,实验使用60%的乙醇溶液提取花色苷。
2.3.2 温度对粗梗稠李花色苷提取量的影响
如图3所示,花色苷的提取量随着提取温度的升高而增大,40 ℃时,花色苷提取量达到最大值0.558 mg/g,进一步升高温度花色苷的提取量降低。这是由于升高温度有助于花色苷的溶出,但花色苷的热稳定性较差,过高的温度会破坏花色苷C环结构,使其氧化、降解[23-24]。因此,选择30、40、50 ℃三个水平进行正交试验。

图3 温度对花色苷提取率的影响Fig.3 Effect of extraction temperature on extractionrate of anthocyanin
2.3.3 提取时间对粗梗稠李花色苷提取量的影响
随着提取时间的增加,粗梗稠李花色苷提取量呈现先增后降的趋势,当提取时间为60 min时,提取量达到最大值,为0.520 mg/g(图4)。这可能是随着提取时间的增加,花色苷逐渐溶出,提取量增加,但继续延长提取时间,花色苷在热溶液中稳定性较差,发生氧化分解,从而提取量降低[25-26]。故提取时间水平选取30、60、90 min。

图4 提取时间对花色苷提取率的影响Fig.4 Effect of extraction time on extraction rate ofanthocyanin
2.3.4 pH对粗梗稠李花色苷提取量的影响
从图5可以看出,提取液pH为1时,粗梗稠李花色苷提取量达到最大值,为0.549 mg/g。当pH>1时,花色苷提取量下降,这可能是由于pH的升高导致花色苷稳定性降低,因此含量降低。由于pH对花色苷的结构和稳定性影响较大,不同的pH会使花色苷结构发生转化,花色苷一般在酸性条件下比较稳定,利于花色苷的保存。因此,选择pH为0.5、1、2进行正交试验。
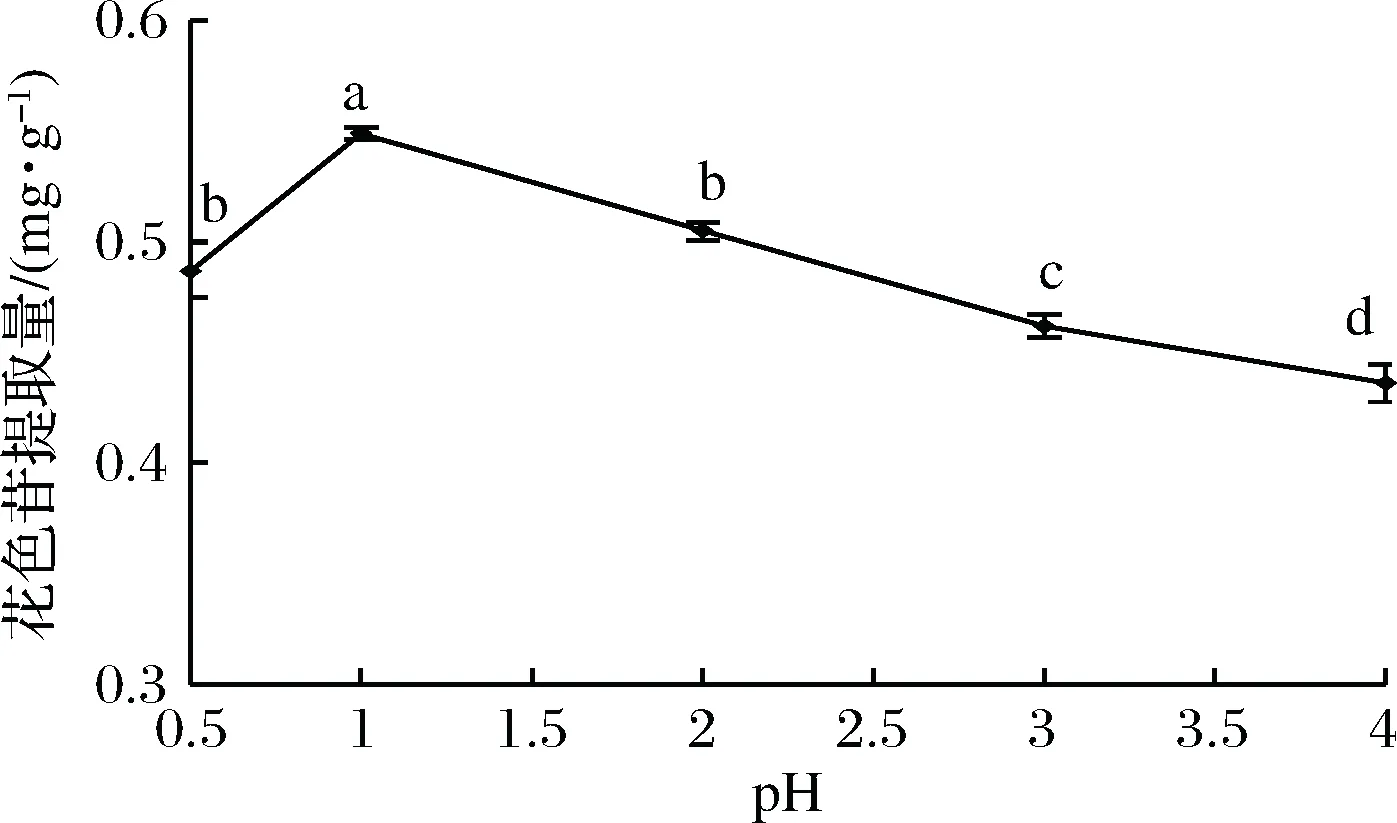
图5 pH对花色苷提取率的影响Fig.5 Effect of pH on extraction rate of anthocyanin
2.3.5 料液比对粗梗稠李花色苷提取量的影响
由图6可知,当料液比从1∶20提高到1∶50(g∶mL)时,粗梗稠李花色苷提取量逐渐增加,当料液比达到1∶50时提取量达到最大值,为0.661 mg/g,当料液比大于1∶50时花色苷提取量开始下降。增加溶剂用量,有利于粗梗稠李中的花色苷向提取液扩散,花色苷的提取量增加,但溶剂用量过度增加时会造成花色苷分子间的作用力减弱,稳定性降低、易被分解,从而导致花色苷的提取量降低,因此选择料液比为1∶50(g∶mL)为宜。
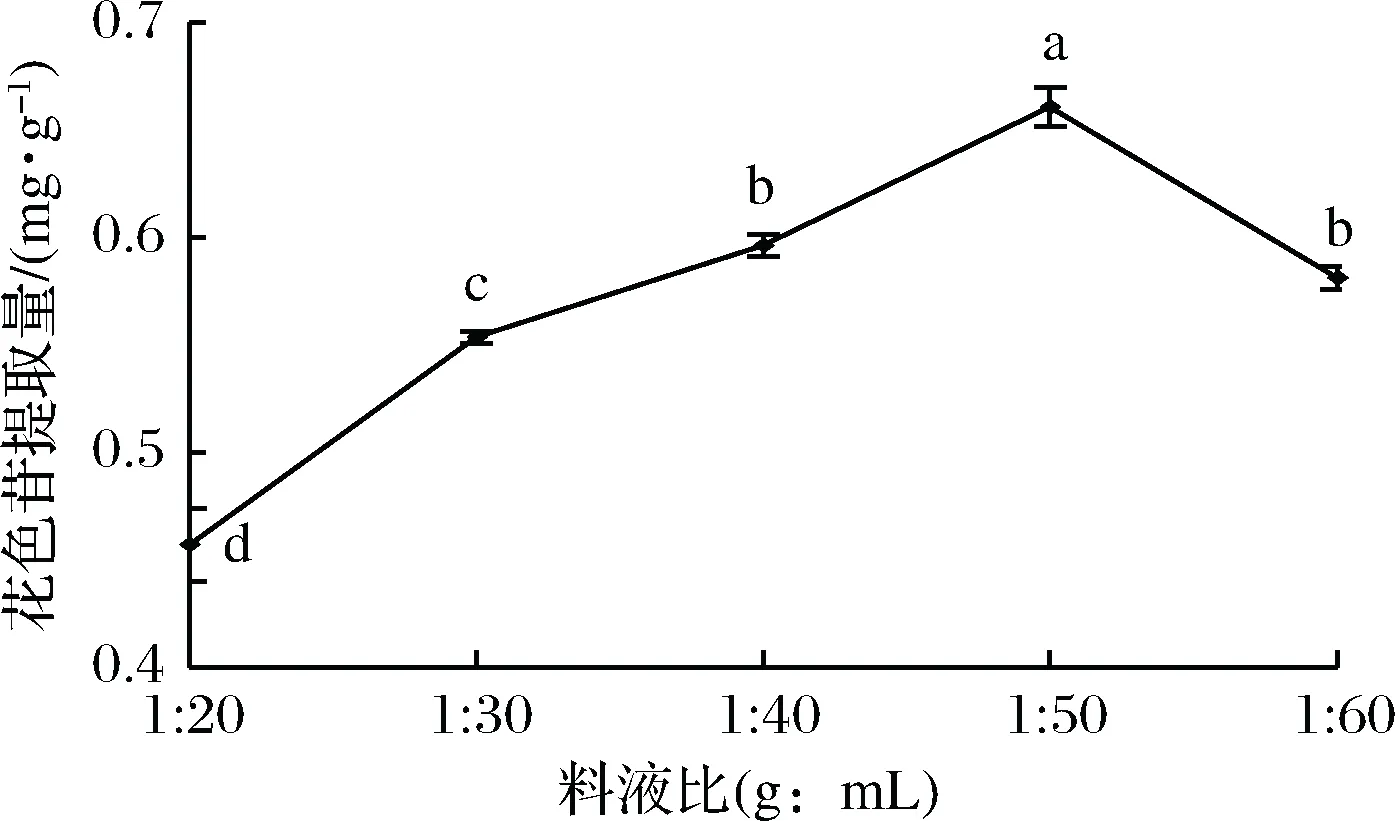
图6 料液比对花色苷提取率的影响Fig.6 Effect of material/liquid ratio on extractionrate of anthocyanin
2.4 正交试验
由表5的直观分析来看,粗梗稠李花色苷的最佳提取工艺为A3B2C1D3,而从极差结果分析可知最佳提取工艺为A3B3C1D3,为此,对A3B2C1D3和A3B3C1D3分别进行5次重复性验证试验。
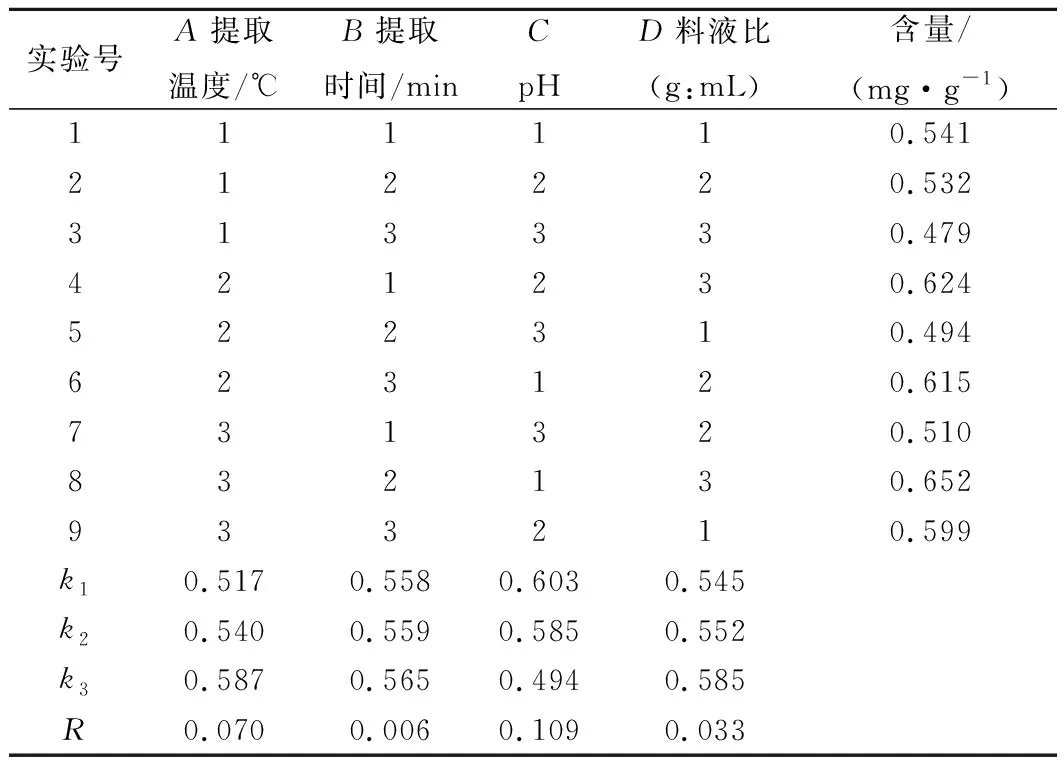
表5 正交试验结果Table 5 Orthogonal test results
试验表明,2种工艺下粗梗稠李花色苷的平均提取量分别为0.641和0.673 mg/g,由此可知粗梗稠李花色苷的最佳提取工艺为A3B3C1D3,即乙醇体积分数为60 %,提取温度为50 ℃,提取时间为90 min,提取液pH值为0.5,料液比为1∶50 (g∶mL)。且各因素对花色苷提取量的影响顺序为:pH(C)>温度(A)>料液比(D)>提取时间(B)。表6的方差结果表明,pH、提取温度、料液比对粗梗稠李花色苷的提取影响均显著(P<0.05)。由于FC>FA>FD>FB,4个因素对得率影响的大小顺序为:C>B>D>A,与表5中的极差分析结果一致。
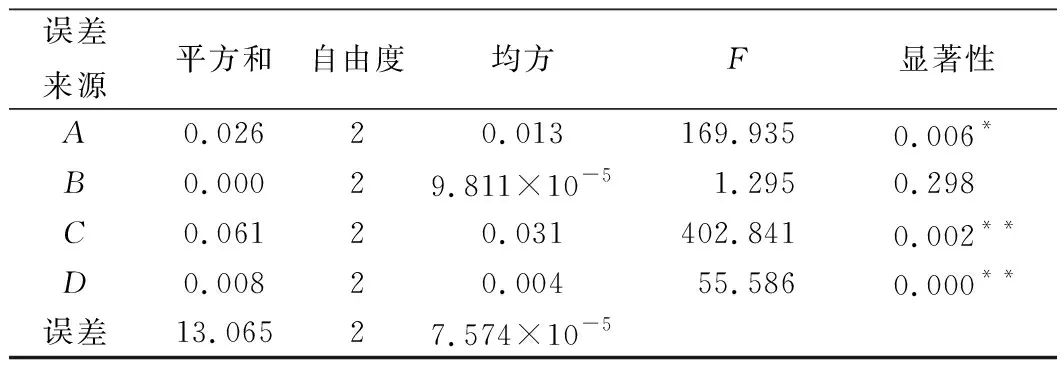
表6 方差分析Table 6 Analysis of variance
2.5 粗梗稠李花色苷的稳定性
2.5.1 温度对粗梗稠李花色苷稳定性的影响
在相同的加热时间内,随着温度的升高,粗梗稠李花色苷的保存率随之下降,且温度越高下降得越快,同时色差变化也逐渐增大(图7)。LALEH等[27]研究血红小檗等4种浆果花色苷在不同温度下的降解情况,推测可能是由于高温下花色苷C3位上糖基发生水解,从而导致稳定性降低。此外,温度升高时,花色苷的构型会向查耳酮式转换[28],从而导致溶液变色,色差增大。粗梗稠李花色苷在20~60 ℃下加热120 min时,花色苷的保存率均较高,在90%以上,因此粗梗稠李花色苷的提取温度应低于60 ℃。
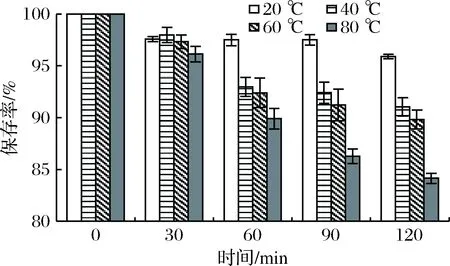
图7 温度对花色苷稳定性的影响Fig.7 Effect of temperature on the stability of anthocyanins
2.5.2 光照对粗梗稠李花色苷稳定性的影响
如图8所示,随着光照时间的延长,粗梗稠李花色苷在3种存储方式下的保存率均呈下降趋势,保存率顺序为:室内避光处>室内自然光>阳光直射处。5 d后室外自然光、室内自然光和室内避光处的保存率分别为38.6%、44.17%和48.32%,10 d后室外自然光照射下保存率急剧下降为1.94%,而室内自然光和室内避光处的保存率下降缓慢为41.22%和46.64%。这主要是因为光照强度加大,花色苷易出现酰基脱落的情况,致使稳定性和保存率降低[29],因此在实际加工和存储过程中应注意防止阳光直射。

图8 光照对花色苷稳定性的影响Fig.8 Effect of light on the stability of anthocyanins
2.5.3 金属离子对粗梗稠李花色苷稳定性的影响
如图9-a所示,随着储存时间和Mg2+浓度的增加,花色苷的保存率开始下降,下降的趋势与对照组无明显差异(P>0.05),说明Mg2+对花色苷的稳定性影响不显著。
如图9-b所示,当溶液中Al3+浓度为0.1 mol/L时,花色苷的吸光度大于对照组,而Al3+浓度<0.1 mol/L时,花色苷的吸光度小于对照组,说明高浓度的Al3+对粗梗稠李花色苷有增色作用。但随着放置时间的延长,加入Al3+的花色苷和对照组的保存率下降趋势基本相同,说明Al3+对花色苷的稳定性影响不显著。
如图9-c、图9-d所示,Zn2+和Cu2+对粗梗稠李花色苷有一定的破坏作用,5 d后,添加Zn2+和Cu2+的花色苷溶液的保存率降至40%,而对照组的保存率大于40%。且随着Zn2+和Cu2+浓度的增加,花色苷的保存率逐渐变小,与对照组存在明显差异(P<0.05)。
如图9-e所示,加入Fe3+的粗梗稠李花色苷的保存率呈现不断下降的趋势,下降幅度均大于对照组(P<0.05)。但Fe3+的浓度越高对花色苷保存率的影响相对越小,可见,Fe3+对花色苷的稳定性有较大的影响。
如图9-f所示,加入Ca2+后,花色苷的保存率的变化与对照组相比不显著(P<0.05),继续延长放置时间保存率下降变缓,由此可见,Ca2+对花色苷的稳定性影响不显著。
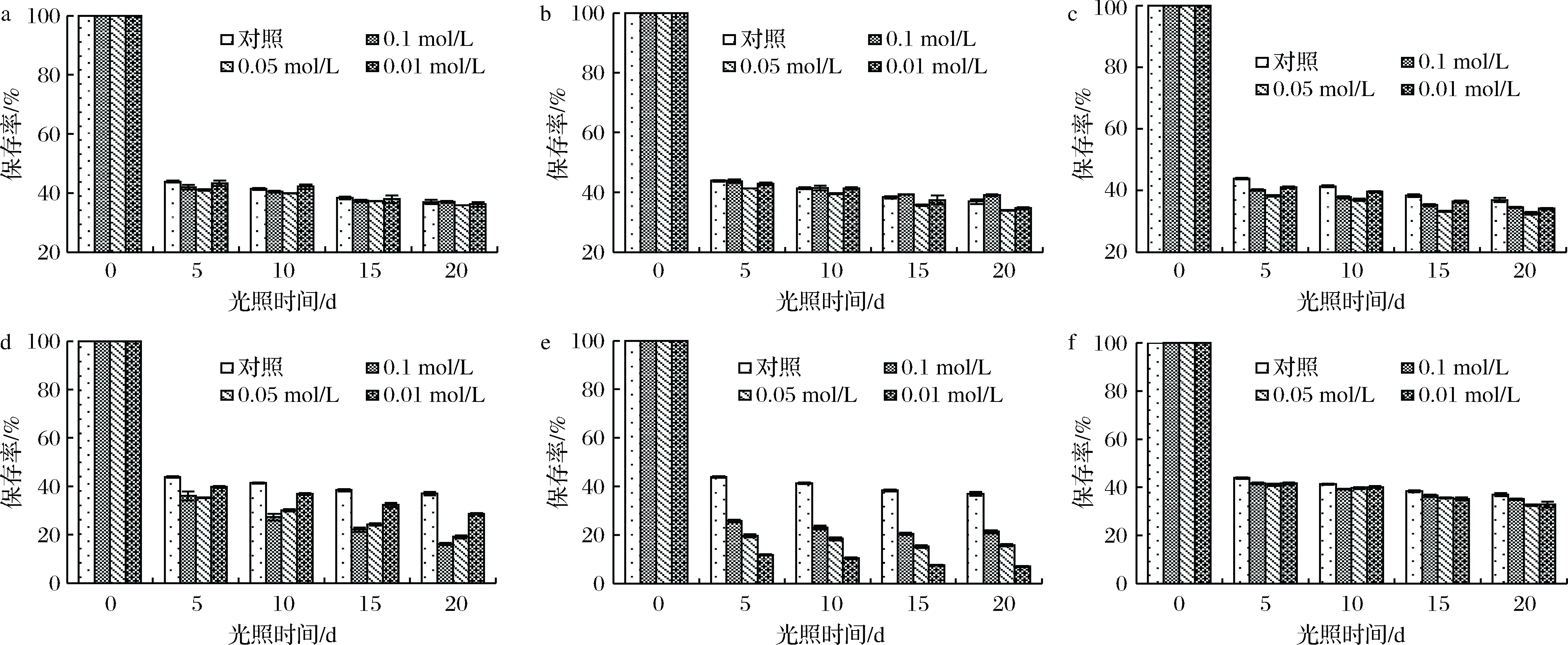
a- Mg2+;b-Al3+;c- Zn2+;d- Cu2+;e-Fe3+;f-Ca2+图9 金属离子对花色苷稳定性的影响Fig.9 Effect of metal ions on the stability of anthocyanins
2.5.4 食品添加剂对粗梗稠李花色苷稳定性的影响
2.5.4.1 蔗糖对粗梗稠李花色苷稳定性的影响
如图10所示,粗梗稠李花色苷中加入蔗糖溶液时,其颜色加深,且蔗糖浓度越大花色苷溶液颜色越深,吸光度越大,说明蔗糖对花色苷有一定的增色作用。随着放置时间的延长,加入蔗糖的花色苷溶液的保存率下降趋势较缓,且保存率均高于对照组,这说明蔗糖能够抑制花色苷的降解,保持花色苷的稳定性。

图10 蔗糖对花色苷稳定性的影响Fig.10 Effect of sucrose on the stability of anthocyanins
2.5.4.2 苯甲酸钠对粗梗稠李花色苷稳定性的影响
如图11所示,加入不同浓度的苯甲酸钠后,花色苷的保存率与对照组差异不显著(P>0.05),但5 d后,对照组保存率下降为46.12%,而加入苯甲酸钠的花色苷的保存率均大于50%,其中加入0.5、0.8 和1 mmol/L苯甲酸钠的花色苷的保存率分别为57.22%、57.63%、59.39%,且无明显差异(P>0.05),因此实际生产中可加入0.5 mmol/L的苯甲酸钠来增加粗梗稠李花色苷的稳定性。
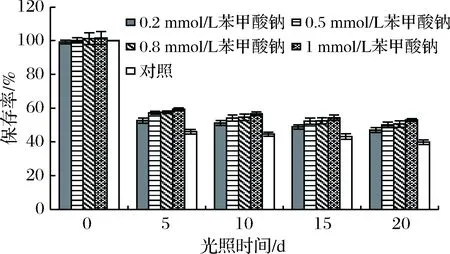
图11 苯甲酸钠对花色苷稳定性的影响Fig.11 Effect of sodium benzoate on the stability ofanthocyanins
2.5.4.3 抗坏血酸对粗梗稠李花色苷稳定性的影响
如图12所示,在花色苷溶液中加入抗坏血酸,花色苷的保存率下降,且浓度越大保存率下降的越多。随着放置时间的增加,加入抗坏血酸的花色苷溶液的保存率均低于对照组,其中加入5和10 mmol/L抗坏血酸的花色苷溶液保存率下降的最快,5 d后降低为9.18%和7.76%,而0.5、1 mmol/L和对照组的保存率分别为38.03%、33.88%和45.96%。这与李颖畅等[13],任二芳等[30]研究结果一致,抗坏血酸对花色苷有明显的降解作用,且抗坏血酸浓度越大,花色苷保存率下降的越多。这可能是因为抗坏血酸在接触氧气后,发生氧化反应生成H2O2,而H2O2可以直接亲核进攻花色苷的C2位,导致花色苷开环,发生降解[31]。因此,粗梗稠李花色苷溶液中不宜加入高浓度的抗坏血酸。
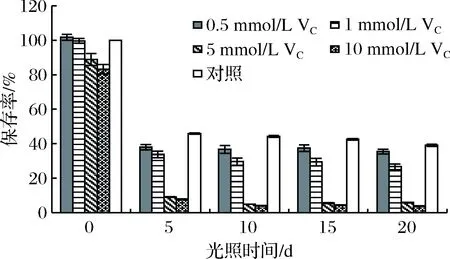
图12 VC对花色苷稳定性的影响Fig.12 Effect of VC on the stability of anthocyanins
3 结论
以滇西地区特色植物粗梗稠李成熟果实为原料提取花色苷,通过单因素正交试验优化得到最佳提取粗梗稠李花色苷的工艺为:乙醇体积分数为60%,提取温度为50 ℃,提取时间为90 min,提取液pH值为0.5,料液比为1∶50 (g∶mL),此条件下花色苷的提取量可达到0.673 mg/g。
粗梗稠李花色苷的保存率随着温度的升高和光照增加而降低,因此在粗梗稠李花色苷加工过程中需要避光处理,避光环境更有利于花色苷溶液的保存;在提取和热处理时,温度应低于60 ℃,储藏时应存放于4 ℃冰箱内。Mg2+和Al3+对粗梗稠李花色苷的稳定性影响不大,但Al3+对花色苷有一定的增色作用;Zn2+、Cu2+和Fe3+对花色苷有一定的破坏作用,使保存率下降,但Fe3+的浓度越高对花色苷保存率的影响相对越小;Ca2+对花色苷保存率的影响随着放置时间的延长而降低。蔗糖和苯甲酸钠对粗梗稠李花色苷有一定的增色和稳定作用;抗坏血酸对花色苷有破坏作用,浓度越大破坏作用越强。
本文从粗梗稠李中提取的色素主要为花色苷类色素,优化后的提取工艺操作简单,稳定性较好。同时考察了该花色苷的稳定性,为粗梗稠李的深加工和综合利用提供理论依据。

