孕中晚期羊水细胞培养联合FISH诊断胎儿染色体异常的临床价值
吴玥丽 吕 虹 赵 玲 朱重阳 赵 晖
河南省妇幼保健院(郑州大学第三附属医院)(450052)
通过羊水细胞培养分析染色体核型是目前临床常用的胎儿染色体异常产前诊断手段,但羊膜腔最佳穿刺时机为孕16~22周,孕晚期羊水细胞死亡率高,繁殖能力大幅下降[1-2]。对错过羊水细胞培养最佳时机的孕妇,一般建议行脐静脉穿刺行遗传学诊断,但该技术检测风险较高,对孕妇及胎儿损伤较大[3]。荧光原位杂交技术(FISH)能够实现细胞内特定染色体数目的检测或染色体上特定基因的定位判断[4]。本研究就羊水细胞培养联合FISH诊断孕中、晚期胎儿染色体异常的临床价值进行分析,为临床产前诊断提供参考。
1 对象与方法
1.1 研究对象
选取2015年6月-2018年6月本院接受羊水细胞培养、FISH产前诊断的孕妇2904例,孕妇均符合下列一项或多项产前诊断指征[5]:①血清学筛查高风险;②年龄≥35岁;③既往有染色体异常患儿生育史;④超声可见脉络丛囊肿、颈项透明层增厚、心室强回声、单脐动脉等软指标异常;⑤夫妇一方为染色体易位携带者或染色体异常。2904名孕妇中位孕周28周(25~37周),中位年龄28岁(25~47岁)。本研究已获本院医学伦理委员会批准,孕妇及其配偶均签署知情同意书。
1.2 检测方法
常规消毒铺巾,于B超引导下经腹抽取羊水30 ml,每例羊水标本分为两份,一份25 ml用于羊水细胞培养,另一份5 ml用于FISH检测。
1.2.1羊水细胞培养 参照相关标准[6],分别采用两套培养体系进行培养与制片。无菌环境下将羊水管离心弃上清,保留每管0.5 ml羊水细胞层,滴管打匀后分别接种至两个50 ml培养瓶底部,再沿培养瓶边缘分别加入两种不同的羊水培养液(4.5 ml),确保羊水培养液覆盖细胞悬液,37℃5%CO2恒温箱培养。5~6 d后更换培养液,并在倒置显微镜下观察细胞生长情况。镜下可见培养瓶底若干形态较好的梭形细胞克隆,继续培养并持续观察。1~2 d后,待克隆变大且可见成对圆形透亮细胞时收获细胞(一般于培养后7~9d收获细胞),收获前4 h加入24μg/ml秋水仙素,使细胞停止于分裂中期,常规制片,胰酶消化,G显带染色。常规计数20个,分析5个分散良好的细胞核型,核型异常者需计数50个分裂相,参照标准[7]进行核型分型诊断。
1.2.2 FISH检测 5 ml羊水标本,使用CSP18/CSPX/CSPY DNA探针和GLP13/GLP21 DNA探针(北京金菩嘉医疗科技有限公司),参照试剂盒操作说明书行标本处理、变性、杂交、洗涤等操作。于荧光显微镜下选取合适的滤光片观察荧光信号,计数、摄图保存并分析结果。结果判断[8]:由2人计数,每组探针计数细胞≥50个,若≥90%细胞核显示为正常整倍体信号,则为整倍体;若非整倍体信号≥60%,则为非整倍体(两个信号点之间的具体≥一个信号点的直径,方可记为两个独立的荧光信号;重叠、信号弥散及微弱均不作记录)。
1.3 分析方法
分析羊水细胞培养、FISH检测的成功率,以及胎儿染色体异常检测结果,总结孕中晚期羊水细胞培养联合FISH诊断胎儿染色体异常的临床价值。
1.4 统计学分析
所有数据采用Microsoft Excel 2010进行分析,染色体异常分类计数以(n)表示,构成比以(%)表示。
2 结果
2.1 羊水细胞染色体核型分析
2904份羊水标本中,2815份培养成功(96.9%),标本自接种、培养至核型分析均分为两组,两组分析2815例羊水染色体结果均一致。在成功培养的2815份标本中,发现异常核型139例(4.94%),异常染色体核型见表1。
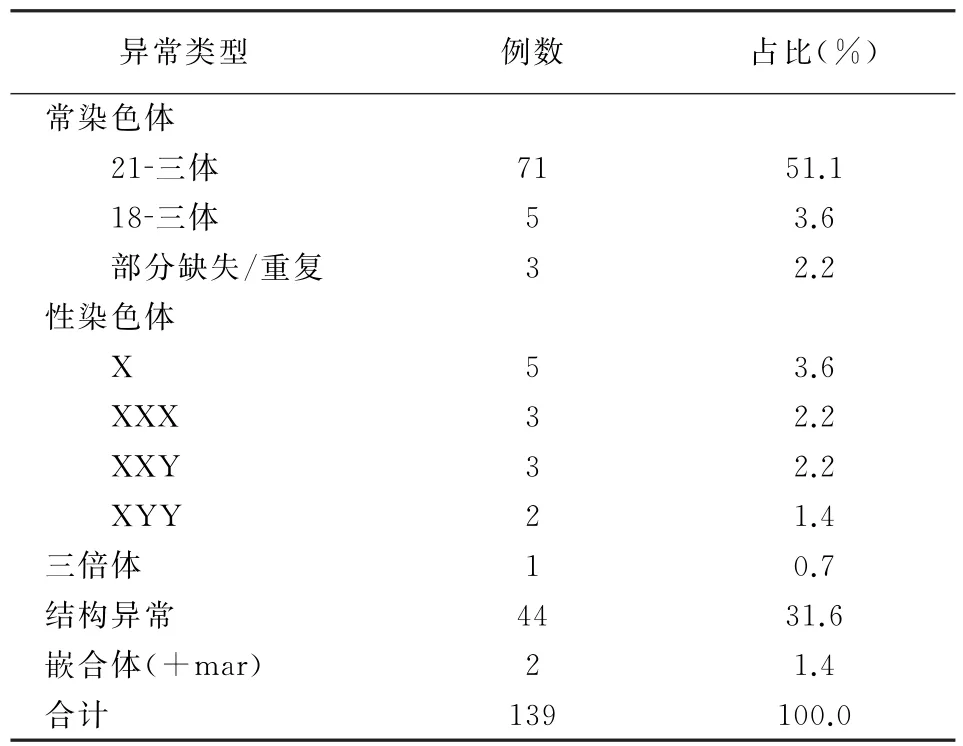
表1 139例染色体异常类型及占比分析
2.2 羊水FISH检测结果分析
2904份羊水标本FISH检测均成功(100.00%)。FISH检测共检出染色体数目异常90例,与羊水细胞染色体核型分析结果一致,其余3例染色体核型检出染色体部分缺失重复,FISH检测未见异常;44例染色体结构异常,2例嵌合体(+mar)异常均未检出,见表2。
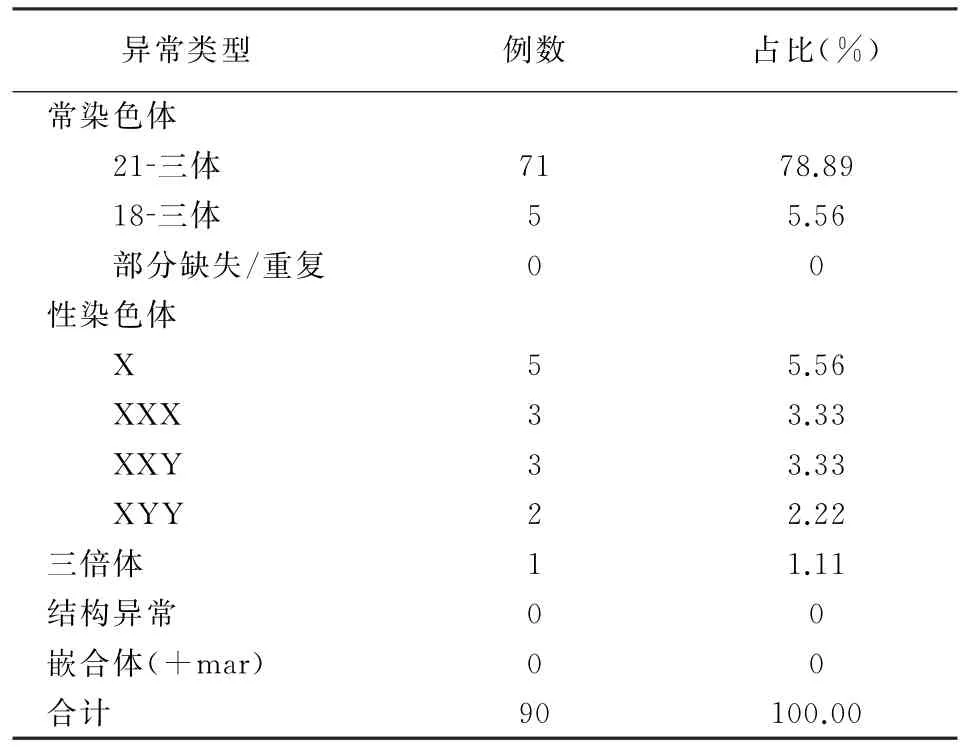
表2 90例羊水FISH检测异常结果分析
3 讨论
染色体异常是导致新生儿出生缺陷的最常见遗传性疾病[9]。产前筛查能够在较大范围内实现唐氏综合征的风险评估,但受筛查性质所限,产前筛查也存在一定假阳性、假阴性,需通过羊水细胞培养染色体核型分析确诊[10]。羊膜腔穿刺术是当前临床常用的有创性产前诊断技术,而遗传学分析也被认为是产前诊断的标准方法。羊膜腔穿刺一般适用于孕16~22周,孕≥24周后羊水培养失败率有所上升[11]。若高风险孕妇错过了羊膜腔穿刺时机,往往需要接受脐静脉穿刺,而脐静脉穿刺风险大、技术要求高[12]。另外存在穿刺失败、取血困难[13]。提高孕中晚期羊水细胞培养成功率,一直是产前诊断领域关注重点。
本次研究尝试对2904名孕中晚期孕妇行羊水细胞培养,培养成功率达96.9%,发现异常核型139例,说明对于孕中晚期孕妇而言,羊水细胞培养的成功率与诊断效率亦应值得肯定,在实际临床操作中注重如下环节,是确保培养成功率的关键:①羊水细胞有较多上皮细胞,常在培养早期出现,初次更换培养液时间建议提前1~2 d,如细胞生长不良可换液后继续培养;也可使用胰蛋白酶消化、收集离心后,将沉淀层吹匀,加适量培养液继续培养,以获取满意的贴壁细胞[14-15]。②在分别使用两种培养液、两个CO2恒温培养箱培养细胞时,应尽量减少开关温箱门、镜下观察细胞的次数,避免外在因素对细胞生长带来不良影响。③若细胞经长期培养后克隆仍较少且难以继续培养,收集离心后,在染色体制备过程中,建议适当减少低渗液、固定液含量,或者减少制片数量,以避免细胞丢失、保证分裂相的可读性[16]。
需要注意的是,羊水细胞培养仍存在一定不足之处,如无法明确带型的染色体异常(如标记染色体或新发染色体结构重排)、羊水细胞染色体嵌合现象等。同时,受光学显微镜分辨率限制,目前仅可辨认6×106bp以上的染色体重排,对微缺失无法辨认[17]。FISH技术可在48h内完成检测,对孕周无严格要求,不要求细胞必须处于分裂中期,敏感特异性高,具有快速、简便、可靠等优势[17]。本研究结果示,2904份羊水标本FISH检测成功率达100.00%,共检出染色体数目异常90例,与羊水细胞染色体核型分析结果一致,有3例染色体部分缺失/重复、44例染色体结构异常、2例嵌合体FISH均未检出。由此可见,FISH技术虽然能够快速检出胎儿部分染色体非整倍体异常,但仅可用于特定染色体非整倍体异常(21、18、13、X和Y)的检出,仍存在一定残余风险。
综上所述,孕中、晚期羊水细胞培养核型分析诊断胎儿染色体异常的临床价值值得肯定,在此基础上联合FISH检测能够提高诊断效率,缩短孕妇等待时间,但FISH技术无法替代传统的细胞遗传学方法,仅可作为传统方法的一项重要补充。

