嗜盐真菌Aspergillus montevidensis生物特性研究
卢雨欣,杨学英,米 洋,刘开辉,2,邓百万,3 *,赵航轲
(1.陕西理工大学 生物科学与工程学院,陕西 汉中 723000; 2.陕西科技大学 食品与生物工程学院,陕西 西安 710021; 3.陕西省食药用菌工程技术研究中心,陕西 汉中 723000)
【研究意义】 我国是盐碱地大国,在全世界国家的盐碱地面积中位居第三,且分布广泛[1-2]。土壤盐碱化已成为世界农业的主要非生物胁迫源,盐碱土壤由于高渗透压、高pH使植物细胞内环境稳态严重失调,导致农作物大面积减产甚至绝收,造成了巨大的经济损失[3-4]。因此,对盐碱地土壤修复及开发利用具有重要意义。从微生物角度而言,高盐土壤环境的利用主要包括降低土壤盐浓度和培育新型耐盐作物两个方面[5],其中通过筛选嗜盐微生物的耐盐基因已成为解决高盐环境问题的重要手段,采用基因工程手段将耐盐基因导入植物体内,从而获得耐盐能力较强的新型生物技术作物[6]。因此嗜盐微生物在高盐土壤环境改良利用及农业生产方面具有重要作用。【前人研究进展】嗜盐微生物由于长期生活在高盐环境中,具有特殊耐盐机制[7-10]。但有关嗜盐微生物耐盐机制的研究多集中在细菌、放线菌等原核微生物中,对嗜盐真菌耐盐机制的研究报道较少[11]。嗜盐真菌为适应高盐环境,其相关耐盐基因必然会在盐胁迫下进行高效表达[12],而形态学上的差异则是其对高盐环境做出的直观表现[13-14]。如Kuncic等[15]就从形态学角度对嗜盐真菌Wallemiaspp.响应高盐诱导进行了研究,发现在高盐胁迫下其细胞壁显著增厚,菌丝球大小显著增加。现阶段关于碳源、氮源对微生物生长的影响已经有了一定的研究,且研究发现含碳化合物和含氮物质对嗜盐真菌的耐盐可能有影响[16-18]。【本研究切入点】本研究从形态学角度对嗜盐真菌Aspergillusmontevidensis生物特性进行初步探究。通过研究高盐环境中不同碳源、不同氮源、不同碳氮比对嗜盐真菌A.montevidensis生长速度、生物转化量、菌落形态以及显微形态特征的影响,对比分析其对嗜盐真菌耐盐的影响,初步探究嗜盐真菌的耐盐机制。【拟解决的关键问题】通过对嗜盐真菌的生物学特性研究,可进一步从分子水平及生物代谢水平探究嗜盐真菌的耐盐机理。同时根据嗜盐真菌的耐盐机制,寻找关键耐盐基因,通过转基因手段培育耐盐植株,为进一步开发利用嗜盐真菌资源及解决盐碱化土壤环境农业生产方面的应用研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株 嗜盐真菌Aspergillusmontevidensis(菌株保藏号:CGMCC3.15762)
1.1.2 培养基配方 PBS缓冲液:Na2HPO41.42 g,NaCl 8 g,K2HPO40.27 g,KCl 0.2 g,加去离子水约800 mL,充分搅拌至试剂完全溶解,调pH至7.4,定容到1 L,121 ℃灭菌25 min后室温保存。
基础培养基(1000 mL):葡萄糖20 g,蛋白胨5 g,K2HPO41 g,MgSO4(7H2O 0.5 g,VB110 mg,琼脂粉18 g,pH 6.5。
供试碳源培养基:以供试碳源替换基础培养基中的葡萄糖,各组分含量不变,同时分别添加0、1.5和3 mol/L的NaCl制成不同盐浓度梯度的供试碳源培养基。供试碳源为:淀粉、纤维素、麦芽糖、蔗糖、葡萄糖。
供试氮源培养基:以供试氮源替换含最佳碳源的基础培养基中的蛋白胨,各组分含量不变,同时分别添加0、1.5和3 mol/L的NaCl制成不同盐浓度梯度的供试碳源培养基。供试碳源为:硝酸铵、氯化铵、酵母粉、蛋白胨、硝酸钾。
供试C/N培养基(1000 mL):Na2HPO46 g,K2HPO43 g,KNO33.57 g,MgSO4(7H2O 0.12 g,CaCl20.01 g,葡萄糖20 g,琼脂粉18 g,pH自然。以葡萄糖和KNO3为碳氮源,使培养基中的碳素及氮素质量比分别为10∶1、1∶1、1∶10,同时分别添加0、1.5和3 mol/L的NaCl制成不同盐浓度梯度的碳氮比培养基。
1.1.3 主要仪器 见表1。
表1 实验设备与仪器
1.2 实验方法
1.2.1 菌落形态观察 将嗜盐真菌A.montevidensis接种于相应的培养基中,28 ℃倒置培养7 d,观察菌落形态,实验设置3个重复。
1.2.2 显微形态观察 采用插片法,在嗜盐真菌A.montevidensis接种位点旁斜45°插入无菌盖玻片,待有菌丝爬上盖玻片后,取出盖玻片并用棉兰进行染色,用高级光学显微镜进行菌丝、产孢结构等显微形态的观察。
1.2.3 菌丝生长速率测量 将嗜盐真菌A.montevidensis接种于相应的培养基中,28 ℃倒置培养7 d,每隔24 h测量培养皿中菌落的生长半径,每种培养基设置3个重复,计算菌丝平均生长速率。
1.2.4 菌丝体干质量测量 将嗜盐真菌A.montevidensis接种于相应培养基中,28 ℃、150 r/min培养7 d,过滤收集菌丝,用PBS缓冲液反复冲洗3次,60 ℃烘至恒重,进行干质量测量。每种培养基设置3个重复。
2 结果与分析
2.1 不同碳源对嗜盐真菌A.montevidensis耐盐的影响
如表2、图1所示,随着盐浓度的增加,嗜盐真菌A.montevidensis菌丝生长旺盛,分生孢子链更长且更加致密,在1.5 mol/L盐浓度下其黄色素达到最大沉积,在3 mol/L高盐浓度下孢子中的色素由黄色转变为青灰色及黑色,菌丝纤细为白色。在不同碳源中,以蔗糖为唯一碳源时,嗜盐真菌A.montevidensis最先满皿,菌丝生长旺盛并有大量孢子产生,且在1.5 mol/L盐浓度下孢子中的黄色素就已经开始转变为青灰色及黑色。以葡萄糖为唯一碳源时生长次之。虽然以纤维素为唯一碳源时,孢子色素也较早转变,但从菌落形态观察,其并不利于菌丝生长。因此,嗜盐真菌A.montevidensis的耐盐性受不同碳源的影响,且以蔗糖为唯一碳源时展现出最好的耐盐性,且该嗜盐真菌A.montevidensis的最适生长盐浓度为1.5 mol/L。
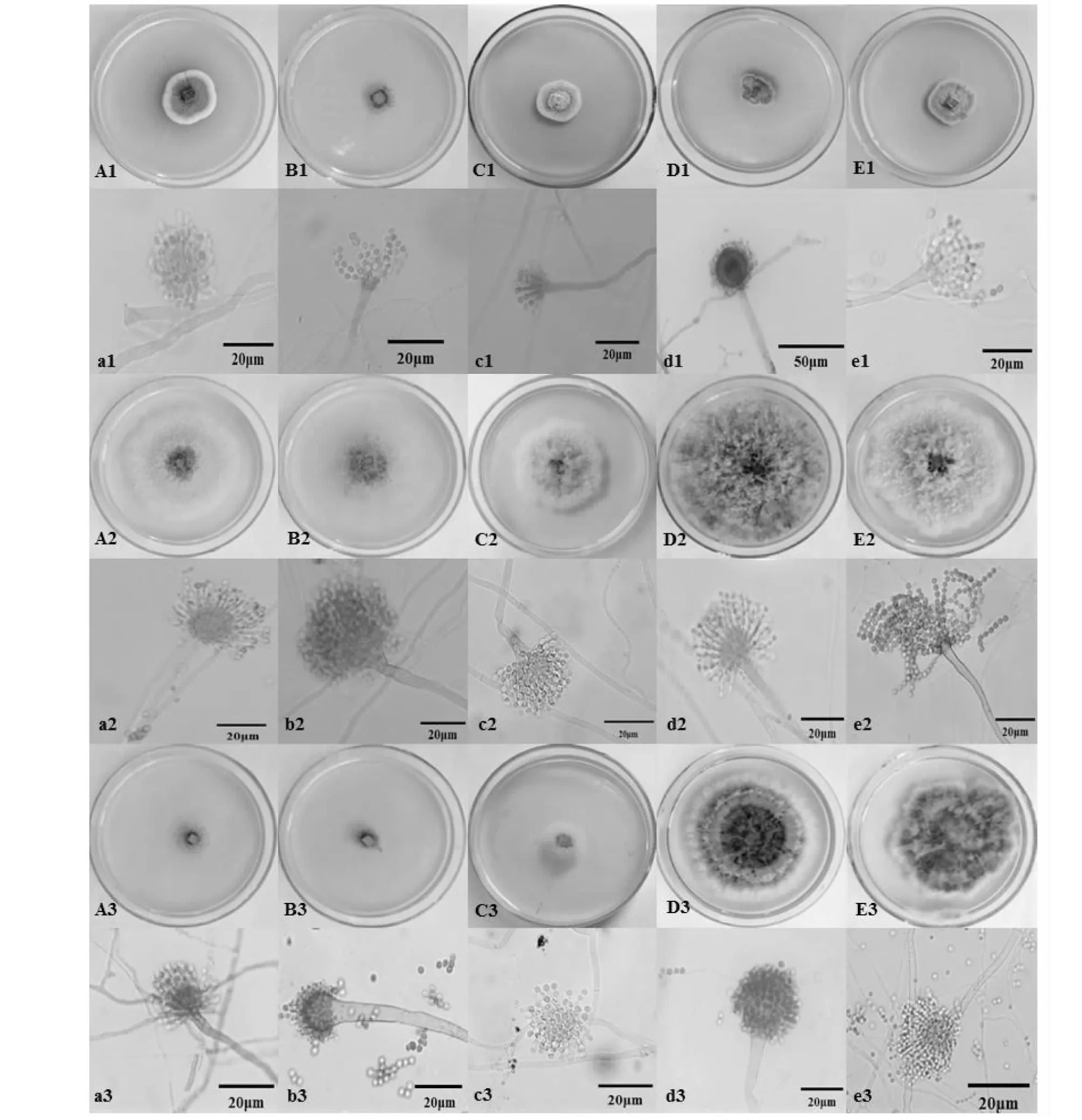
A/a、B/b、C/c、D/d、E/e分别表示以淀粉、纤维素、麦芽糖、蔗糖、葡萄糖为唯一碳源时,嗜盐真菌A.montevidensis的菌落形态(显微形态);1、2、3分别代表0、1.5、3 mol/L盐浓度A/a,B/b,C/c,D/d and E/e respectively represent the colony morphology (microscopic morphology) of halophilic fungus A.montevidensis when starch,cellulose,maltose,sucrose or glucose are the only carbon sources; 1,2 and 3 respectively represent the salt concentration of 0,1.5 and 3 mol/L
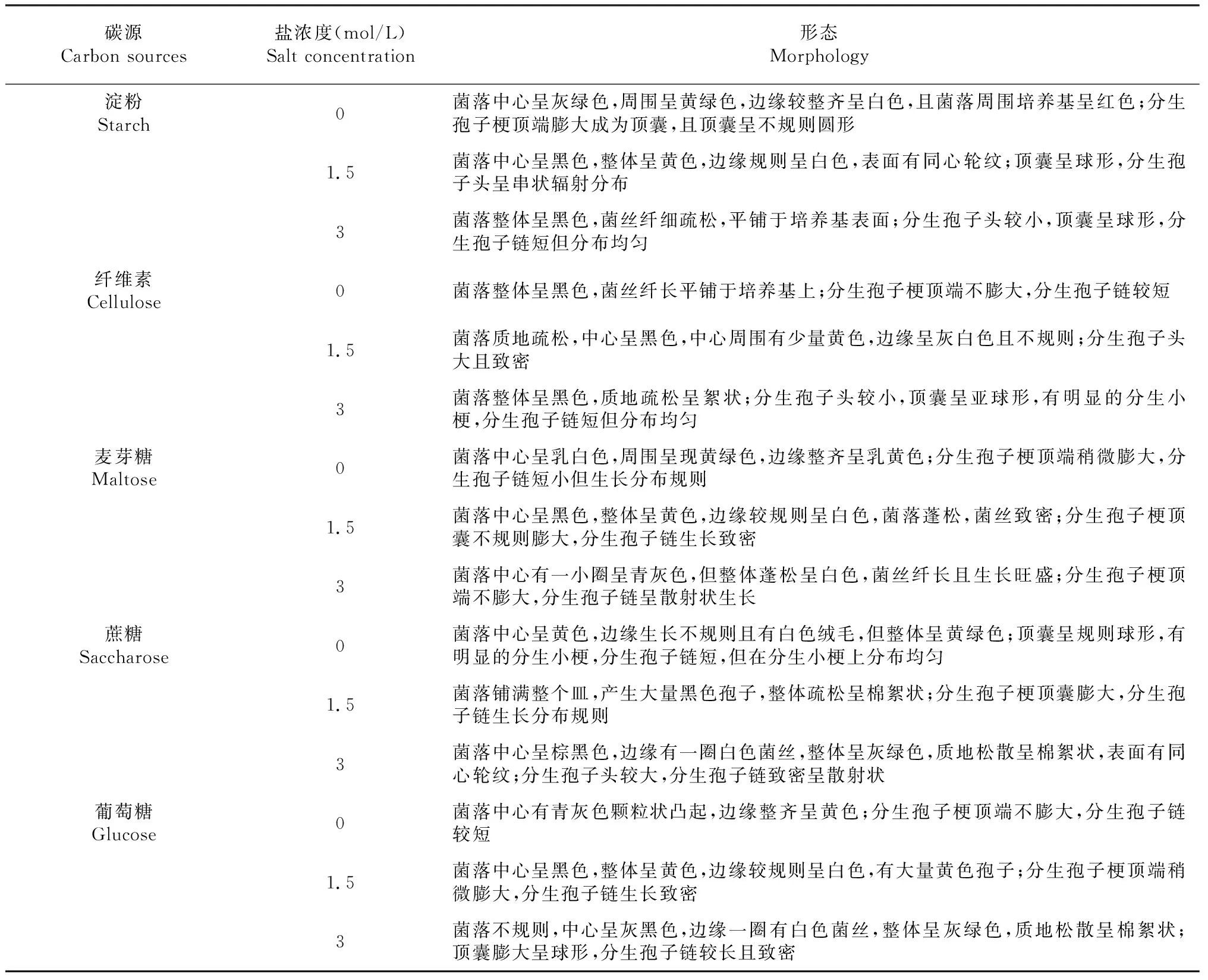
表2 不同碳源对嗜盐真菌A.montevidensis形态的影响
如图2所示,不同盐浓度下嗜盐真菌A.montevidensis在5种不同碳源的培养基上的生长速率、菌丝体干质量均不同。当NaCl浓度为1.5 mol/L时,以蔗糖为碳源时该菌生长速率最快为0.61 cm/d,菌丝体平均干质量最大为3.00 g/L;当NaCl浓度为3 mol/L时,同样是以蔗糖为碳源时该菌生长最快,生长速率为0.54 cm/d,菌丝体干质量最大为2.41 g/L。在无盐条件下时,该菌在不同碳源的培养基上生长速率、生物转化量差异并不明显,但随着盐浓度的增加,差异明显,进一步说明了不同碳源对该菌株的耐盐性存在影响。
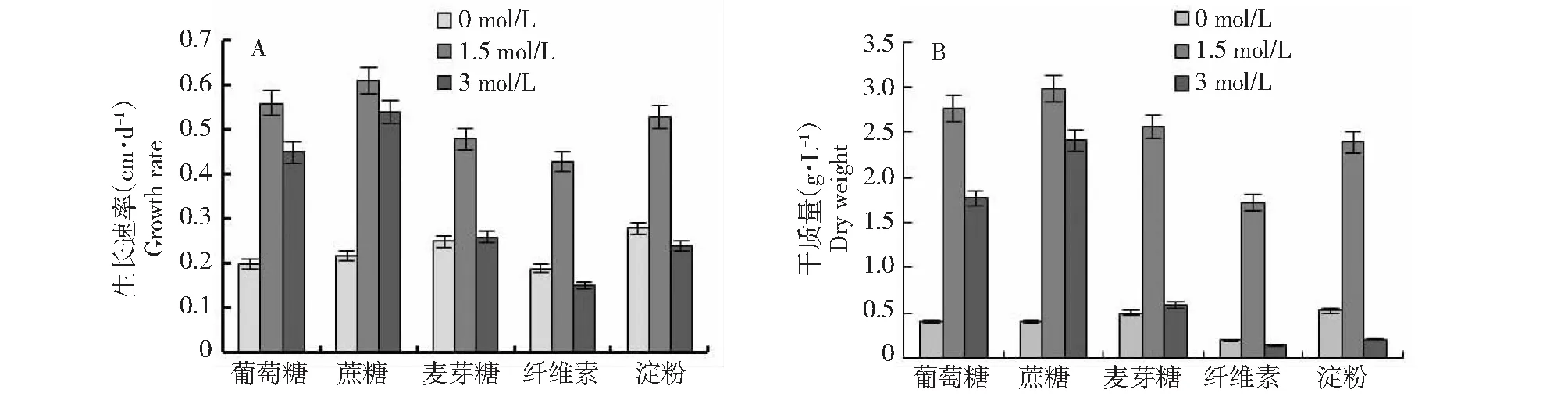
图2 不同碳源下嗜盐真菌A.montevidensis的生长速率(A)及菌丝体干质量(B)Fig.2 Growth rate (A) and dry weight (B) of halophilic fungus A.montevidensis under different carbon sources
2.2 不同氮源对嗜盐真菌A.montevidensis耐盐的影响
如表3、图3所示,随着盐浓度的增加,嗜盐真菌A.montevidensis分生孢子链更长且更加致密,菌丝纵向生长越来越旺盛,甚至3 mol/L盐浓度下,嗜盐真菌A.montevidensis在以酵母粉为唯一氮源的培养基上其菌丝已触及皿盖。在不同的氮源中,以蛋白胨为唯一氮源时嗜盐真菌A.montevidensis最先满皿且产生大量孢子,在1.5 mol/L盐浓度下孢子中的黄色素就已经开始转变为青灰色及黑色。从菌落形态观察,以硝酸铵、氯化铵、酵母粉为唯一氮源时,有利于该嗜盐真菌在3 mol/L高盐浓度下菌丝的生长,但不利于其产生孢子。因此,嗜盐真菌A.montevidensis的耐盐性也受到不同氮源的影响,在以蛋白胨为唯一氮源时展现出最好的耐盐性。

A/a、B/b、C/c、D/d、E/e分别表示以硝酸铵、氯化铵、酵母粉、蛋白胨、硝酸钾为唯一氮源时,嗜盐真菌A.montevidensis的菌落形态(显微形态);1、2、3分别代表0、1.5、3 mol/L盐浓度 A/a,B/b,C/c,D/d and E/e respectively represent the colony morphology (microscopic morphology) of halophilic fungus A.montevidensis when ammonium nitrate,ammonium chloride,yeast powder,peptone or potassium nitrate are the only nitrogen sources;1,2 and 3 respectively represent the salt concentration of 0,1.5 and 3 mol/L

表3 不同氮源对嗜盐真菌A.montevidensis形态的影响
如图4所示,在1.5 mol/L盐浓度下,以蛋白胨为唯一氮源时生长速率最快为0.63 cm/d,菌丝体平均干质量最大为3.05 g/L,酵母粉、硝酸钾、硝酸铵次之。在3 mol/L盐浓度下,仍是以蛋白胨为氮源时菌丝生长速率最快为0.57 cm/d,其菌丝体平均干质量最大为2.56 g/L。氮源种类的不同对嗜盐真菌A.montevidensis的生长影响较大,且随着盐浓度的增加差异较为明显,进一步说明了不同氮源对该菌株的耐盐性也存在影响。

图4 不同氮源下嗜盐真菌A.montevidensis的生长速率(A)及菌丝体生物量(B)Fig.4 Growth rate (A) and dry weight (B) of halophilic fungus A.montevidensis under different nitrogen sources
2.3 不同C/N对嗜盐真菌A.montevidensis耐盐的影响
由图6可以看出,0 mol/L盐浓度下,嗜盐真菌A.montevidensis在不同C/N的培养基中生长状况良好,在C/N为1∶1和1∶10的培养基上,菌落整体为绒状,中间呈黄色,边缘整齐呈白色;在C/N为10∶1的培养基上,菌落表面有乳白色颗粒状凸起,边缘处里面呈浅棕色外面为黄色。1.5 mol/L盐浓度下,嗜盐真菌A.montevidensis在不同C/N的培养基上菌落形态相似,在C/N为1∶1的培养基上菌落边缘处出现一圈浅绿色,在C/N为10∶1的培养基上菌落整体更为蓬松,菌丝更加致密,边缘的绿色比之C/N为1∶1的培养基颜色加深。3 mol/L盐浓度下,嗜盐真菌A.montevidensis在C/N为10∶1的培养基中生长状况最好,菌落整体呈蓝绿色;1∶10的培养基上该菌生长次之,菌丝呈浅绿色;在1∶1的培养基上菌丝呈白色,且仅呈现为萌发状态。由此可见,C/N为10∶1的培养基是嗜盐真菌A.montevidensis的最佳C/N培养基。
选取最优C/N=10∶1,观察其在0、1.5、3 mol/L盐浓度下的显微形态如图6所示。0 mol/L盐浓度下有大量成熟的闭囊壳结构,大小约为44.51~65.74 μm × 46.98~70.72 μm;1.5和3 mol/L盐浓度下,显微形态差别并不显著,均存在分生孢子头和闭囊壳两种结构,其闭囊壳大小约为32.09~42.26 μm × 36.00~47.04 μm,但1.5 mol/L盐浓度下的菌丝及闭囊壳结构多于3 mol/L。说明随着盐浓度的增加,嗜盐真菌A.montevidensis其繁殖方式从以闭囊壳为主的有性繁殖转变为以分生孢子为主的无性繁殖。

A、B、C分别代表0、1.5、3 mol/L盐浓度A,B and C respectively represent the salt concentration of 0,1.5 and 3 mol/L
3 讨 论
通过对嗜盐真菌A.montevidensis生物特性的初步探究,结果表明:嗜盐真菌A.montevidensis在盐浓度为1.5 mol/L,以蔗糖为碳源、以蛋白胨为氮源的培养基上生长状况最好,此条件下平均生长速率为0.63 cm/d,菌丝体干质量达3.05 g/L。嗜盐真菌A.montevidensis生长最佳C/N为10∶1。董秀黄等[19]人曾利用蔗糖作为碳源从新疆哈密南湖分离得到最多的嗜盐菌;王艳红[20]等人通过对中度嗜盐菌HalobacillusY5的研究,发现其生长最适碳源为蔗糖,最适氮源为蛋白胨。说明蔗糖与蛋白胨能使嗜盐菌在盐胁迫条件下更好的生存,与本研究结果一致。
嗜盐真菌通过调节复杂的生命活动过程,继而为适应高盐环境的响应策略在形态学上的表现也有所不同[15,21]。本研究中的嗜盐真菌A.montevidensis,在不同碳氮源条件下,当嗜盐真菌A.montevidensis菌落变为青灰色或黑色,菌丝生长旺盛,分生孢子链长且致密时,展现出更好的耐盐性。在无盐条件下,以产生闭囊壳结构为主,而在高盐环境中会以产生分生孢子为主。
本研究通过对嗜盐真菌A.montevidensis最佳盐浓度以及碳氮源筛选,结合形态学特征对该菌生物学特性进行初步研究。为进一步全面揭示该嗜盐真菌耐盐机制提供参考,同时为耐盐基因的筛选及耐盐农作物培育提供了理论依据,为高盐环境土壤结构改良及开发利用,以促进农业发展奠定了基础。
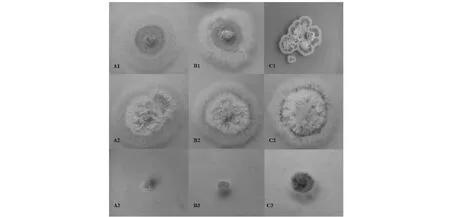
A、B、C表示的C/N分别为1∶10、1∶1、10∶1;1、2、3分别代表0、1.5、3 mol/L盐浓度C/N respectively represented by A,B and C are 1∶10,1∶1 and 10∶1; 1,2 and 3 respectively represent the salt concentration of 0,1.5 and 3 mol/L

