木糖和葡萄糖共发酵生产L-组氨酸
吴鹤云,张悦,蒋帅,田道光,谢希贤,2,陈宁,2*
1(天津科技大学 生物工程学院,天津,300457)2(代谢控制发酵技术国家地方联合工程实验室,天津,300457)
L-组氨酸是一种重要的功能性氨基酸,具有抗炎[1]、抗氧化[2]和免疫调节[3]等多种生理功能,在医药[4]、保健食品[5]和饲料行业[6]有着广阔的应用前景。血粉等蛋白原料的水解提取是目前L-组氨酸的主要生产方法[7],但是原料不易得,设备损失率高等因素制约了此法的生产规模,很难满足日益增长的L-组氨酸市场需求。而发酵法生产氨基酸具有原料来源广泛、反应所需能耗低、环境友好等优点[8],适合工业化生产,成为L-组氨酸生产研究的主流方向。
高效生产L-组氨酸菌种的缺失是限制发酵法规模化生产L-组氨酸的主要因素,所以菌种改良仍旧是目前L-组氨酸发酵生产研究的重点,研究者也在通过诱变筛选或者代谢工程改造的方法持续改良L-组氨酸菌种的发酵性能[9-13]。这些研究通过解除L-组氨酸生物合成的调控作用,强化合成途径,增强前体物供应等策略的应用,显著提高了菌种L-组氨酸的生产能力。本实验室前期通过CRISPR/Cas9介导的基因组编辑方法[14]直接改造大肠杆菌W3110的染色体,通过对组氨酸操纵子前导序列的替换,增加操纵子基因的拷贝数和引入外源解调控的HisG突变体[15](HisG*),构建了菌株EscherichiacoliHIS1,该菌L-组氨酸生物合成途径所受调控作用已解除,L-组氨酸合成途径被强化,具备了过量积累L-组氨酸的能力。
L-组氨酸生物合成最主要的限制因素是关键酶HisG所受的反馈抑制作用。许多研究者[16-17]致力于筛选解调控的HisG突变体,以促进L-组氨酸的过量合成。然而L-组氨酸的合成是一个十分耗能的过程,会占用细胞大量的资源[18],所以HisG的活性过强则容易导致菌体的生长受限,反而会影响L-组氨酸的最终产量,于是如何在不妨碍菌体生长的前提下尽可能提高HisG的活性便成为菌株高效生产L-组氨酸的关键。使用诱导型启动子启动关键酶的表达,通过调整诱导剂浓度或诱导时间可调控菌体的生长和产物生成。NAKASHIMA等[19]通过在大肠杆菌基因组上引入T7RNA聚合酶,并用木糖诱导的启动子PxylF启动表达,同时对糖代谢转录抑制因子的编码基因mlc进行点突变解除葡萄糖对木糖启动子转录的阻遏作用,建立了一套木糖诱导的T7表达系统。该系统结合T7启动子不仅可实现目的基因可控的强表达,还避免了质粒的使用,且木糖作为诱导剂相比异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,TPTG)等常用诱导剂价格低廉。E.coliHIS1的构建过程中便借鉴了NAKASHIMA等的研究成果,采用木糖诱导的T7表达系统控制L-组氨酸合成关键酶HisG*的表达。
发酵条件优化是提高目标产物发酵生产效率的重要方法[20-23]。本研究通过摇瓶和发酵罐培养的方式优化了E.coliHIS1的发酵条件,主要对木糖的添加量,添加时间和添加方式进行了优化。
1 材料与方法
1.1 菌株和质粒
本研究涉及的菌株和质粒如表1所示。

表1 本研究涉及的菌株和质粒
1.2 培养基
斜面培养基:葡萄糖 1 g,蛋白胨 10 g,牛肉膏 10 g,酵母粉 5 g,NaCl 2.5 g,溶于1 000 mL水中。
种子培养基:葡萄糖 20 g,酵母粉 4 g,蛋白胨 3 g,K2HPO4·3H2O 1.2 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 20 mg,MnSO4·H2O 20 mg,VB1、VB3、VB5、VB12、VH各1 mg,溶于1 000 mL水中。
发酵培养基:葡萄糖 20 g,酵母粉 5 g,蛋白胨 4 g, K2HPO4·3H2O 6 g,MgSO4·7H2O 1.5 g,FeSO4·7H2O 20 mg,MnSO4·H2O 20 mg,VB1、VB3、VB5、VB12、VH各2 mg溶于1 000 mL水中。木糖根据实验需要酌情添加,详见结果与分析部分。
1.3 xylA基因敲除
采用CRISPR/Cas9介导基因编辑方法敲除xylA基因,所涉及的引物如表2所示,操作过程参考文献[14, 24]:以E.coliW3110基因组为模板,根据其xylA基因的上下游序列设计上游同源臂引物(UP-xylA-S、UP-xylA-A)和下游同源臂引物(DN-xylA-S、DN-xylA-A),并用聚合酶链式反应(polymerase chain reaction,PCR)扩增其上下游同源臂片段;上述片段通过重叠PCR的方法融合,获得用于xylA基因敲除的重组片段,构建pGRB-xylA质粒使用的含靶序列的DNA片段通过引物gRNA-xylA-S和gRNA-xylA-A的退火制得。制备E.coliHIS1的感受态细胞,先将pREDCas9质粒化转至E.coliHIS1中后,再制备感受态同时将重组片段和pGRB-xylA质粒同时电转至感受态细胞中,于32 ℃培养,待长出单菌落,经菌落PCR鉴定筛选出阳性转化子,再消除pGRB-xylA和pREDCas9质粒,获得菌株E.coliHIS1-1。

表2 用于xylA基因敲除的引物
1.4 培养方法
摇瓶培养:用接种环刮取1环斜面种子接种于装有30 mL种子培养基的500 mL三角瓶中,9层纱布封口,37 ℃,200 r/min振荡培养8 h;按10%接种量接种到装有发酵培养基的500 mL三角瓶中(终体积为30 mL),9层纱布封口,37 ℃,200 r/min振荡培养,发酵过程中通过补加氨水维持pH在7.0~7.2;初始葡萄糖耗尽后,补加质量浓度600 g/L葡萄糖溶液维持发酵进行。
发酵罐培养:取适量无菌水于茄形瓶中,将茄形瓶上的菌体刮下,然后将菌悬液接入种子培养基中,培养过程中通过自动流加质量浓度为250 g/L的氨水,将pH稳定在7.0左右,温度恒定在35 ℃,溶氧在25%~35%,培养至发酵液OD600值达10~15。按照15%~20%接种量接入新鲜的发酵培养基,初始装液量为3 L。发酵过程中通过自动流加250 g/L氨水控制pH稳定在7.0左右,温度维持在35 ℃,溶氧在25%~35%;当溶氧值急速上升时,表明培养基中的葡萄糖耗尽,之后则根据溶氧的变化通过调整补糖速率自动流加质量浓度为800 g/L的糖溶液,维持发酵培养基中的葡萄糖质量浓度不超过3 g/L。
1.5 检测方法
利用紫外分光光度计测量发酵液在600 nm 处的吸光度(OD600)表征生物量;采用SBA-40E系列生物传感分析仪测定发酵液中葡萄糖浓度;采用高效液相色谱法(high performance liquid chromatography,HPLC)对发酵液中木糖浓度进行定量分析:所用仪器为岛津液相色谱仪(SHIMADZU LC-20AT),色谱柱为Aminex®HPX-87H色谱柱(7.8 mm×30 0mm),检测器为RID-20A检测器,流动相为5 mmol/L H2SO4溶液,流速为1 mL/min;采用Sykam S-433D氨基酸分析仪检测发酵液中L-组氨酸浓度,具体检测按照厂商提供的标准操作流程进行。
1.6 数据分析方法
发酵数据代表3组平行发酵数据的平均值和标准差。利用T检验双尾分布对2组发酵参数进行单向方差分析。
2 结果与分析
2.1 木糖添加量对L-组氨酸发酵的影响
诱导剂浓度是影响诱导效果的一个重要因素,诱导剂浓度太低起不到诱导作用,而浓度太高可能导致目标基因表达强度过大,蛋白合成耗费的资源以及局部反应过强造成的代谢失衡,会限制菌体生长,影响产物的最终产量,对细胞有毒性的诱导剂如IPTG更需关注其使用量。本研究为了验证木糖添加量对E.coliHIS1L-组氨酸发酵的影响,在摇瓶培养初始时向发酵培养基中分别添加质量浓度为0、 5、10、15和20 g/L的木糖,其中不添加木糖组为对照组。发酵28 h后,检测发酵液的OD600值和L-组氨酸的浓度,结果如图1所示。
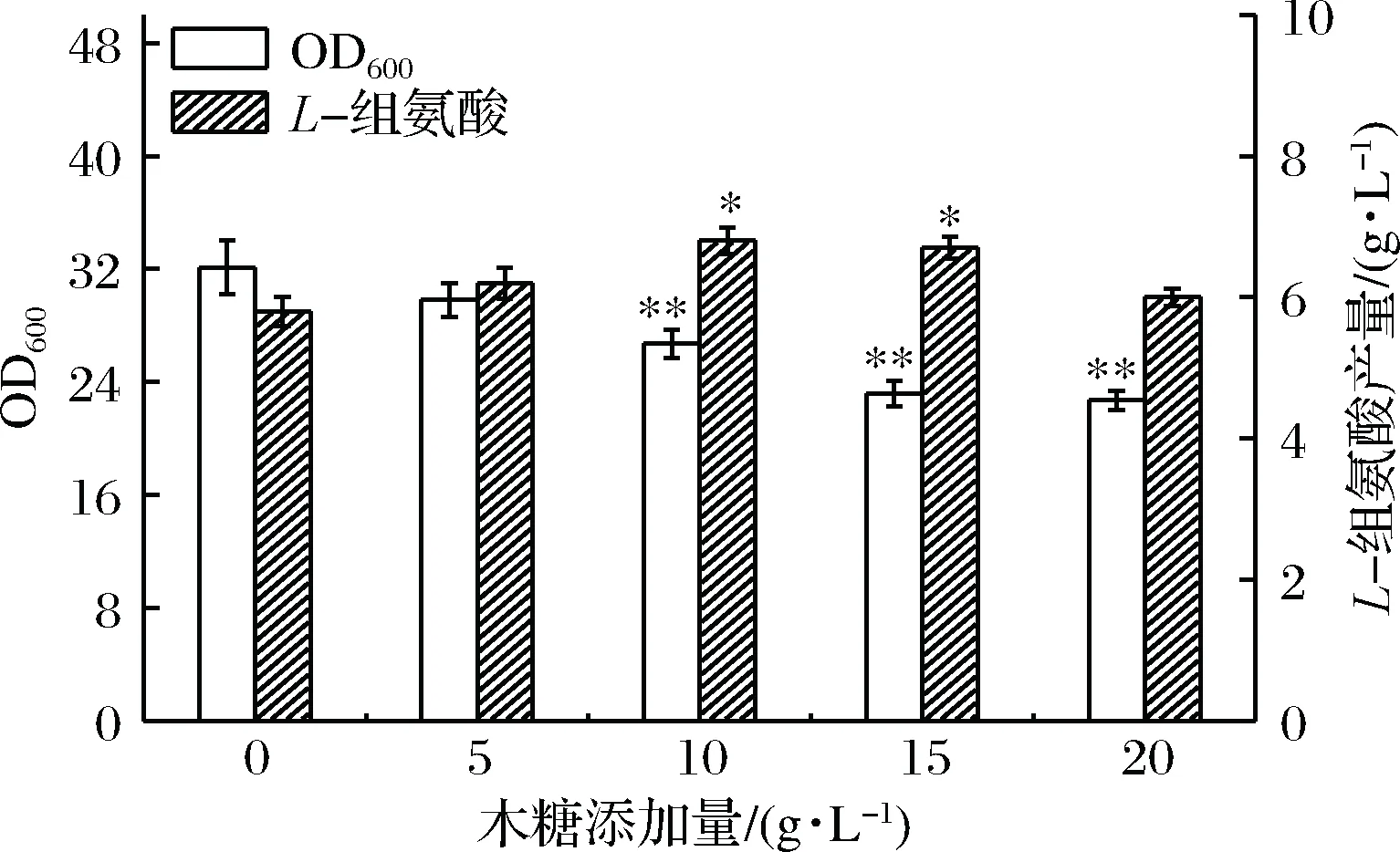
图1 不同木糖添加量对L-组氨酸发酵的影响
由图1可知,随着木糖添加量的增加菌体生长呈现出逐渐降低的趋势;L-组氨酸的产量则是先升高,至木糖添加量为10 g/L时,L-组氨酸的产量最高,木糖添加量进一步提高时,L-组氨酸的产量有降低的趋势。结果表明,在一定范围内,随着木糖添加量的增加,菌体L-组氨酸的生产能力逐步提升,另外,不添加木糖时,菌体也可积累组氨酸,说明木糖诱导系统并不严谨,存在渗漏表达。但是随着木糖添加量的增大,菌体生长所受的抑制作用也越来越明显,影响最终L-组氨酸的产量,原因在于增大木糖浓度后,诱导作用加强,关键酶过量表达,占用了细胞大量资源,L-组氨酸的合成也是一个十分耗能的过程,造成菌体生长受限。总体来讲,较佳的木糖添加量为10 g/L,此时L-组氨酸的产量为7.2 g/L,相较不添加木糖时,L-组氨酸的产量提高了24%,OD600值降低了16.8%。
2.2 诱导时间对L-组氨酸发酵的影响
鉴于诱导剂木糖的添加会同时影响L-组氨酸的积累和菌体生长,因此选择一个较佳的诱导时间,更好地协调L-组氨酸的生成和菌体生长,将有利于最终L-组氨酸的产量提升。于是通过发酵罐发酵方法对木糖的添加时间进行了优化。在发酵初始、8、16、24 h分别添加10 g/L的木糖,不添加木糖作为对照实验,发酵60 h后,5种发酵条件下菌体生长曲线和L-组氨酸的产量对比情况如图2所示。
由图2-B可知,在实验条件下,不管何时添加木糖诱导,L-组氨酸最终的产量普遍高于对照组,说明木糖诱导后,进一步促进了关键酶HisG*的表达,有利于L-组氨酸的生产,其中8 h添加木糖效果最好,L-组氨酸的最高产量可达38.1 g/L,较对照组(28.2 g/L)提高了35.1%。但是由图2-A可知,过早添加木糖会降低菌体生长速率,使最终生物量降低,特别是在0 h添加木糖后,发酵过程中的最高OD600值只有43,相比对照组的58,降低了25.9%,这也体现出L-组氨酸的合成与细胞生长的竞争关系。而过晚添加木糖(24 h),虽然避免了对菌体生长的影响作用,但是诱导效果受到影响,最终L-组氨酸的产量虽比不添加木糖时提高了17.8%,但是比8 h添加木糖时要低13.1%。值得注意的是,糖代谢转录抑制因子的编码基因mlc突变,使得葡萄糖效应解除[19],加之发酵过程中的葡萄糖质量浓度较低,基本上处于“零残糖”状态,因此所添加的木糖会被逐渐消耗。对发酵过程中木糖质量浓度的检测结果也显示(如图2-C所示,将添加木糖的时刻记为0),早期添加木糖时因为生物量低,菌活力不足,消耗的较慢,后期添加木糖时,木糖消耗速率较快,总体看来所添加的10 g/L木糖会在6~10 h耗尽。

A-生长曲线;B-L-组氨酸生产曲线;C-木糖质量浓度曲线图2 不同发酵时期添加木糖对L-组氨酸发酵的影响
2.3 木糖间隔补加或阻断木糖代谢对L-组氨酸发酵的影响
发酵过程中随着木糖的消耗,会导致HisG*的表达强度逐渐减弱。本研究通过2种方法维持发酵液中的木糖质量浓度,以保持诱导条件的相对稳定:一种是增加木糖的添加次数,另外一种方法便是敲除木糖异构酶的编码基因xylA阻断木糖代谢途径,构建了菌株HIS1-1,用于L-组氨酸的发酵。xylA基因敲除时重组片段的构建和阳性菌鉴定的电泳图如图3所示,其中上游同源臂长400 bp,下游同源臂长500 bp,重组片段长900 bp, 菌落PCR鉴定时,原菌片段长1 600 bp,阳性菌片段长900 bp。电泳图显示xylA基因敲除成功。
HIS1和HIS1-1发酵罐发酵结果如图4所示,其中HIS1发酵过程中,除了8 h添加10 g/L木糖外,每当发酵液中木糖质量浓度低于2 g/L时,便补加10 g/L,在实际的操作过程中基本上保持在每8 h添加1次木糖;HIS1-1的发酵过程中只在8 h添加10 g/L木糖;对照组所用菌株为HIS1,发酵时同样只在8 h添加10 g/L木糖。结果显示,3组实验中葡萄糖的消耗速率大致相同(图4-A)。从菌体生长趋势上看,3组实验中,对照组的菌体生长速率相对更快(图4-B)。另外,敲除xlyA基因或多次添加木糖后,L-组氨酸的产量分别提高至43.3 g/L和48.2 g/L,相较于对照组的38.1 g/L,分别提高了13.6%和26.5%(图4-C)。而多次添加木糖对L-组氨酸发酵的促进作用明显优于xlyA基因的敲除,说明木糖不仅通过诱导关键酶表达促进L-组氨酸的合成,木糖代谢也是有利于L-组氨酸的合成。这是因为在大肠杆菌中,木糖可通过木糖异构酶作用形成木酮糖并随后在木酮糖激酶的催化下形成木酮糖-5-磷酸进入戊糖磷酸途径(pentose phosphate pathway,HMP)[25],也就是说HMP是木糖代谢的必经途径,L-组氨酸合成的重要前体物5-磷酸核糖-1-焦磷酸(5-phosphoribosyl-1-pyrophosphate,PRPP)则是HMP的衍生物。而大肠杆菌细胞中葡萄糖经HMP代谢占比较小,因此相对于葡萄糖,通过木糖代谢更有利于提高L-组氨酸合成前体物PRPP的供应。
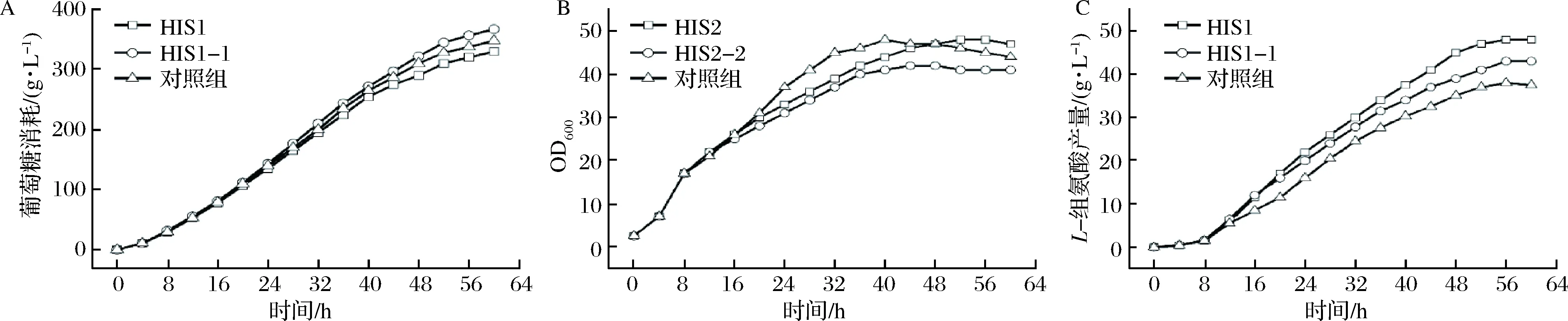
A-葡萄糖消耗曲线;B-生长曲线;C-L-组氨酸生产曲线图4 木糖多次添加或xylA基因的敲除对L-组氨酸发酵的影响
2.4 木糖连续补料对L-组氨酸发酵的影响
在前述L-组氨酸的发酵过程中,木糖多次添加虽然可保证发酵液中始终存在木糖,以诱导HisG*的表达,但是木糖质量浓度变化较大(0~12 g/L),诱导条件仍不稳定。然而结果已经表明木糖同时作为诱导剂和碳源可显著促进L-组氨酸的生产。整个发酵过程中木糖消耗速率在1~2 g/(L·h),同葡萄糖消耗速率的比值约在1∶4~1∶7。为维持木糖质量浓度,采取同时连续流加木糖和葡萄糖的方式进行L-组氨酸的发酵,其中流加所用的糖液参考葡萄糖和木糖的消耗速率进行配比,共分为4组进行比较:流加糖溶液的质量浓度仍为800 g/L,而糖溶液中木糖(xylose)和葡萄糖(glucose)的质量比(X∶G)分别为1∶4、1∶5、1∶6、1∶7,发酵结果如图5所示。
由图5可知,在实验条件范围内,随着流加糖中木糖比例的升高,菌体的生长呈现逐渐减慢的趋势,但是区别并不明显(图5-B);而L-组氨酸的产量则随着流加糖中木糖比例的升高逐渐提升(图5-C)。当流加木糖和葡萄糖的质量比为1∶5的混合糖液时可以维持发酵液中木糖质量浓度在8.5~12.5 g/L,流加糖中木糖的比例太高,木糖来不及消耗,所以发酵液中木糖质量浓度会逐渐增大;流加糖中木糖比例太低则又会造成木糖的质量浓度逐渐降低,影响诱导效果(图5-A)。
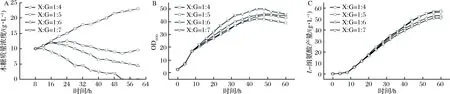
A-木糖质量浓度曲线;B-生长曲线;C-L-组氨酸生产曲线图5 流加糖溶液中木糖和葡萄糖的质量比对L-组氨酸发酵的影响
另外,本研究还对HIS1纯葡萄糖发酵,HIS1-1发酵(发酵8 h时添加10 g/L木糖,木糖只作为诱导剂)和HIS1木糖葡萄糖共发酵(X∶G=1∶5)3种发酵方式总体的耗糖和L-组氨酸产量进行了比较,结果如表3所示。HIS1-1发酵和HIS1纯葡萄糖发酵结果的不同主要是由于木糖的诱导作用带来的;HIS1木糖葡萄糖共发酵与HIS1纯葡萄糖发酵结果的不同是木糖同时作为诱导剂和碳源综合作用的结果;而HIS1-1发酵(阻断了木糖代谢途径)和HIS1木糖葡萄糖共发酵结果的差异,则主要是由木糖作为碳源,参与L-组氨酸的合成造成的。如果将木糖和葡萄糖共发酵时葡萄糖至L-组氨酸的转化率按照HIS1-1发酵时的转化率来算(11.7%),消耗320 g/L的葡萄糖可生产37.4 g/L的L-组氨酸,余下的19.1 g/L的L-组氨酸则来源于73 g/L的木糖代谢,经核算,木糖到L-组氨酸的转化率竟高达26.2%,是葡萄糖的2.2倍,切实说明木糖代谢更利于L-组氨酸的合成。总体看来,木糖和葡萄糖共发酵(X∶G=1∶5)可以使HIS1的L-组氨酸产量由纯葡萄糖发酵的28.2 g/L提高至56.5 g/L,产量提高了1倍,总的糖酸转化率提高了77.8%。
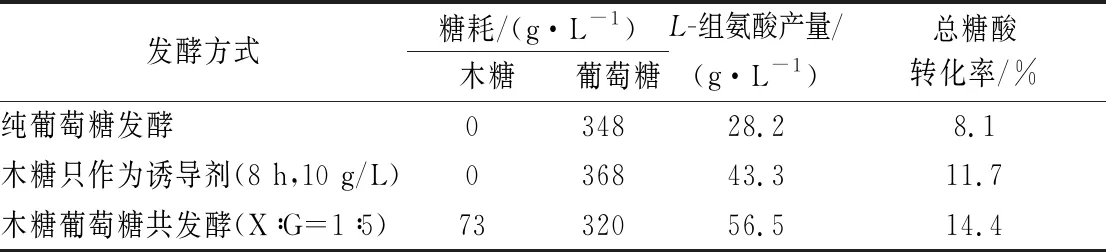
表3 不同发酵工艺L-组氨酸产量和耗糖情况
3 结论
为促进E.coliHIS1中组氨酸合成关键酶HisG*的表达,对诱导剂木糖的添加量,添加时间和添加方式进行了优化。过程中发现木糖不仅可以作为诱导剂增强HisG*的转录表达以促进组氨酸的合成,木糖代谢本身也有利于L-组氨酸的合成,于是便提出了一种木糖和葡萄糖共发酵生产L-组氨酸的工艺方案:5 L发酵罐上培养E.coliHIS1,发酵8 h之后添加10 g/L的木糖,发酵过程中流加木糖和葡萄糖质量比为1∶5的糖溶液,最终可发酵生产56.5 g/L的L-组氨酸,是现有报道的最高水平。木糖和葡萄糖共发酵相较于纯葡萄糖发酵L-组氨酸产量提高了1倍,糖酸转化率提高了77.8%,说明木糖同时作为诱导剂和碳源可显著促进L-组氨酸的生产。木糖在细胞中的代谢速率较低,后期可通过强化菌种的木糖代谢途径,以提高细胞的木糖代谢能力,有望进一步提高L-组氨酸的发酵效率。

