甲基丙烯酸酐化明胶水凝胶介导的骨髓间充质干细胞增强肩袖损伤后愈合的研究
CHEONG Sou San(张素珊) 李赟 于贞成 赵丹阳 崔岩 曹怡 韩冬
由急性外伤或慢性退行性病变引起的肩袖损伤在临床较为常见。大多数肩袖损伤发生在肌腱与骨的界面附近,主要表现为肌腱止点处骨骼的矿物质流失和界面纤维软骨的无法再生[1-3]。肩袖具有复杂的解剖结构,使临床治疗肩袖损伤的效果非常有限,恢复肩袖的解剖结构与功能是亟待解决的难题。
肌腱是通过纤维或纤维软骨止点附着在骨上,而肩袖损伤时通常是纤维软骨止点的撕裂[4],而纤维软骨的无法再生成为了肩袖难以愈合的关键问题。近年来,随着对肌腱和骨愈合生物学机制的深入研究,用于加强腱-骨愈合的新的组织工程技术也有了一定发展。骨髓间充质干细胞(Bone marrow-derived mesenchymal stem cells,BMSCs)具有较强的多分化潜能,可能是修复腱-骨界面的理想种子细胞,Ouyang等[5]的研究证明了BMSCs能改善腱-骨止点的愈合。此外,应用BMSCs治疗肩袖损伤的实验表明,软组织和骨之间整体的接触区域是愈合的主要决定因素[6],提高接触区域的面积也是当前的研究热点。甲基丙烯酸酐化明胶(Gelatin methacrylate,GelMA)是一种光敏性生物水凝胶材料,具有良好的生物相容性,能为干细胞提供类似于天然细胞外基质的生长环境,并具有快速成胶性,可有效包裹大量细胞,故成为了一种优良的细胞载体。另外,GelMA来源广泛,液体形式可填充各种结构的缺损,对于复杂的肩袖结构,能达到提升整体愈合接触面的目的[7-9]。因此,GelMA水凝胶是一种理想的组织工程材料[10]。为解决肩袖愈合的难题,本研究拟将GelMA包裹具有多种分化潜能的BMSCs后加载至腱-骨损伤界面,观察BMSCs/GelMA水凝胶应用于肩袖损伤后对腱-骨愈合的影响。
1 材料与方法
1.1 试剂及仪器
低糖DMEM培养基、胎牛血清、青霉素-链霉素双抗、0.25%胰蛋白酶、磷酸盐缓冲液(Gibco,美国);大鼠BMSCs成骨、成脂和成软骨诱导分化培养基试剂盒(广州赛业生物科技有限公司);甲基丙烯酸酐化明胶、LAP光引发剂(苏州永沁泉智能设备有限公司);CCK-8试剂盒(Dojindo,日本);活/死细胞双染色试剂盒(KTA1001,武汉Abbkine生物技术公司);Actin-Tracker Green微丝绿色荧光探针(C1033,上海碧云天生物技术有限公司);苏木素-伊红染色试剂盒、Masson三色染色液、改良番红O-固绿软骨染色液(北京索莱宝科技有限公司);PrimeScriptTMRT Master Mix试剂盒、TB Green®Premix Ex TaqTM试剂盒(TaKaRa,日本)。
酶标仪(Synergy H1,BioTek,美国);倒置相差显微镜(TS2,Nikon,日本)、正置光学显微镜(Eclipse E100,Nikon,日本)、激光共聚焦显微镜(ECLIPSE Ti,Nikon,日本);实时定量PCR仪(ABI7500,ABI,美国);生物力学测定仪(Instron,美国)。
1.2 BMSCs分离与培养
实验动物选取近交系Wistar大鼠(上海甲干生物科技有限公司),2周龄,雄性,本研究动物实验均遵守相关实验动物伦理要求。无菌条件下完整取出后肢的股骨和胫骨,剪去骨干两端,冲洗骨髓腔,收集冲洗液至培养皿,加入完全培养基(含10%胎牛血清和1%青霉素-链霉素双抗的低糖DMEM培养基),置于37 ℃、5% CO2、饱和湿度培养箱中静置培养。每3 d换液一次,镜下观察细胞生长情况,达80%聚集后传代。取第2、3代细胞备用。
1.3 克隆形成能力检测
为检测培养细胞是否具有干细胞的自我更新潜能,取第2代培养细胞检测其克隆形成能力。以10个/cm2的细胞密度接种于6孔培养板,加入完全培养基常规培养。第14天时终止培养,镜下观察确认细胞克隆形成,细胞固定后用0.5%w/V结晶紫染色,待干燥后拍照观察细胞集落数。
1.4 三系分化鉴定
取第2代细胞进行三系分化鉴定。成骨分化:按2×104个/孔的细胞密度接种于6孔板,实验组(n=3)加入成骨诱导分化完全培养基,对照组(n=3)使用完全培养基,诱导培养21 d后,加入茜素红染液并镜下观察。成脂分化:以2×104个/孔接种于6孔板,实验组(n=3)加入成脂诱导分化培养基,对照组(n=3)加完全培养基,培养21 d后加入油红O染色,镜下观察。成软骨分化:按2×104个/孔的细胞密度接种于6孔板,实验组(n=3)加入成软骨诱导分化完全培养基,对照组(n=3)加完全培养基,诱导培养21 d后,加入阿利新蓝染液染色,镜下观察。
1.5 构建BMSCs/GelMA水凝胶
先将GelMA冻干粉溶解于PBS溶液中制得10%w/V的工作液,光引发剂Lithium phenyl-2,4,6-trimethylbenzoylphosphinate(LAP)粉末溶解于PBS溶液中制得0.5%w/V的工作液。取第3代BMSCs加入GelMA溶液,使最终细胞密度为1×107个/mL,而GelMA和LAP的终浓度分别为5%w/V和0.1%w/V。吹打混匀后,吸取30 μL含BMSCs的GelMA溶液至圆孔模具中,迅速以405 nm蓝光照射20 s进行光交联固化;成胶后,将BMSCs/GelMA水凝胶小心转移至48孔培养板,加入完全培养基后置于CO2培养箱中。
1.6 BMSCs/GelMA水凝胶的细胞增殖检测
BMSCs/GelMA水凝胶在体外培养1、3、5和7 d时,分别行CCK-8法测定细胞增殖情况。按照培养基∶CCK-8=10∶1的比例,向每孔中加入一定量的CCK-8溶液,孵育4 h后,取10 μL上清液转移至96孔板中,用酶标仪检测450 nm处的光密度。每个时间点样本量为3个。
1.7 BMSCs/GelMA水凝胶的细胞形态检测
微丝绿色荧光探针(Actin-Tracker Green)是结合发绿色荧光FITC的鬼笔环肽溶液。在BMSCs/GelMA水凝胶体外培养第7天时,以4%多聚甲醛固定1 h,再使用Actin-Tracker Green进行细胞骨架内微丝染色,并用激光共聚焦显微镜观察荧光染色情况,以检测GelMA水凝胶中的细胞形态。
1.8 动物实验
选取36只近交系Wistar大鼠(8周,雄性)进行动物实验。实验分为3组(n=12):①BMSCs/GelMA水凝胶组,修复术中加入BMSCs/GelMA水凝胶;②GelMA水凝胶组,修复术中加入GelMA水凝胶;③对照组,仅行修复手术。
手术方法(图1):大鼠麻醉后常规消毒,于肩部外侧切开皮肤,纵行切开三角肌,仔细解剖显露肱骨大结节后即找到冈上肌肌腱止点,锐利刀片切断肌腱止点,并刮除纤维软骨。5-0 PDS线穿过肌腱断端,以23 G针头横行穿过肱骨头形成隧道,缝线穿过针头以通过隧道。缝线打结前,分别于腱-骨止点位置植入BMSCs/GelMA水凝胶或GelMA水凝胶。对照组无植入材料,直接打结固定肌腱断端于肱骨头处。最后逐层缝合以关闭切口。术后大鼠前肢活动不受限,手术切口每日消毒护理。术后2、4周时各取材6只进行相关检测。

图1 肩袖撕裂动物模型手术示意图(黑色实线箭头为冈上肌肌腱,白色箭头为被针头穿过的肱骨头,黑色虚线箭头为打结前放置的GelMA材料)Fig. 1 The animal model for rotator cuff tears and surgical repair procedure (The supraspinatus tendon indicated by the black solid arrow; The needle through the humeral head indicated by the white arrow; Implanted GelMA denoted by black dotted arrow)
1.9 腱-骨界面组织学检测
术后4周时,每组取样进行组织学检测(n=4)。完整取下肩袖关节后,除保留冈上肌肌腱,其余肌腱和韧带完全去除,4%多聚甲醛固定后,浸入乙二胺四乙酸二钠溶液中脱钙1个月。脱钙后进行常规脱水和浸蜡包埋,切片(厚度4 μm),HE染色,观察细胞修复和界面愈合情况; Masson三色染色,观察胶原纤维分布情况;番红O-固绿染色,观察修复部位的软骨生成和骨组织形态。
1.10 腱-骨界面相关基因表达检测
以实时定量PCR(Real-time quantitative polymerase chain reactions,qPCR)检测腱-骨界面相关基因的表达。选取的基因为肌腱相关基因Scleraxis(Scx),成骨相关基因runt-relatedtranscriptionfactor2(Runx2),软骨相关基因collagentypeⅡ(Col2)和sex-determiningregionY-box9(Sox9)。根据GenBank序列数据库设计引物(表1)。在术后2周和4周,收集每组的肩袖样本(n=6),保留冈上肌肌腱,去除其余肌腱和韧带,样本以液氮研磨,加入TRIzol裂解液并提取总RNA,使用PrimeScriptTMRT Master Mix逆转录试剂盒将总RNA逆转录为cDNA模板,使用TB Green©Premix Ex TaqTM试剂盒进行目的基因扩增。以GAPDH为内参,计算Scx、Runx2、Col2和Sox9基因的相对表达量。

表1 引物序列Table 1 Primer sequences
1.11 腱-骨界面生物力学检测
在术后4周进行取材(n=6),获取肩袖样本后,保留肱骨和肩胛骨及其上的肌肉,保留冈上肌肌腱,其余肌腱和韧带完全切断,获取标本(图2)。在Instron力学测定仪上,将肱骨与肩胛骨分别以上、下夹具固定,设定预张力0.1 N,逐渐向上拉伸上夹具,直至肌腱完全断裂,记录拉伸过程中肌腱断裂时的最大抗张力。

图2 用于生物力学检测的标本(黑色箭头所指为冈上肌肌腱止点)Fig. 2 Specimen for biomechanical tests (black arrow indicating supraspinatus tendon insertion)
1.12 统计学分析
2 结果
2.1 BMSCs的克隆形成能力与三系分化鉴定
克隆形成能力:提取的细胞体外培养14 d后,结晶紫染色可见皿底部有多个单细胞克隆形成,肉眼可见直径大于2 mm的细胞集落分布(图3)。

图3 第2代BMSCs克隆形成检测结果Fig. 3 Colony-forming analysis of P2 BMSCs
三系分化结果显示:提取细胞经成骨诱导培养并行茜素红染色,肉眼可见橙红色的阳性反应,倒置显微镜下可见橙红色钙结节;成脂诱导并行油红O染色,镜下可见脂滴并显示光亮的圆形脂肪细胞,有的呈现鲜红色串珠状;成软骨诱导培养并行阿利新蓝染色,可见细胞质蓝染(图4)。
2.2 BMSCs/GelMA水凝胶的细胞增殖情况
在体外培养1、3、5和7 d,BMSCs/GelMA水凝胶上清液的OD值分别为0.69±0.01、1.22±0.04、1.34±0.04和1.82±0.10,表明GelMA水凝胶中的细胞在培养的7 d内呈增长趋势,其中第7天比第1天的OD值增加了近3倍(图5)。
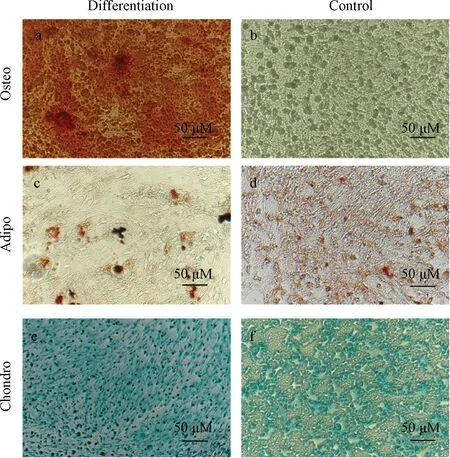
图4 第2代BMSCs的成骨、成脂和成软骨分化Fig. 4 Osteogenic, adipogenic and chondrogenic differentiation of P2 BMSCs

图5 CCK-8检测BMSCs/GelMA水凝胶的细胞增殖情况Fig. 5 Cell proliferation in BMSCs/GelMA hydrogels detected by CCK-8 assay
2.3 BMSCs/GelMA水凝胶的细胞形态
经过7 d体外培养,对BMSCs/GelMA水凝胶进行细胞骨架Actin染色。激光共聚焦显微镜下可观察到包裹于水凝胶中的BMSCs细胞核蓝染(DAPI染色),细胞骨架发出绿色荧光,细胞伸展较好,形态为多态性,多呈单层生长(图6)。

图6 体外培养7 d后BMSCs/GelMA水凝胶的细胞骨架微丝染色(500×)Fig. 6 Actin staining of the BMSCs/GelMA hydrogels after cultured 7 days in vitro (500×)
2.4 腱-骨界面组织学检测
术后4周实验动物切口已痊愈。HE染色显示,与其余两组相比,BMSCs/GelMA水凝胶组纤维软骨生成较多,在10倍镜下观察到软骨生成明显,显示均匀、丰富的纤维软骨细胞分布。术后4周肌腱仍处于修复状态,肌腱组织排列无序紧密。Masson三色染色显示BMSCs/GelMA组和GelMA组均呈现大面积蓝染的胶原纤维组织,表明两组有较丰富的胶原生成和沉积;反之,对照组中蓝染相对弱,表明胶原纤维生成相对少。番红O-固绿染色显示BMSCs/GelMA组与GelMA组红色纤维软骨层清晰可见,表明腱-骨界面之间良好的纤维软骨再生,而对照组红色软骨层较少(图7)。

图7 肩袖切片的组织学染色结果(黑色箭头指向软骨细胞层;白色箭头指向胶原纤维组织层;绿色箭头为处于修复的肌腱)Fig. 7 Histological staining of rotator cuff in cross-section (Black arrows: formation of chondrocytes; White arrows: collagen fibers; Green arrows: tendon being repaired)
2.5 腱-骨界面相关基因表达检测
qPCR检测腱-骨界面相关基因在愈合过程中的表达情况,BMSCs/GelMA组与另外两组相比,Col2的基因表达在术后4周比术后2周高出2倍(P<0.01)。由于术后4周是肩袖损伤后愈合的一个关键时刻,Col2基因在术后4周的表达上调提示了腱-骨界面之间纤维软骨再生能力的提高。此外,在术后2周,与其余两组相比,BMSCs/GelMA组Scx、Runx2和Sox9基因表达水平均有明显增加(P<0.05),说明在肩袖损伤的早期愈合过程中,BMSCs具有潜在的成肌腱、成骨和成软骨分化能力,即具有良好的腱-骨界面修复能力(图8)。

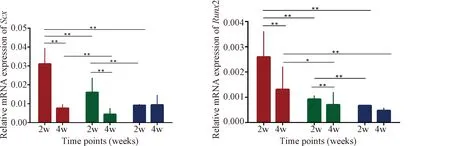
*: P<0.05;**: P<0.01图8 qPCR检测各组肩袖愈合相关基因表达Fig. 8 qPCR demonstrated mRNA expression levels of rotator cuff healing related genes in each group
2.6 腱-骨界面生物力学检测
术后4周,测量3组肩袖腱-骨止点断裂时的最大负荷并进行比较,结果(图9)显示: BMSCs/GelMA水凝胶组的最大负荷为(12.435 ± 2.92) N,GelMA水凝胶组为(11.94 ± 2.93) N,对照组为(12.21 ± 2.66) N,3组间无显著统计学差异(P>0.05)。
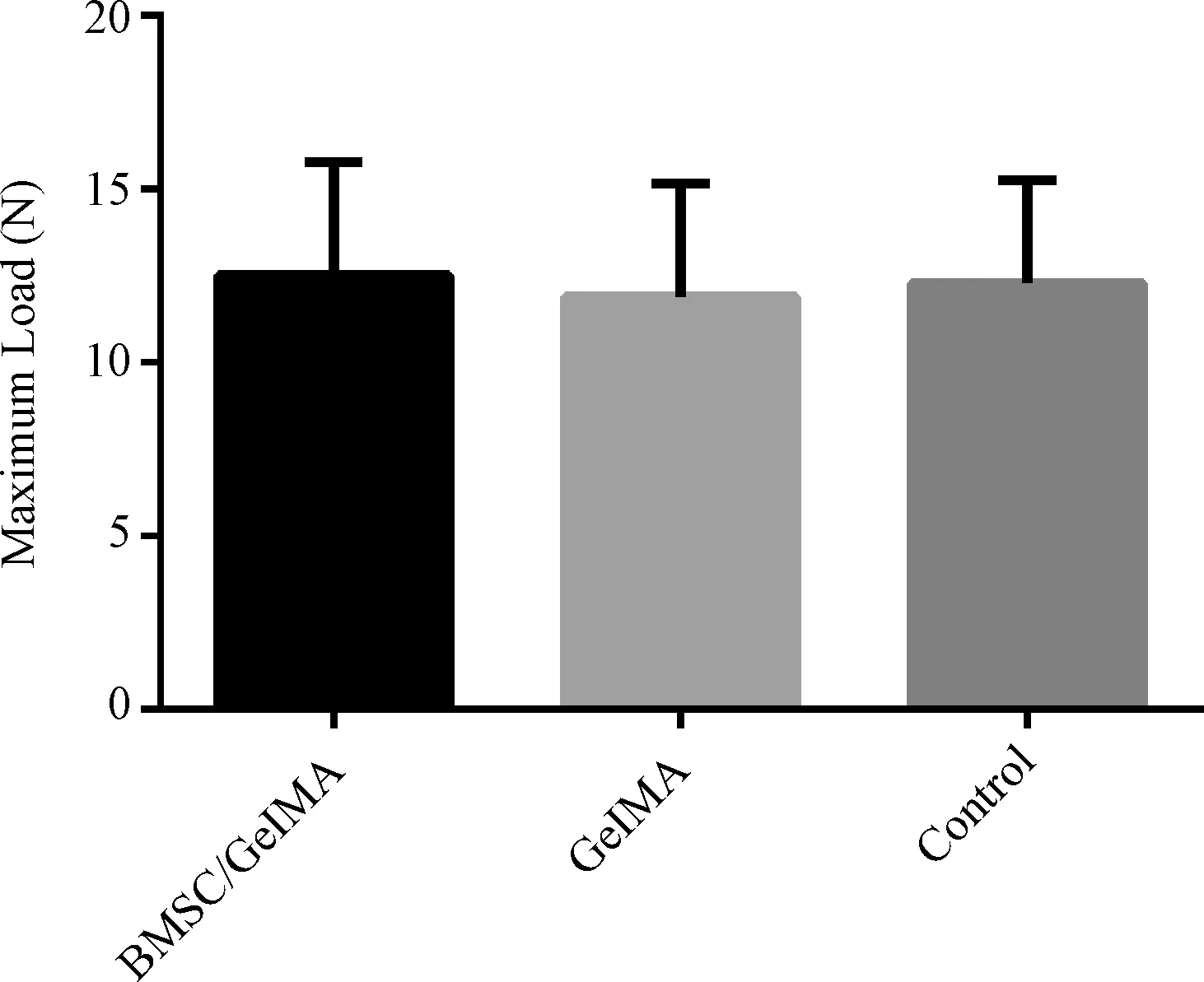
图9 术后4周各组生物力学检测结果Fig. 9 Results of biomechanical tests in each group 4 weeks after operation
3 讨论
由于肩袖多层结构的组织复杂性,肩袖损伤后无法恢复正常分层结构,故难以达到功能性愈合。随着再生医学的快速发展,组织工程技术对解决这一临床难题展现出美好的前景。既往研究表明,肩袖损伤多发生在含纤维软骨的界面上,其治疗目标是防止纤维性瘢痕组织增生和再生纤维软骨层[11]。在细胞治疗中,BMSCs经常被用于加强肩袖愈合,但其治疗效果不显著,分析原因可能是细胞与腱-骨界面的接触面积不足。
本实验利用GelMA包裹BMSCs,并将其植入肩袖损伤模型中,以提高BMSCs与腱-骨界面的接触面积,加大细胞治疗的细胞量。结果表明,通过GelMA水凝胶介导的BMSCs显示出良好的细胞增殖性和细胞形态,能较好地发挥细胞治疗效果。GelMA水凝胶主要成分为明胶[12],与胶原比较,明胶具有更高的溶解性和更低的抗原性,为细胞生长和组织形成提供了良好的微环境。动物实验中各组指标的检测印证了BMSCs/GelMA水凝胶的植入促进了腱-骨界面愈合能力。生物力学检测中,各组未显示出显著统计学差异,可能由于观察的愈合时间还不够长。
近十余年来,关于细胞与生物材料界面的研究多已转移到微环境三维立体培养模式。GelMA水凝胶固有的生物活性和快速光交联的物理化学特性[13],虽然能快速、有效地将多量细胞转移至体内,但目前GelMA水凝胶的应用受限于其较低的机械强度,可考虑对其加以修饰,以调节各种特性,例如物理强度、化学性质、电导率和孔隙率等[14]。已证实碳纳米管与GelMA复合水凝胶的机械性能可通过控制掺入的碳纳米管的比例进行调整[15]。另外,最新研究发现,一种在隐形眼镜中广泛使用的生物材料聚甲基丙烯酸2-羟乙酯(pHEMA)能以互相穿插技术掺入负载有角膜细胞的GelMA水凝胶以增强其机械性能,体外测试结果显示,载有细胞的GelMA/HEMA角膜基质模型具有合适的机械强度[16]。
综上所述,基于GelMA水凝胶的干细胞治疗方法可有效加强肩袖损伤的愈合,但在将来的工作中,要进一步研究如何提高GelMA的机械性能以提升对肌腱-骨的修复,为临床上组织损伤的治疗提供相关实验基础。

