组织工程产品用种子细胞的质量控制与标准化
韩倩倩 赵君 王苗苗 曲明悦 王春仁 李静莉
【提要】 组织工程产品主要是利用生物学和工程学的原理来构建受损组织的功能性替代品,以恢复、维持或改善组织功能。含细胞成分的组织工程产品在体外构建时离不开载体支架材料与种子细胞的相互调控和配合。种子细胞作为原材料之一,参与体外培养构建产品,同时也转化为组织工程产品的组成成分来发挥作用。组织工程产品构建用种子细胞不同于细胞治疗用干细胞,其作为构建组织工程产品的原材料,在构建过程中细胞本身会发生生物学变化,最终与支架材料形成一个有机的整体。组织工程产品用种子细胞因其独特性,要用专门的视角理顺其质量控制指标,以保证组织工程产品的质量。
器官或组织的损伤或功能缺损是人类健康中最常见、最具破坏性且代价最高的问题之一。组织工程产品是应用生物学和工程学的原理来开发恢复、维持或替代组织器官的产品,成为组织器官缺损治疗的希望。组织工程产品在体外构建时,离不开载体支架与种子细胞的相互调控和配合。组织工程用细胞作为原材料之一,参与体外培养构建产品,同时也转化为组织工程产品的组成成分来发挥作用。其中,如何获得可以提供所需功能的种子细胞或细胞替代品是利用组织工程学构建和创造新组织的重要环节[1]。本文参照ISO 18362Manufactureofcell-basedhealthcareproducts[2]、《GB/T 36988-2018组织工程用人源组织操作规范指南》[3]、《中国药典》[4]、《药品生产质量管理规范》[5]等指导文件,对组织工程产品用种子细胞的质量控制指标进行综述,分别对细胞供体的样本准入要求、细胞的采集及加工要求、关键生产物料的质控要求、细胞库建设的指导要求及与支架材料共培养结束后的放行检验等环节进行总结。
1 细胞供体的准入要求
根据《中国药典》(2015版)三部 《生物制品生产检定用动物细胞基质制备及检定规程》中规定,细胞系/株应具有细胞系/株来源的相关资料:①细胞系/株制备机构的名称,细胞系/株来源的种属、年龄、性别和健康状况的资料,这些资料最好从细胞来源实验室获得,也可引用正式发表文献;②人源细胞系/株须具有细胞系/株的组织或器官来源、种族及地域来源、年龄、性别及生理状况的相关资料;③动物来源的细胞系/株须具有动物种属、种系、饲养条件、组织或器官来源、地域来源、年龄、性别、病原体检测结果及供体的一般生理状况的相关资料;④如采用已建株的细胞系/株,应从具有一定资质的细胞保藏中心获取细胞,且应提供该细胞在保藏中心的详细传代过程,包括培养过程中所使用的原材料的相关信息,具有细胞来源的证明资料。
1.1 供体筛查的基本要求
根据GB/T 36988-2018《组织工程用人源组织操作规范指南》,通过供体筛查和供体检测结果确定供体资质是否合格,负责签署分发的负责人应判定并记录细胞或组织供体的合格性。只有符合下列条件的供体才能成为合格的供体。①无可传播性病原体或疾病感染的临床证据;②无因异种移植而产生传染性疾病的风险;③可传播性病原体检测结果为阴性或无反应性。除供体资质确定豁免特例之外,所有供体均应进行筛查,主要是通过审核供体的医疗记录来分析可能存在的风险。
1.2 供体检测的基本要求
供体检测总的要求是尽可能地降低传染性疾病的危险性,检测试验室应对供体样本的传播性病原体进行检测。如果供体年龄小于1个月,则应检测其母亲样本。应在获取供体细胞或组织时对供体样本进行检测,如果在获取细胞或组织时不能取样进行检测,则应在获取前或获取后7 d内采集样本进行检测。如果供者仅提供外周血干细胞/祖细胞,在获取细胞前采集样本检测的时间最多不得超过30 d。检测实验室应使用国家食品药品监督管理部门签发批准的、明确用于血源筛查的试剂,并且应按照试剂生产企业的说明书进行操作。一旦国家批准了新的病原体的筛查试剂或针对尸体检测的试剂,则检测实验室应使用这些新批准的试剂。检测试验室应具有相应的检测资质。
为尽可能地降低传染性疾病的危险性,应对所有的细胞或组织供体的样本进行下列可传播性病原体的检测:人免疫缺陷病毒Ⅰ型(HIV-Ⅰ)、人免疫缺陷病毒Ⅱ型(HIV-Ⅱ)、乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、梅毒螺旋体。
为降低可传播性病原体的风险,对于活的含白细胞的细胞或组织供体样本,还应检测与细胞相关的可传播性病原体,包括人T-淋巴细胞白血病病毒Ⅰ型(HTLV-Ⅰ)、人T-淋巴细胞白血病病毒Ⅱ型(HTLV-Ⅱ)、人巨细胞病毒(HCMV)。
对于硬脑膜供体,应对可传播性海绵状脑炎病毒进行充分评价。
由于人类对病原体的认识在不断更新,而且新的病原体不断出现,一旦有充分的数据证明某种病原体可通过人源细胞/组织传播并严重危害人类健康,则应増加这种新型可传播性病原体的检测,病毒的检测应采用最为敏感的检测方法。
2 细胞的采集及加工要求
生产单位或机构应建立细胞或组织的采集程序,包括设施、环境控制、设备、物料和试剂、标签管理、贮存、人源细胞/组织的接收、发运前运输与发运。细胞或组织的采集单位应使用不会产生污染或交叉污染的方法采集细胞或组织。评估所有与采集相关的操作,包括技术程序、人员、设备、物料和试剂以及采集样本运送程序等,以确定这些操作活动能够控制污染和交叉污染。细胞或组织采集应采用无菌技术,不应从有感染的身体部位采集。
细胞或组织采集前应确认并记录供体身份。对非活体供体,宜通过核对授权文件和/或医疗记录的身份证号码、年龄、性别、种族及体质量等信息确认,并对文件或记录照相保存。对活体供体,宜通过问询供者姓名、身份证号码等确认供者,并详细记录身份核对的方法及结果,问询时间及问询者姓名等。
采集过程应有详细的记录,人源细胞/组织的生产单位或机构应定期审计采集单位的记录并确认供体身份,以确保供体记录与人源细胞/组织确为同一供体。同时在活体供体采集过程中,应对造成或可能造成活体供体伤害的任何不良事件以及原因的调查结果记录进行审查。
生产单位或机构应建立并维护规范的、涉及生产全过程的操作程序,确保加工过程不造成污染或交叉污染,并防止传染性疾病的引入、传染及传播的风险。
3 关键生产物料的质控要求
根据原材料对产品质量的影响程度、原材料的来源、生产以及对产品潜在的污染风险,结合《中国药典》(2015版)的要求,按风险进行分级管理。DMEM/F12培养基、胎牛血清、胰蛋白酶按第4级进行严格的质量控制,其他按照1、2级进行管理(表1、2)。
4 细胞库的建设
细胞库的建立可为生物制品的生产提供已标定好的、细胞质量相同的、能持续稳定传代的细胞种子。
4.1 原材料的选择
细胞培养液中不得使用人血清,如需使用人血白蛋白,则须使用有批准文号的合格制品。
消化细胞用的胰蛋白酶应进行检测,证明其无细菌、真菌、支原体或病毒污染。特别应检测胰蛋白酶来源的动物可能携带的病毒,如细小病毒等。
用于生物制品生产的培养物中不得使用青霉素或β-内酰胺(β-Lactam)类抗生素。配制各种溶液的化学药品应符合《中国药典》(二部)或其他相关国家标准的要求。

表1 细胞培养过程关键物料材料等级划分及质量标准依据
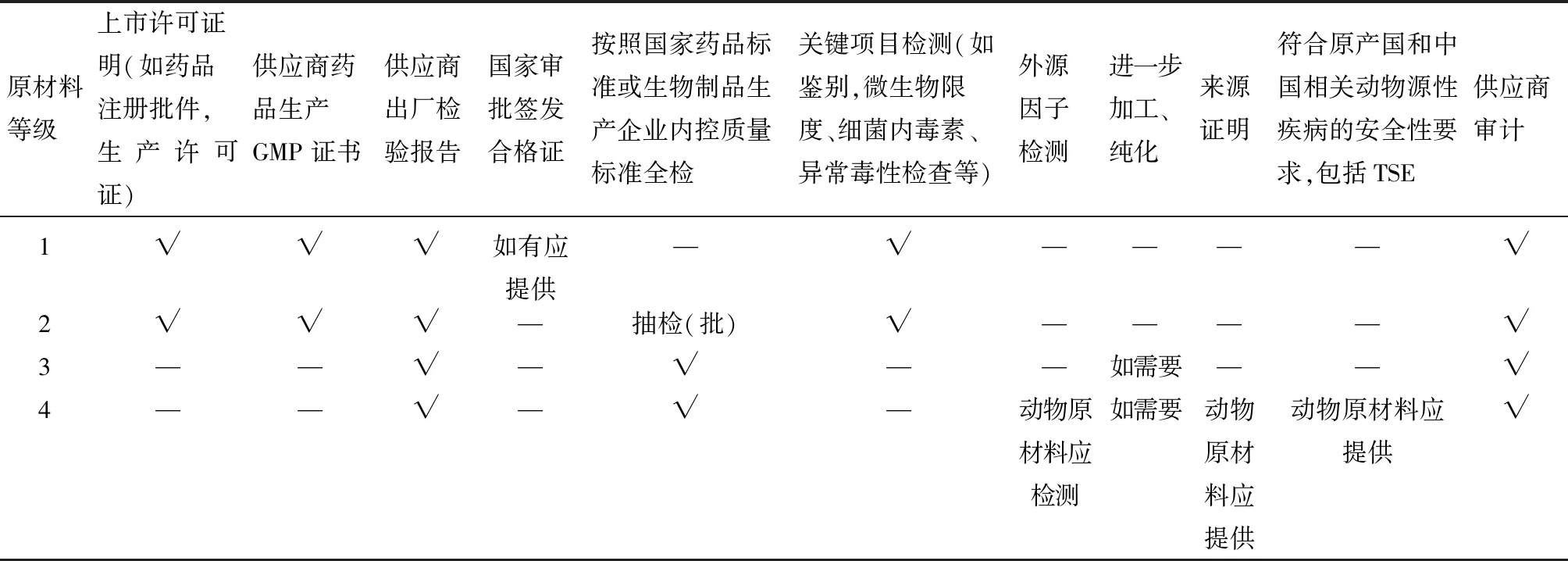
表2 不同风险等级生产用原材料的质量控制要求
4.2 细胞操作的环境要求
细胞培养的操作应符合中国《药品生产质量管理规范》的要求。生产人员应定期检查身体。在生产区内不得进行非生产制品用细胞或微生物的操作;在同一工作日进行细胞操作前,不得操作或接触有感染性的微生物或动物。
4.3 人细胞库的建立
细胞库为三级管理,即原始细胞库(PCB)、主细胞库(MCB)及工作细胞库(WCB)。如为引进的细胞,可采用主细胞库和工作细胞库组成的二级细胞库管理。在某些特殊情况下,也可使用主细胞库一级细胞库管理,但须得到国务院药品监督管理部门的批准。
4.3.1原始细胞库
由一个原始细胞群体发展成传代稳定的细胞群体,或经过克隆培养而形成的均一细胞群体,通过检定证明适用于生物制品生产或检定。在特定条件下,将一定数量、成分均一的细胞悬液,定量均匀分装于安瓿,于液氮或-130 ℃以下冻存,即为原始细胞库,供建立主细胞库用。
4.3.2主细胞库
取原始细胞库细胞,通过一定方式进行传代、增殖后均匀混合成一批,定量分装,保存于液氮或-130 ℃以下。这些细胞必须按其特定的质控要求进行全面检定,应合格。主细胞库用于工作细胞的制备,每个生产企业的主细胞库最多不得超过两个细胞代次。
4.3.3工作细胞库
工作细胞库的细胞由主细胞库细胞传代扩增制成。主细胞库的细胞经传代增殖, 达到一定代次水平,制成一批均质细胞悬液,定量分装于安瓿或适宜的细胞冻存管,保存于液氮或-130 ℃以下备用,即为工作细胞库。每个生产企业的工作细胞库必须限定为一个细胞代次。冻存时细胞的传代水平须确保细胞复苏后传代增殖的细胞数量能满足生产一批或一个亚批次制品。复苏后细胞的代次水平应不超过批准的该细胞用于生产的最高限定代次。所制备的工作细胞库必须经检定合格(见4.5“细胞检定”中有关规定)后,方可用于生产。
4.4 细胞库的管理
每种细胞库均应分别建立台帐,记录放置位置、容器编号、分装及冻存数量、取用记录等。细胞库中的每支细胞安瓿或细胞冻存管均应注明细胞系/株名、代次、批号、编号、冻存日期,储存容器的编号等。
冻存前细胞活力应在90%以上,复苏后细胞存活率应不低于85%。冻存后的细胞,应至少行一次复苏培养并连续传代至衰老期,检查不同代次水平的细胞生长情况。
主细胞库和工作细胞库分别存放。非生产用细胞应与生产用细胞严格分开存放。
4.5 细胞检定
细胞检定主要包括细胞鉴别、外源因子和内源因子的检查、致瘤性检查等(表3)。必要时还须进行细胞染色体核型检查。这些检测内容对于主细胞库细胞和工作细胞库细胞及生产限定代次细胞均适用。
细胞库建立后应至少对主细胞库细胞及生产终末细胞进行一次全面检定。每次从主细胞库建立一个新的工作细胞库,均应按规定项目进行检定。
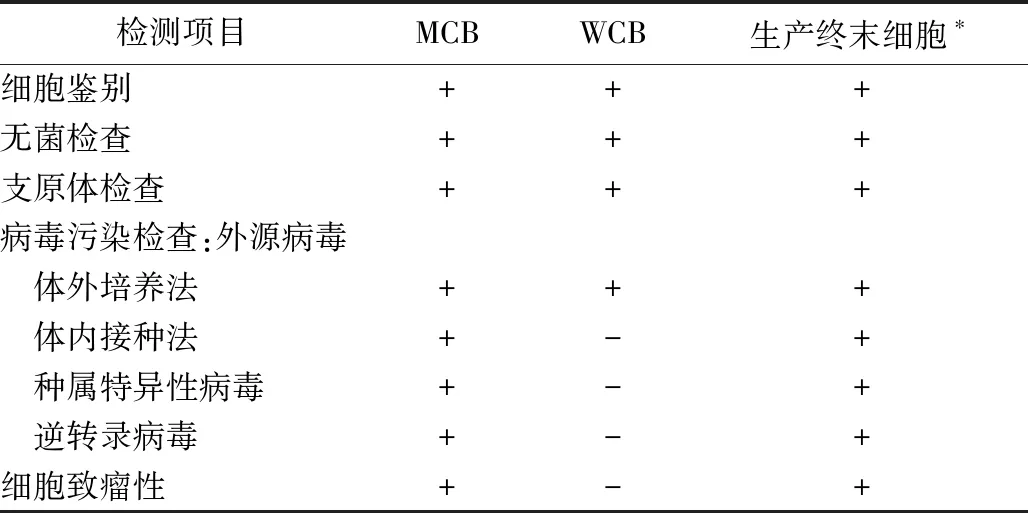
表3 细胞检定项目要求
除考虑安全性指标外,还应充分考虑细胞的功能性指标。如细胞在建库过程中,细胞属性的维持以及细胞功能蛋白的表达水平都是需要考虑的关键指标。
5 与支架共建培养结束后的放行检验
与支架进行共建培养后,对于细胞的放行检验不容忽视。越来越多证据表明,支架对于细胞的微调控作用,会引起细胞发生分化及代谢相关指标的变化。因而,建立合理且可行的放行检验标准是检验组织工程产品有效且安全的保障。然而,鉴于细胞的特殊性,包括培养及储存环境需要无菌,货架期短等,无法如其他医疗器械一样进行放行检验指标的设立。
对于带细胞的组织工程产品的放行检验指标,从有效性角度来说,应至少包括细胞属性标志蛋白与细胞功能蛋白的检测,用以评估终产品中细胞的有效性发挥。安全性角度,应从制剂及无菌两方面进行检验。其中,制剂检测至少包括内毒素检测、抗生素检测及牛血清白蛋白检测等。组织工程产品的活细胞特性决定了货架有效期较短,而常规无菌检查时间长,无法用体外培养法进行无菌检查。“菌落总数检测试纸”快速检验法,15~24 h即可验证无菌,不失为一种理想的放行检验无菌检查方法。
6 总结
组织工程学的三要素是指材料、细胞、生长因子。所以对于组织工程产品而言,细胞/干细胞是极为重要的。组织工程产品制备需要用细胞和生物材料在外部合理的培养环境下,构建能够植入人体进行组织修复与替代的产品。细胞对于组织工程产品既是生产物料,也是产品组成成分。而且还要保持其特有的性能,才能保证植入人体后发挥其生物活性。当然,对于细胞来讲,保证其供体的安全性,操作的规范性至关重要[1]。本文总结了从供体到细胞培养,到质量控制的基本指标。组织工程产品多样,细胞来源也多样,生产者应该根据自己产品的特点制定质量控制规程,以保证产品的安全性和有效性。

