苦豆碱对PDGF-BB诱导的人肺动脉平滑肌细胞增殖的抗氧化作用
吴玉华,李 娜,李 静,陆 彪,周 茹
肺动脉高压(PAH)是一种复发率高、死亡率高的心血管疾病,该病被认为是“假恶性肿瘤”[1]。目前治疗肺动脉高压的药物,其长期有效性亟待提高。本课题组前期研究了苦豆碱可对抗野百合碱诱导的肺动脉高压,其机制可能与抗氧化作用有关[2]。本研究以人肺动脉平滑肌细胞(HPASMCs)为研究对象,血小板源性生长因子BB(PDGF-BB)刺激建立HPASMCs增殖模型,探索苦豆碱对HPASMCs增殖的抑制作用与其抗氧化作用之间的关系,为未来苦豆碱用于治疗肺动脉高压患者提供更多依据。
1 资料与方法
1.1 一般资料:人肺动脉平滑肌细胞(HPASMCs),购自上海中乔新舟生物科技有限公司。
1.2 实验药品与试剂:苦豆碱购自沈阳都顺制药有限公司,药品纯度≥99%;超氧化物歧化酶(SOD)、丙二醛(MDA)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)、总抗氧能力(T-AOC) 检测试剂盒均购自南京健成生物工程研究所有限公司。
1.3 实验仪器:细胞超净台(安泰有限公司)、恒温培养箱(Thermo Scinentific公司)、台式离心机(西门子公司)、长酶标仪(热点公司)、低温高速离心机(Bio-RAD公司)。
1.4 实验方法
1.4.1 HPASMCs复苏:将装有细胞的冻存管从液氮中取出,放入37 ℃的水浴箱中匀速震动,在1 min内溶化,然后把冻存管消毒后,把冻存液移至离心管中,离心弃上清液,然后向细胞沉淀中加入新鲜培养基,混合均匀,将细胞混悬液移入细胞培育瓶中。以上操作均在细胞超净台中进行,然后把培育瓶放置在37 ℃培养箱中进行培育,标记复苏时间以及细胞代数。
1.4.2 HPASMCs培养:本实验所使用的耗材及器械均需要进行高压灭菌,然后放置在细胞超净台内,用酒精和紫外线灯照射消毒实验区域。配制人肺动脉平滑肌细胞培养基,向平滑肌细胞培养基SMCM中加入2%胎牛血清、0.5%生长因子和0.5%双抗,混合均匀,保存在4 ℃冰箱。使用配制的完全培养基培养HPASMCs,在37 ℃、5% CO2条件下培养24 h 后,观察HPASMCs生长情况。HPASMCs正常情况下为贴壁生长,吸出培养基,用预冷PBS冲洗未贴壁细胞,更换新鲜培养基,继续培养。
1.4.3 HPASMCs造模及分组:将细胞培养于100 mm的培养皿中,当融合达90%时,向正常组细胞皿中加入新鲜培养基作为正常对照组,继续培养48 h。向其余4组每个培养皿中加入5 mL含有20 ng/mL PDGF-BB的新鲜培养基,共同放入5% CO2、37 ℃培养箱中培养24 h,使用CCK-8验证细胞增殖后,确认HPASMCs增殖模型的建立。选取其中一组增殖模型组为阳性对照组,其余3组加入含有浓度0.125 mM、0.25 mM、0.5 mM苦豆碱的培养基培养24 h,作为药物干预组。
1.4.4 使用SOD、CAT、GSH-Px、MDA 以及T-AOC试剂盒检测细胞内氧化水平:从细胞培养箱中取出各组细胞,弃旧培养基,使用预冷的PBS冲洗1遍,胰酶消化细胞,然后转移至新的离心管中,4 ℃ 1 000 转/min离10 min,弃上清液。往细胞沉淀中,加入1 mL预冷的PBS混悬,再次离心。按说明书配制细胞裂解液裂解细胞,离心2次后,弃上清液。向沉淀的HPASMCs中加入200μl细胞裂解液,混匀放置在摇床上,在4 ℃条件下震荡30 min。充分裂解后的HPASMCs,在4 ℃ 20 000 转/min 离心5 min。弃沉淀,谨慎吸取上清液,将其移入新的离心管中,做好标记放入-80 ℃冰箱保存。按照氧化检测试剂盒说明书的步骤分别加入样本和试剂,旋涡混匀,37 ℃孵育,加入显色剂,室温静置10 min,在550 nm波长下检测。实验结束后,分析处理数据。
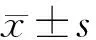
2 结果
2.1 苦豆碱对PDGF-BB刺激人肺动脉平滑肌细胞增殖模型中SOD、GSH-Px、T-AOC水平的影响:细胞经PDGF-BB刺激后,与正常对照组HPASMCs比较,模型组中SOD、GSH-Px、T-AOC水平显著降低(P<0.05);经过0.125 mM、0.25 mM、0.5 mM的苦豆碱干预后肺动脉平滑肌细胞中SOD、GSH-Px、T-AOC水平均有不同程度的升高(P<0.05),见表1。
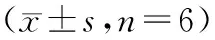
表1 不同组苦豆碱对SOD、GSH-Px、T-AOC水平比较
2.2 苦豆碱对PDGF-BB刺激人肺动脉平滑肌细胞增殖模型中MDA、CAT水平的影响:HPASMCs经PDGF-BB刺激后,阳性对照组中MDA水平显著升高,CAT水平降低(P<0.05);经过0.125 mM、0.25 mM、0.5 mM的苦豆碱干预后肺动脉平滑肌细胞中MDA水平降低(P<0.05),CAT水平有不同程度的升高(P<0.05),见表2。
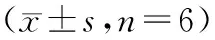
表2 不同组苦豆碱对MDA、CAT水平的比较
3 讨论
肺动脉高压(PAH)主要特点是限制肺动脉循环流动,静息时动脉压≥25 mmHg,移动时≥30 mmHg。肺血管阻力和压力的升高,引发右心肥大和衰竭,最终导致死亡[3]。研究表明,PAH的主要病理表现为肺血管收缩以及重塑。目前已经知道肺血管重塑的关键因素是肺动脉平滑肌细胞(PASMCs)的增殖和肥大、非肌型动脉肌化以及细胞凋亡被抑制共同作用导致的,其中PASMCs的增殖和凋亡失衡在PAH的形成和发展过程中起重要作用[4]。肺血管重塑引起的肺中小动脉管腔狭窄甚至阻塞是在多种病理改变共同作用下造成的,肺中小动脉PASMCs异常增殖、细胞外基质沉积增加,大量弹力胶原纤维合成,形成新血管内膜[5]。另一方面,在肺血管的重塑过程中肺中小动脉PASMC在决定肺血管活性以及血管构型,保护血管正常张力等生理状态中处于重要地位。因此,以PASMCs为靶点,抑制其增殖是治疗肺动脉高压的核心方向。
本研究发现,细胞经PDGF-BB刺激后,与正常对照组HPASMCs比较,阳性对照组中SOD、GSH-Px、T-AOC水平显著降低,HPASMCs经PDGF-BB刺激后,阳性对照组中MDA水平显著升高、CAT水平显著降低。说明:①PASMCs的异常增殖与氧化应激关系密切[6];②抗氧化剂、抗氧化酶和活性氧簇(ROS)、促氧化酶(包括NOX)的浓度之间的不平衡[7],是各种生理病理过程以及PAH发病机制中的关键因素[8];③血管壁细胞内皮细胞和平滑肌细胞,都能产生活性氧,打破了血管壁中的氧化-抗氧化平衡系统,导致血管收缩加重,引起平滑肌细胞异常增殖,最终引起血管重塑[9]。有文献报道,体内的ROS可以改变基因表达,修饰蛋白质磷酸化,然后引起相关反应体内磷酸化的表皮生长因子增多,激活了下游细胞外信号调节激酶,诱导血小板和巨噬细胞产生血小板源性生长因子等,从而促进PASMCs的增殖[10]。
本研究结果提示,在PDGF-BB刺激建立的人肺动脉平滑肌细胞增殖模型中,SOD参与了肺动脉高压的发病过程。SOD是清除体内ROS的专一性酶,是活性氧自由基的天敌,与CAT或GSH-Px一起彻底清除体内ROS和H2O2有害物质,维持机体稳定平衡。通过还原反应消除生物体内新陈代谢过程中产生的有害物质[13]。在肺动脉高压患者体内,SOD的活性较正常人显著降低[14]。过氧化氢酶(CAT)是机体内重要的酶清除剂,同样也是生物防御系统中的关键酶,可将体内的过量的H2O2分解为氧气和水,通过除去体内的H2O2保护细胞免受其害[15]。谷胱甘肽过氧化物酶(GSH-Px)是体内一种关键的过氧化物酶,其使用硒作为主要的组分,该酶可将谷胱甘肽转化为氧化型谷胱甘肽。GSH-Px通过还原过氧化物成为羟基化合物,促进H2O2的分解,从而降低过氧化物对细胞膜结构和功能的损害[16]。本研究结果表明,PDGF处理的模型组显著降低了CAT、GSH-Px、T-AOC的浓度,在给予苦豆碱干预后扭转了这些变化。
体内过多的ROS能够作用于细胞膜上的脂质,通过催化花生四烯酸生成丙二醛(MDA)[17]。MDA是过氧化脂链式反应过程中重要的中间产物,它通过与细胞膜上的蛋白结合后导致膜蛋白酶失活、细胞膜通透性增强,最终造成细胞代谢紊乱。当机体内SOD 活性的下降,在金属离子存在的条件下,促使脂质过氧化物催化裂解产生MDA。机体内过量的MDA通过和相关蛋白质产生分子内或分子间的联系,对正常机体细胞造成毒性损伤。在本实验中,我们研究发现增值的HPASMCs在给予苦豆碱干预后其SOD 活性升高,MDA含量减少。
综上所述,氧化应激可通过多种方式参与肺动脉高压的形成与发展。氧化应激与PASMCs的异常增殖密切相关。虽然肺动脉高压发病机制复杂,氧化应激及其信号转导机制也未完全阐明,但在细胞水平上,抗氧化剂可从肺动脉血管重塑过程中中断和清除 ROS 产生的酶系统,从而治疗肺动脉高压,这就为肺动脉高压的治疗提供了全新的方向,也为进一步探讨最佳的抗氧化策略提供了机会。

