软钾镁矾反应转化制备K2SO4 的母液回收利用研究
朱 敏, 陈 杭, 宋兴福, 于建国
(华东理工大学国家盐湖综合利用工程技术研究中心,上海 200237)
作为一种高效硫钾复合肥,硫酸钾是果树、烟草等忌氯经济作物的主要钾肥品种,在农业上具有重要应用价值。目前,国内硫酸钾产品主要包括曼海姆法加工型与资源型两大类[1],其中,曼海姆法[2]以氯化钾和硫酸为原料,通过复分解反应制备硫酸钾产品,副产物HCl 主要采用高温操作以气体形式移除,以提高反应转化率[3]。由于高温酸性操作条件,曼海姆法对工艺设备抗腐蚀性要求高、投资大,且污染严重。近年来,得益于新疆罗布泊、青海一里坪等地天然硫酸镁亚型盐湖的勘探发现及相关技术突破,国内资源型硫酸钾获得了巨大发展。目前,资源型产品占硫酸钾市场总量的比例已超60%[4],成为国内硫酸钾产业发展的重要组成部分。
资源型硫酸钾的生产主要采用软钾镁矾转化法[5],即充分利用资源型矿产特征与多元水盐体系相平衡规律,通过兑卤、晒盐、洗涤、脱水等工序获得软钾镁矾矿与光卤石矿,其中,光卤石矿主要用于制备氯化钾[6],并与软钾镁矾矿进一步反应结晶生产硫酸钾。目前,基于国内西部天然硫酸镁亚型盐湖的资源开发需求,国内科研工作者对软钾镁矾转化生产硫酸钾开展了一系列工艺过程优化研究[7-10],相关研究对新疆、青海等地硫酸钾资源开发形成了有效的技术支撑。但资源型硫酸钾生产工艺技术仍存在进一步的优化提升空间,尤其是软钾镁矾转化过程的钾回收率指标,已有研究结果表明,软钾镁矾反应转化生产硫酸钾的过程中会产生大量残余母液,且残余母液中钾质量分数较高,可达10%以上[11]。因此,回收残余母液中钾元素是进一步提高软钾镁矾转化法中钾回收利用率的关键突破点之一。


针对软钾镁矾反应转化母液的钾资源回收利用,已有的介稳平衡数据仅能提供工艺路线设计参考,无法满足结晶终点精确控制需求。对此,本文在已有相图数据基础上设计了软钾镁矾反应转化残余母液的钾资源结晶回收工艺路线,并以此为基础,采用常压蒸发、减压蒸发、真空蒸发3 种不同结晶方式考察了母液钾资源在不同温度(108、75、35 ℃)下的回收利用过程,围绕蒸发结晶产物的晶体结构、纯度、收率、粒径以及结晶终点的变化规律进行研究,为残余母液钾资源的综合回收利用提供理论依据。
1 实验部分
1.1 原料和试剂
基于残余母液K+, Mg2+//Cl−, S O24−-H2O 体系的基本组成,实验所需原料主要包括氯化钾(分析纯,w≥99.5%,上海泰坦科技有限公司)、硫酸钾(分析纯,w≥99.0%,上海泰坦科技有限公司)、六水合氯化镁(分析纯,w≥98.0%,国药集团化学试剂有限公司)和去离子水(电导率小于 1 μS/cm)。
1.2 测试与表征
在蒸发结晶体系中,分析对象主要包括结晶产物中K+、Mg2+、Cl−和 S O24−的含量及产物的晶体结构、粒径分布,各指标的具体分析如下。
(1)结晶产物中K+、Mg2+、Cl−和 S O24−含量由化学分析法测定。其中,K+含量采用四苯硼钠容量法测定,Mg2+含量采用EDTA 络合滴定法测定,Cl−含量采用硝酸银容量法测定, S O24−含量采用硫酸钡重量法测定。具体步骤可参考GB/T 20406—2017、GB/T 6549—2011 和GB/T 13025.5—2012。
(2)结晶产物的晶体结构采用X 射线多晶衍射仪(XRD,德国布鲁克AXS 公司,D8 Advance 型)表征。具体测试条件为:CuKα,扫描范围10°~80°,角速度为每0.12 s 转0.02°,并采用MDI-Jade-6.0 软件对结晶产物的XRD 谱图进行对比分析。
(3)结晶产物的粒径分布采用马尔文激光粒度测试仪(英国马尔文公司,MASTERSIZE 3000 型)进行分析。测试过程中以乙醇为分散剂防止样品发生团聚,样品加入量以20%遮光度为标准。
1.3 实验步骤
母液常压蒸发、减压蒸发结晶实验装置如图1所示。蒸发结晶在一个预制玻璃夹套反应器内进行,并配套搅拌电机(德国IKA 公司,EUROSTAR 20 型)以强化反应器内部混合,反应器内部溶液温度用水银温度计测定,溶液温度由油浴恒温槽(宁波天恒仪器厂,THY-2015B 型)控制,控温精度为 ± 0.1 K。同时,蒸发结晶过程真空度由装置尾端循环水真空泵(巩义市予华仪器有限公司,SHZ-DⅢ型)控制,以实现减压蒸发操作。为保证实验真空度,真空结晶操作直接采用旋转蒸发仪(上海申生科技有限公司,SENCO R308 型)进行操作,测试结果表明该装置真空度可达0.097 MPa,对应溶液沸点为35 ℃,符合常温蒸发操作需求。
依据前期硫酸钾小试结果和理论计算[13],软钾镁矾反应转化后的残余母液组成为KCl(w=9.0%)、K2SO4(w=7.0%)、MgCl2(w=11.9%),故按此组成模拟母液配制,并取500 g 溶液置于玻璃夹套反应器中。设置油浴温度为150 ℃,依据实验条件开启并调节真空泵至合适真空度,蒸发过程产生的蒸汽经直形冷凝管冷却后流至收集瓶,待蒸发水量达到预先计算终点时,停止蒸发,并迅速进行固液分离。过滤后固体颗粒采用马尔文激光粒度仪测定粒径分布,剩余滤饼放入80 ℃烘箱,待完全干燥后进行化学滴定分析和XRD 表征。
2 结果与讨论
2.1 蒸发结晶工艺路线设计
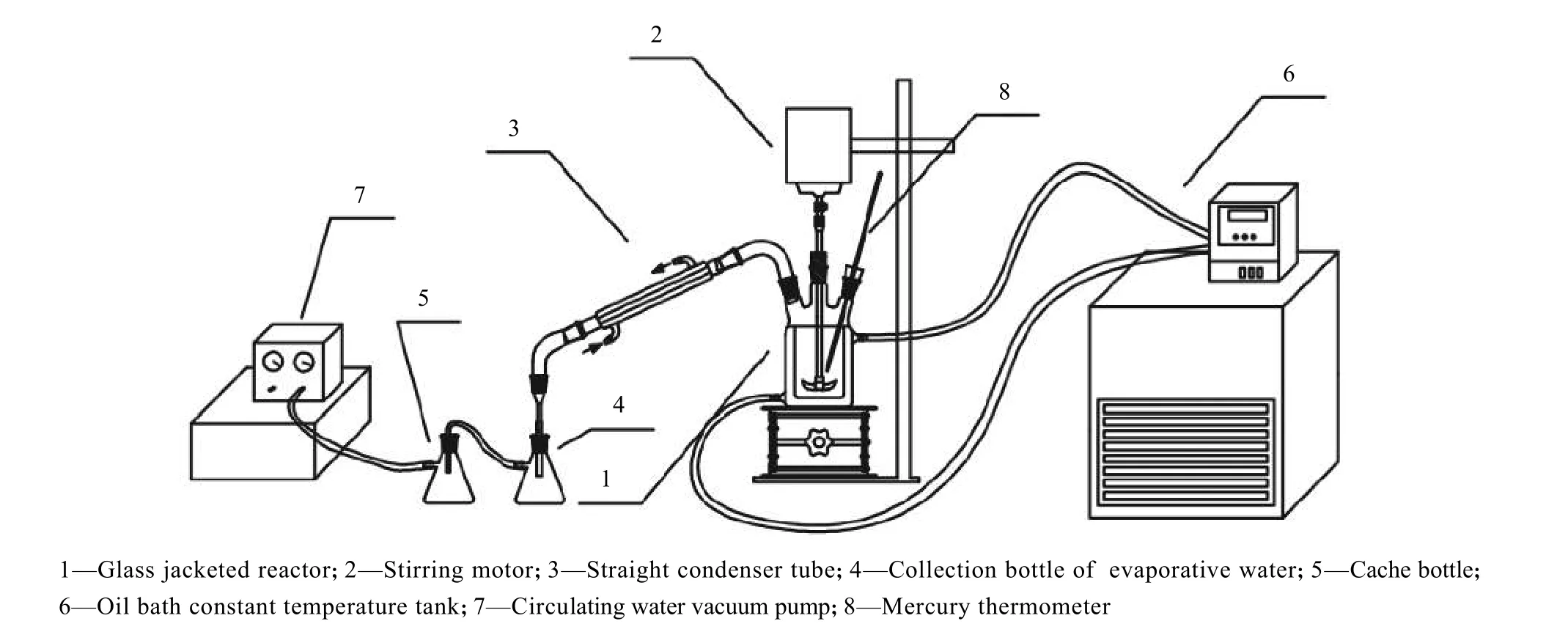
图1 蒸发装置图Fig.1 Evaporation device
由25~100 ℃下K+, Mg2+//Cl−, S O24−-H2O 体 系平衡相图[13,18,27-28]可知,100 ℃下残余母液初始组成位于K2SO4·2MgSO4(无水钾镁矾,Lan)结晶区,35~75 ℃下残余母液初始组成位于KCl 结晶区。基于上述不同温度下的平衡相图差异,以100 ℃和75 ℃相图为例,对其蒸发结晶工艺路线分别进行描述。
温度为100 ℃时平衡相图数据[28]及其蒸发路线如图2 所示(其中J为耶涅克指数),根据残余母液组成,其原料点位于图中M点,因此,100 ℃下母液等温蒸发的钾资源回收过程可分为2 个主要阶段。第1 阶段:Lan 析出,固相为Lan,即固相点在L点保持不动,液相点则由M点逐步移至Lan 与KCl 的共饱和线上的C点。第2 阶段:KCl 和Lan 共析,固相点由L点向K点移动,液相点由C点移动至D点,其中,D点 为KCl、Lan 的 共 饱 和 线 终 点。DM线 与LK线的交点B点表示KCl 与Lan 结晶终点的固相组成。由上述分析可知,100 ℃下母液蒸发结晶工艺路线的产物形式为Lan 和KCl。
温度为75 ℃时平衡相图数据[29-30]如图3 实线所示,根据残余母液组成,其原料点M位于KCl 结晶区,由此,钾资源回收过程可分为2 个主要阶段。第1 阶段:KCl 开始析出,固相为KCl,固相点在K点保持不动,液相点由M点逐步移至C点。第2 阶段:KCl 和K2SO4·MgSO4·4H2O(钾镁矾,Leo)共析,固相点由K点向B点移动,液相点由C点移动到D点,其中,D点为KCl、Leo 和Lan 的共饱和点。DM线与BK线的交点F点表示KCl 与Leo 共析结晶终点的固相组成。由上述分析可知,75 ℃下母液蒸发结晶工艺路线的产物形式为KCl 和Leo。
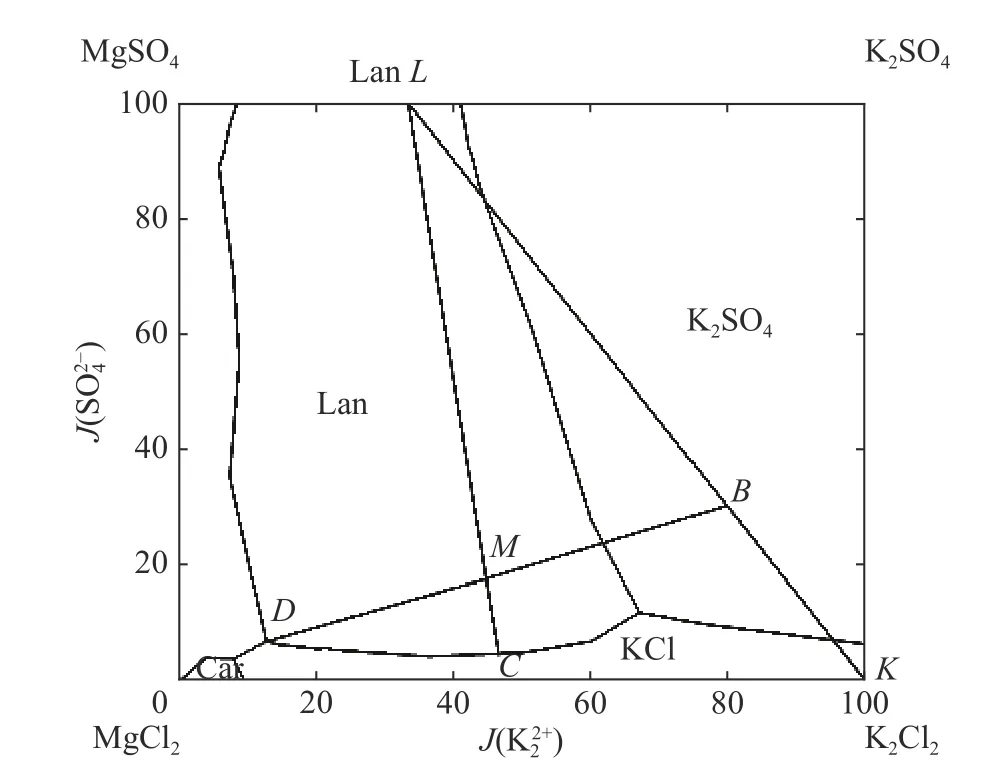
图2 K+,Mg2+ // Cl−, S O24− -H2O 体系100 ℃平衡相图Fig.2 Equilibrium phase diagram of K+, Mg2+ // Cl−, SO24− -H2O at 100 ℃

图3 K+,Mg2+ // Cl−, S O24− -H2O 体系75 ℃相图Fig.3 Phase diagram of K+, Mg2+ // Cl−, S O24− -H2O at 75 ℃
图3 同时示出了75 ℃时K+, Mg2+//Cl−, SO24−-H2O 体系的介稳平衡(如虚线所示),对比于相平衡结果可知,介稳条件下KCl 结晶区明显变大,并导致其蒸发结晶产物发生明显改变。第1 阶段:KCl 开始析出,固相为KCl,液相点由M点到平衡相图C点后继续移动直至P点,氯化钾结晶量明显增加。第2 阶段:结晶产物由平衡相图时的KCl 和Leo 转变为介 稳 相 图 下 的KCl 和KCl·MgSO4·2.75H2O(钾 盐 镁矾,Kai),固相点由K点向A点移动,液相点由P点移动到Q点,其中,Q点为KCl、Kai 和Car 的共饱和点。相应的结晶终点的固相组成由F点移至E点。由此可知,体系介稳平衡特征对于软钾镁矾反应转化母液的钾资源回收利用存在决定性的影响。
如前所述,目前对于K+, Mg2+//Cl−, S O24−-H2O体系仅有50 ℃和75 ℃条件下的介稳相图报道[25,29-30],相关介稳平衡基础数据不足。本文考察了不同温度(108、75、35 ℃)下的钾资源回收利用过程,以明晰不同温度介稳条件下钾资源回收利用的蒸发结晶终点变化规律,为实际工业结晶过程的精细化控制提供依据。
2.2 常压蒸发工艺
首先分析了常压蒸发结晶操作下残余母液的钾资源回收利用,常压蒸发过程中实际沸点为108 ℃,为便于将理论水蒸发量与实际水蒸发量进行比对,理论计算过程参照100 ℃下的平衡相图。依据100 ℃下K+, Mg2+//Cl−, S O24−-H2O 体 系 平 衡 计 算 可 知,Lan 与KCl 结晶析出终点时水的理论蒸发量(以每千克母液计)分别为220 g、260 g,相对应的钾回收率理论值分别为5%和86%。据此,考察了500 g 母液中水蒸发量分别为150、170、190、210、230、250 g时的结晶产物,并系统分析相应结晶产物的组成与粒径变化规律。
2.2.1 结晶产物组成分析 对不同水蒸发量(500 g母液)下的产物进行XRD 表征,结果表明水蒸发量为150~230 g 时结晶产物主要为KCl 和Lan,这与平衡相图理论分析结果一致;当水蒸发量达250 g 时,结晶产物开始出现Car(光卤石,KCl·MgCl2·6H2O)特征峰(图4),即光卤石开始共饱和析出。进一步的结晶产物组成分析结果如表1 所示,相应的产物纯度和收率变化趋势如图5 所示。由表1可知,随水蒸发量的增加,产物中Mg2+含量先减小后增大,K+和Cl−含量则先增大后减小,该结果表明KCl 和Lan 共析时,KCl 结晶量与Lan 结晶量的比值逐渐增加,当后期Car 开始析出时,产物K+含量开始减少,Mg2+含量相应增加。此外,母液沸点随着水蒸发量的增加而逐渐升高,当母液组成接近KCl、Lan、Car 共饱和点时,母液MgCl2浓度及其沸点增加更为显著,即溶液MgCl2浓度与沸点存在明显正相关性[27]。由此,可确定蒸发结晶终点应控制水蒸发量为210 g(500 g母液),即每千克母液中水蒸发量为420 g ,与2.2 节中平衡相图理论计算值(260 g) 相比明显偏高,这主要归因于相转变的滞后性,即介稳状态下体系结晶过程存在明显过饱和度,导致实际蒸发量显著偏高。
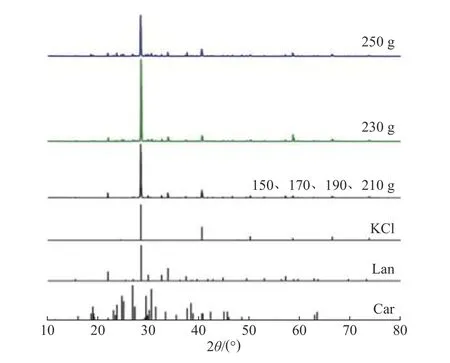
图4 常压蒸发结晶产物的XRD 谱图Fig.4 XRD spectra of evaporation and crystallization product under atmospheric pressure

表1 常压蒸发结晶产物组成(500 g 母液)Table 1 Product compositions of evaporation and crystallization under atmospheric pressure (500 g mother liquor)

图5 常压蒸发结晶产物的纯度和收率Fig.5 Purity and recovery rate of evaporation and crystallization product under atmospheric pressure
2.2.2 结晶产物粒径分析 对于无机资源的结晶回收利用过程,粒径是衡量产物质量的重要指标之一。残余母液中不同水蒸发量下钾资源结晶回收利用的产物粒径变化如图6 所示(图中Dx(50)即中值粒径,反映粒径的变化趋势)。由图可知,随着水蒸发量的增加,结晶产物的粒径整体呈增长趋势。这是由于随着溶液的不断蒸发,其固液比增大,相应的结晶生长面积增加,故过饱和度的消耗速率也相应增加,初级成核逐步减少,晶体粒径则随之增大。大颗粒结晶产物可有效降低固液分离时的母液夹带量,有利于结晶产物的纯度控制。
2.3 减压蒸发工艺
减压蒸发结晶操作的真空度控制在0.075 MPa,则母液沸点稳定为75 ℃左右。依据2.1 节75 ℃时K+, Mg2+//Cl−, S O24−-H2O 体系介稳相图计算可知,残余母液减压蒸发时KCl 将优先析出,其结晶终点理论水蒸发量为400 g (1 000 g 母液),相应的钾回收率约为79%。对此,实验分别考察了500 g 母液中水蒸发量为170、190、210、230 、250 g 时的结晶产物,以确定实际蒸发结晶控制终点,并与介稳平衡理论计算值进行对比。

图6 常压时水蒸发量对结晶过程的影响:(a)粒径分布;(b)中值粒径Fig.6 Effect of evaporation mass of water on crystallization under atmospheric pressure: (a) Particle size distribution; (b) Median particle size
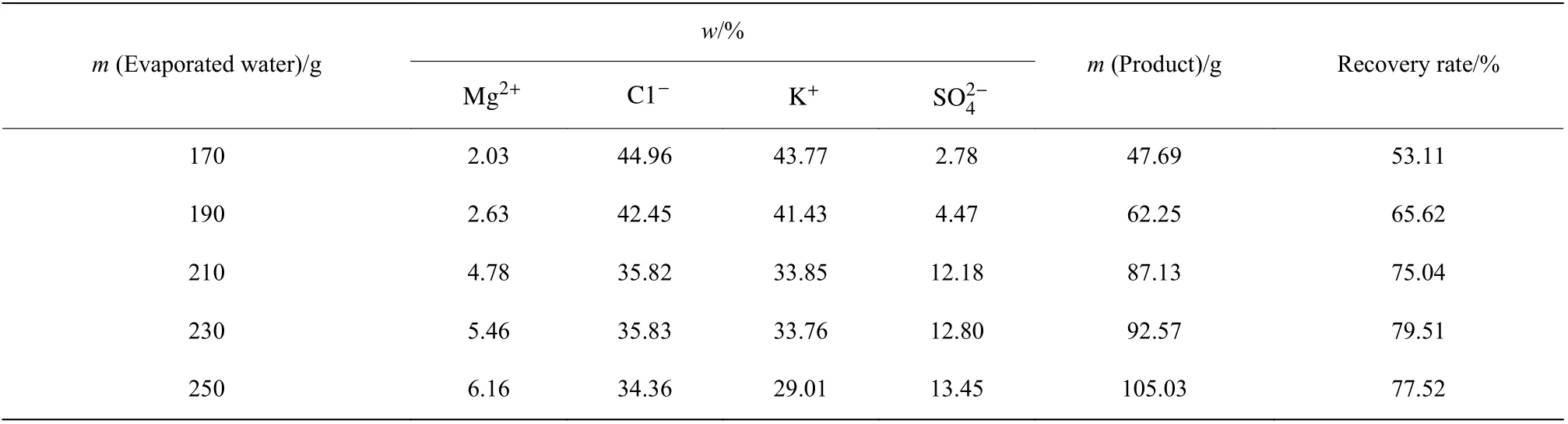
表2 减压蒸发结晶产物组成(500 g 母液)Table 2 Product compositions for evaporation and crystallization under reduced pressure (500 g mother liquor)
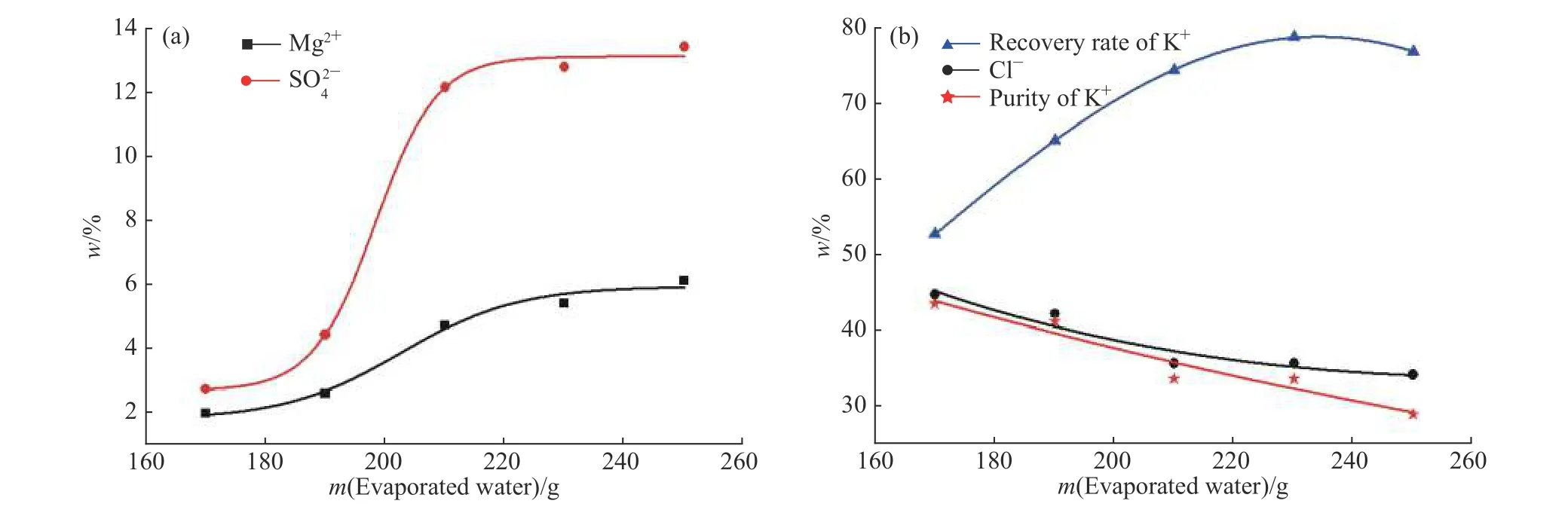
图7 水蒸发量对减压蒸发产物的影响:(a)杂质离子;(b)纯度和收率Fig.7 Effect of evaporation mass of water on evaporated product under reduced pressure: (a) Impurity ion; (b) Purity and recovery rate
2.3.1 结晶产物组成分析 不同水蒸发量条件下的产物组成分析结果如表2 所示,相应的产物纯度和收率变化趋势则如图7 所示。由图可知,随着水蒸发量的增加,产物中Mg2+和 S O24−含量逐渐增大,并且在中间发生了突跃,K+和Cl−含量则逐渐减少。蒸发结晶前期产物中Mg2+和 S O24−含量增加的潜在因素为母液夹带,其增加幅度较小,而水蒸发量为210 g 时,XRD实验分析表明此时Kai 和KCl 开始共析,进而导致产物中Mg2+和 S O24−含量大幅增加,产物纯度急剧下降,这一实验结果与75 ℃时介稳平衡理论计算相一致。综合考虑钾资源回收率及回收产物纯度,可确定75 ℃时母液蒸发结晶终点为190 g H2O(500 g 母液),即380 g H2O/(1 000 g 母液),此时钾回收率为65.62%,产物钾质量分数为41.43%。这一蒸发结晶终点结果与2.3 节中根据介稳相图的理论计算结果(400 g)相接近。
2.3.2 结晶产物粒径分析 残余母液75 ℃时KCl 结晶回收利用的产品粒径变化如图8 所示。由图可知,随着水蒸发量增加,结晶产物的粒径呈增长趋势,这与108 ℃时常压蒸发结晶的实验结果相一致,即随着蒸发结晶过程的进行,结晶生长面积的增加导致溶液过饱和度降低,初级成核减小,粒径相应逐步变大。
2.4 真空蒸发工艺
基于软钾镁矾反应转化残余母液的组成特征,其真空蒸发结晶时的操作温度约为35 ℃。由35 ℃时K+, Mg2+//Cl−, S O24−-H2O 体系平衡相图可知,残余母液初始组成位于KCl 结晶区,并可理论计算获得KCl 结晶回收工段的终点水蒸发量为56 g/(1 000 g母液),相应的钾回收率约为4%,后续蒸发结晶产物则为KCl 和Pic 的混合物。在此基础上考察了500 g母液水蒸发量分别为150、170、210、240、250、260 g时的结晶产物,并进行对比实验研究。

图8 水蒸发量对减压蒸发产物的影响:(a)粒径分布;(b)中值粒径Fig.8 Effect of evaporation mass of water on evaporated products under reduced pressure: (a) Particle size distribution; (b) Median particle size
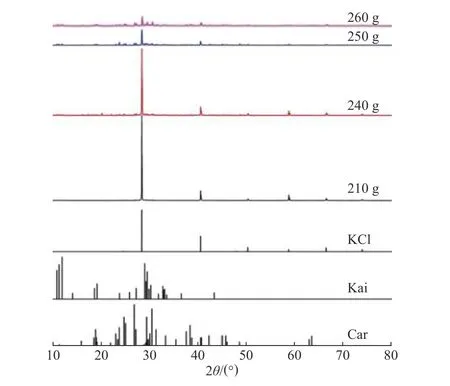
图9 真空蒸发结晶产物的 XRD 谱图Fig.9 XRD spectra of evaporation and crystallization product under vacuum
2.4.1 结晶产物组成分析 如图9 所示,真空蒸发结晶操作时,XRD 分析结果表明其析盐规律为:蒸发前期KCl 优先析出,水蒸发量达240 g 时,蒸发产物转变为KCl 和Kai,当水蒸发量进一步增加至250 g 时,结晶产物中开始出现光卤石Car 的特征峰,这与平衡相图KCl 和Pic 共析的理论计算结果明显不符。进一步分析不同阶段真空蒸发结晶产物组成,其结果如表3 所示,相应的产物纯度和收率变化趋势则如图10 所示。由图可知,随着水蒸发量的增加,Mg2+和SO24−含 量 呈 增 长 趋 势,且 过 程 中 发 生突 跃,K+和Cl−含量逐渐减少,这与75 ℃时产物组成变化规律一致。综合考虑钾资源回收率及已回收产物纯度,回收KCl 资源并避免共析,减少后续操作步骤,可确定35 ℃时母液回收利用的蒸发结晶终点为KCl 工段的结晶终点,相应的水蒸发量为210 g (500 g 母液),即1 000 g 母液时为420 g,回收产物中钾纯度为44.64%,钾资源回收率达78.73%。这与2.4 节中平衡相图56 g /(1 000 g 母液)的理论计算值差异显著。
2.4.2 结晶产物粒径分析 残余母液真空蒸发结晶回收产物的粒径变化规律如图11 所示。由图可知,随着水蒸发量的增加,结晶产物的粒径先增大后减小。前期粒径的增加与前述75 ℃和108 ℃蒸发结晶过程一致,即结晶生长面积的增加促使过饱和度降低,进而使得产物粒径增加;而后期KCl 晶体粒径的降低则主要归因于Kai 和Car 共析后KCl 的溶解过程,导致产物晶体尺寸开始降低。
2.5 工艺实验结果对比分析
综合母液钾资源蒸发结晶回收利用实验结果可知,常压蒸发、减压蒸发、真空蒸发操作工艺存在明显差异。常压蒸发实验时母液析盐顺序以Lan 为先、KCl 为后,其中,Lan 与KCl 结晶终点控制的水蒸发量为420 g (1 000 g 母液),依据100 ℃平衡相图理论计算的析盐顺序与实验结果相同,但结晶终点的计算值(260 g)与实验值相差明显。这主要归因于介稳状态下母液过饱和度的存在,即介稳过饱和度对蒸发结晶的终点控制存在决定性影响。真空蒸发结晶的实验与理论计算对比结果进一步表明,介稳状态过饱和度甚至影响析盐规律的理论分析,35 ℃真空蒸发结晶时,依据平衡相图计算的母液析盐顺序依次为KCl 和Pic,但实际上无机盐结晶顺序为KCl、Kai、Car。上述介稳过饱和度对析盐顺序、结晶终点计算的影响在75 ℃减压蒸发结晶实验中得到进一步确认,该实验的析盐顺序依次为KCl、Kai、Car,这与平衡相图计算的析盐顺序(KCl、Leo、Lan)明显不符,但与其介稳平衡计算结果一致。同时,实验蒸发结晶终点时水蒸发量380 g(1 000 g母液)与75℃介稳相图的理论计算值(400 g)相近。由此可知,介稳过饱和度直接影响蒸发结晶析盐规律与终点控制的理论分析,是蒸发结晶工艺过程设计不可忽视的重要因素。
通过上述实验分析,3 种不同温度的等温蒸发结晶过程可达到母液钾资源回收利用的目的,并均可实现65%以上的钾资源回收率,其相应的实验对比结果如表4 所示。由表可知不同温度相平衡的变化导致原料点所在结晶区不尽相同,从而导致108 ℃常压蒸发时钾资源回收的结晶析盐规律与75、35 ℃时存在明显不同,即108 ℃时原料点位于Lan 结晶区,产物必然为Lan 和KCl 的混合物,影响回收产品的质量,而75、35 ℃时原料点均位于KCl 结晶区,有利于钾资源的回收。依据不同蒸发结晶工艺实验结果,35、75 ℃和108 ℃时钾资源回收率分别为78.73%、65.62%和71.49%,产物的钾质量分数分别为44.64%、41.43%和22.53%,产物纯度随着温度的升高而降低,同时,蒸发结晶过程的能耗总体随操作温度的降低而降低,且盐湖资源富集的西部地区干旱少雨,为常温自然蒸发结晶提供了得天独厚的水文条件。由此,可确定35 ℃真空蒸发结晶工艺为母液钾资源回收利用的最佳工艺路线。
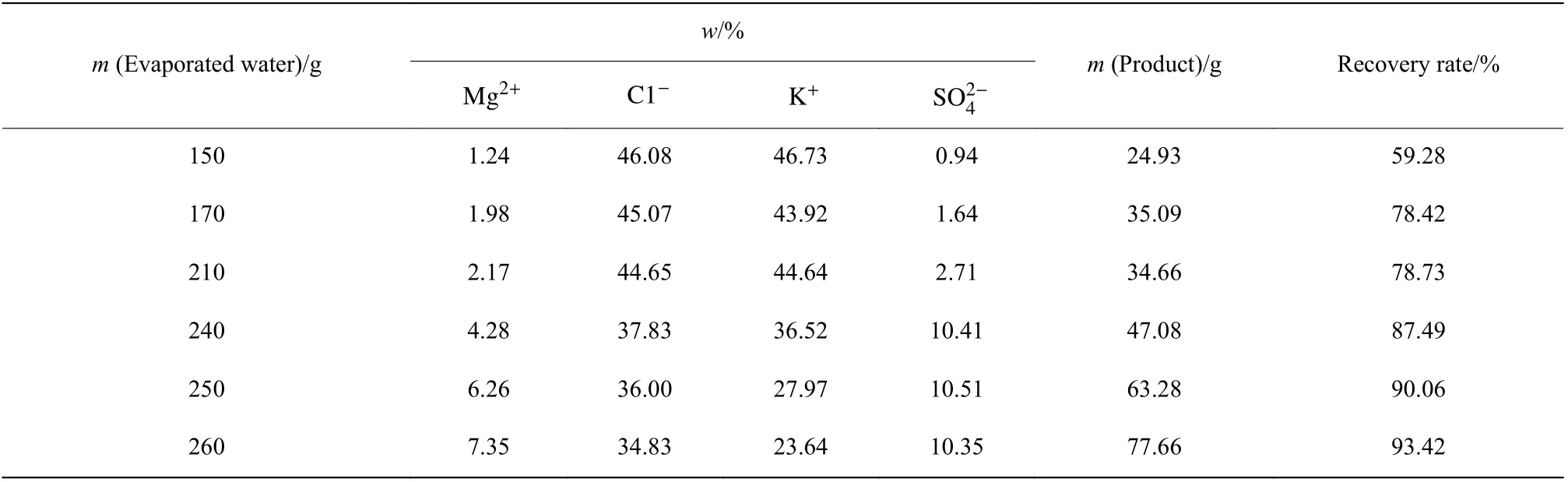
表3 真空蒸发结晶产物组成(500 g 母液)Table 3 Product composition of vacuum evaporation and crystallization (500 g mother liquor)
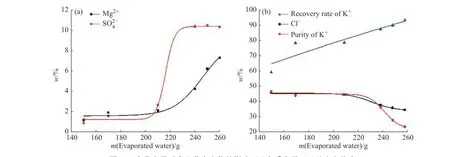
图10 水蒸发量对真空蒸发产物的影响:(a)杂质离子;(b)纯度和收率Fig.10 Effects of evaporation mass of water on vacuum evaporation products: (a) Impurity ion; (b) Purity and recovery rate

图11 水蒸发量对真空蒸发产物的影响: (a) 粒径分布;(b) 中值粒径Fig.11 Effects of evaporation mass of water on vacuum evaporation products: (a) Particle size distribution; (b) Median particle size

表4 不同蒸发工艺结果对比(1 000 g 母液)Table 4 Results comparison of different evaporation processes (1 000 g mother liquor)
3 结 论
以软钾镁矾反应转化制备硫酸钾的残余母液为主要研究对象,分别考察了常压蒸发、减压蒸发、真空蒸发3 种不同蒸发结晶工艺路线条件下的母液钾资源回收利用。结合实验与工艺计算结果可知,108 ℃时蒸发结晶的钾资源回收产品形式以氯化钾和无水钾镁矾为主,而75 ℃和35 ℃时的结晶产物主要为氯化钾;不同温度下蒸发结晶终点的水蒸发量分别为420、380、420 g(1 000 g 母液),这一结果与介稳相图理论计算值相近,但与平衡相图理论计算值存在显著差异,说明介稳过饱和度是蒸发结晶过程终点控制的重要影响因素。综合蒸发结晶过程钾资源回收率及产物纯度两项指标可知,在35 ℃时,其回收率和钾质量分数均达到最高,分别达到78.73%和44.64%,因此,35 ℃真空蒸发结晶是软钾镁矾反应转化母液钾资源回收利用的最佳工艺形式。

