三阴性乳腺癌中FOXC1,HIF-1α及上皮间质转化因子的表达及意义*
牛文露,赵 艳,金 鑫,秦燕子,朱英乔,彭新蕊,周亮亮,张恩迪
[1.蚌埠医学院第一附属医院(蚌埠医学院临床医学院),安徽 蚌埠 233003;2.蚌埠医学院第一附属医院临床病理科(蚌埠医学院病理学教研室); 3.蚌埠医学院第一附属医院肿瘤外科]
乳腺癌是威胁女性健康最常见的恶性肿瘤,近年来,其发病率呈明显上升并年轻化趋势。其中雌激素受体(estrogen receptor,ER)、孕激素受体(progestrone receptor,PR)、人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)表达均为阴性的三阴性乳腺癌(triple negativebreast cancer,TNBC)约占乳腺癌总量的15 %~20 %,因是乳腺癌中侵袭转移能力最强的亚型而备受关注[1]。
上皮间质转化(epithelial-mesenchymal transition, EMT)是指上皮细胞在刺激因素作用下转化成间充质样细胞并伴随明显基因和表型改变的一种多阶段过程。研究表明[2]该过程与肿瘤的侵袭转移相关,表现为细胞间的连接减少或消失,CK、E-cadherin等上皮性表型表达降低,而Vimentin、N-cadherin等间充质表型表达增高。FOXC1 基因作为叉头框( fork head box,FOX)转录因子基因家族中的成员之一,参与了肿瘤的发生和发展过程,对多种恶性肿瘤细胞的增殖、分化、凋亡、转移和侵袭产生重要影响[3]。HIF-1α是实质性肿瘤内部缺氧微环境发挥重要作用的核心转录因子,其活性在肿瘤的能量代谢,血管新生,肿瘤细胞的增殖和转移中起重要作用[4]。研究发现FOXC1可能与HIF-1α起协同作用,影响肿瘤细胞增殖、凋亡及上皮间质转化(EMT)等活动。本研究应用免疫组织化学(Elivision法)检测TNBC标本及正常对照组织中FOXC1,HIF-1α的表达,分析其与患者临床病理参数、EMT相关因子表达的关系,探讨两者在TNBC发生发展及侵袭转移过程中的作用。
1 材料与方法
1.1标本收集 得到伦理委员会批准,收集蚌埠医学院第一附属医院病理科2012年1月至2014年12月三阴性乳腺癌组织标本78例(术前未行放、化疗)进行回顾性研究。所有病例均有完整的临床、病理及随访资料。年龄37岁~85岁,中位年龄为59岁。肿瘤直径< 2cm,32例; ≥2 cm,46例。组织学Ⅰ-Ⅱ级35例,Ⅲ级 43人。淋巴结转移阳性59例,淋巴结转移阴性19例。临床分期AJCC/UICC分期标准(第七版)Ⅰ-Ⅱ期28例,Ⅲ-Ⅳ期50人。从中随机选择30例癌旁正常乳腺组织作为对照。
1.2抗体与试剂 浓缩型兔抗人 FOXC1 多克隆抗体、兔抗人HIF-1α多克隆抗体购自青岛宏达生物技术有限公司,兔抗人E-cadherin单克隆抗体、鼠抗人Vimentin单克隆抗体、二抗及DAB显色剂购自北京中杉金桥生物技术有限公司。
1.3免疫组化染色 将实验所需蜡块经切片、脱蜡、脱苯、水化等处理后,石蜡切片恒温箱中过夜,脱蜡、水化,PBS冲洗,免疫组化经微波抗原修复后滴加抗体按试剂盒说明书操作,中性树胶加盖玻片后封片、晾干。以PBS代替一抗为阴性对照。
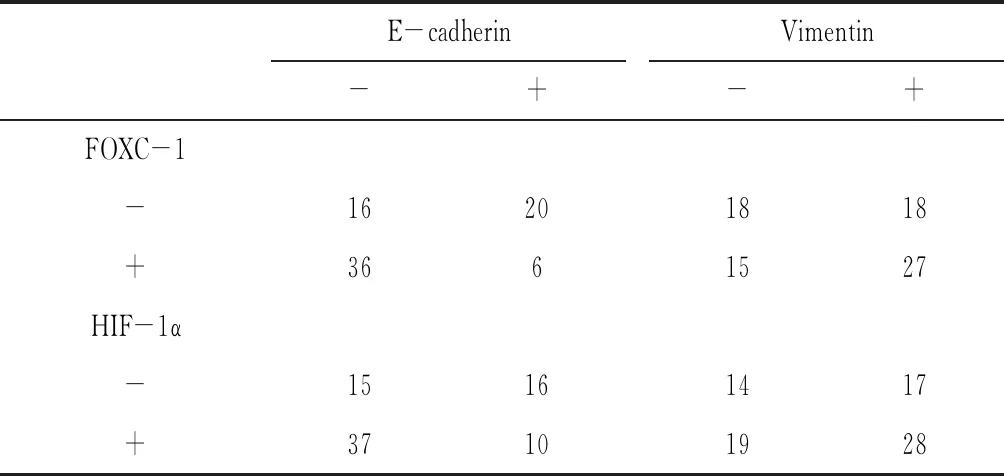
1.4结果判定 FOXC1 蛋白染色主要定位于细胞核,少部分定位于细胞质或细胞膜。HIF-1α以胞浆和胞核中出现清晰的棕褐色颗粒为阳性染色,大部分表达于胞浆。E-cadherin以细胞膜和(或)细胞质内出现棕黄色颗粒为阳性。Vimentin定位于胞浆。高倍镜下随机选取5个视野(每个视野观察细胞数不少于200个),按阳性细胞所占百分比及着色深浅进行结果判定。着色深浅等级为:0=无着色(不表达),1=淡黄色(弱表达),2=棕黄色(中等表达),3=棕褐色(强表达)。阳性细胞所占百分比分为:0 %,<10 %,10 %~<25 %,25 %~<50 %,50 %~75 %或更高。结果判断标准:①依据染色强度判定:无染色计为 0 分,浅棕黄色计为1分,棕黄色计为 2 分,深棕褐色计为 3 分;②根据染色范围来判定:即阳性细胞数 N<5 %计为 0 分,5 % 1.5统计学方法 统计学处理采用SPSS 15.0软件。两样本率的比较采用卡方检验,相关性分析采用Spearman等级相关分析,以P<0. 05为差异有统计学意义。 2.1FOXC1,HIF-1α,E-cadherin及Vimentin蛋白的表达 见图1~图8、表1。78例TNBC中FOXC1,HIF-1α蛋白表达均高于对照组,组间差异有统计学意义(P<0.05)。TNBC组中E-cadherin低表达和Vimentin高表达,与对照组比较差异有统计学意义(P<0.05)。 表1 FOXC-1,HIF-1α,E-cadherin及Vimentin在不同三阴性乳腺癌中的表达 2.2TNBC组织中FOXC1,HIF-1α蛋白表达与EMT相关因子表达的相关性 由表2可见,TNBC组织中FOXC1表达与E-cadherin表达呈负相关(r=-0.317,P<0.05),与Vimentin的表达呈正相关(r=0.364,P<0.05);TNBC组织中HIF-1α表达与E-cadherin表达呈负相关(r=-0.297,P=0.001),与Vimentin表达呈正相关(r=0.316,P=0.014)。 表2 TNBC组织中FOXC1,HIF-1α表达与E-cadherin,Vimentin 表达的关系 2.3FOXC1,HIF-1α蛋白表达与临床病理特征的关系 FOXC1蛋白的表达与TNBC肿瘤的淋巴结转移有关(P<0.05),HIF-1α蛋白的表达与组织学分级及淋巴结转移有关(P<0.05),见表3。 表3 TNBC组织中FOXC1,HIF-1α蛋白的表达与临床病理特征的关系 虽然临床采用以手术为主的综合治疗模式,但证据表明,转移仍是绝大多数三阴性乳腺癌患者治疗失败和死亡的主要原因[5]。由于TNBC组织学分级较差,不表达ER、PR和HER-2,且多伴有p53突变、EGFR的表达,对目前较常用的分子靶向药物不敏感,尽管新辅助化疗有一定反应率,但总体预后仍最差[6]。随着对乳腺癌生物学行为认识的不断深入,如何针对乳腺癌肿瘤细胞表达,而正常细胞很少或不表达的特定基因或表达产物作为靶点进行分子靶向治疗,最大限度地杀伤肿瘤是当今世界研究的难点和热点[7]。因此,迫切需要寻找敏感性好、能早期预测TNBC转移复发并能抑制其增殖和转移的基因治疗靶点,为临床TNBC的复发转移及预后做出早期预测提供依据,从而及时采取更加有效的治疗措施。 FOXC1 基因作为叉头框( fork head box,FOX)转录因子基因家族成员,其遗传突变与胚胎发育异常密切相关,越来越多的研究发现FOXC1可通过多个关键信号通路直接影响乳腺癌肿瘤转移和侵袭[8]。FOXC1可激活NF-κB信号途径促进TNBC细胞增殖,并介导EGF受体的功能[9]。2010年Ray等[10]在以基因图谱分类乳腺癌分子分型中,检测到FOXC1 mRNA在TNBC中的水平明显高于其他各组亚型;此外,在己知ER、PR、HER-2表达状态下,用免疫组化方法分析,发现FOXC1在部分TNBC细胞中呈强染色。我们运用免疫组化方法在78例TNBC石蜡标本中检测FOXC1的表达情况并评价蛋白表达与各临床特征间的相关性。结果显示FOXC1 基因在TNBC组织中的阳性表达率明显高于其在癌旁组织中的阳性表达率,差异具有明显统计学意义(P<0.05)。FOXC1 基因的表达与年龄、肿瘤大小、组织学分级及临床分期无统计学差异而与有无淋巴转移有明显统计学差异(P<0.05),在癌组织中淋巴转移的区域FOXC1 基因的阳性表达率越高。我们推测 FOXC1 基因可能与TNBC的侵袭、转移有关。 缺氧是多数实质性肿瘤内部微环境的重要特征,低氧诱导因子-1(HIF-1)作为低氧依赖的核转录因子,是肿瘤适应低氧环境、克服缺氧这一不利因素的中心,也是肿瘤供氧和供能的中心,参与下游多个靶基因表达的调控,是研究肿瘤低氧状态的重要靶基因[11]。它由HIF-1α和HIF-1β两个亚单位组成,其中HIF-1α既是HIF-1的活性亚基,又是功能亚基,决定了HIF-1的活性,介导细胞对缺氧环境进行适应性反应[12]。Goggins E等[13]研究发现乳腺癌组织中HIF-1α呈高表达,并在肿瘤细胞的定向迁移中起着重要的作用。本实验结果显示在TNBC组织中HIF-1α蛋白的表达远高于在癌旁正常组织,差异具有统计学意义(P<0.05)。推测HIF-1α蛋白与三阴性乳腺癌的发生相关,并且HIF-1α的表达与病理分级、淋巴结转移明显相关,表明HIF-1α高表达与肿瘤的侵袭性相关。 上皮间质转化(epithelial-mesenchymal transition, EMT)在胚胎形成和组织发展过程中发挥作用,但近年来研究更多集中于在恶性肿瘤转移及侵袭过程中扮演的重要角色[14]。上皮-间充质可塑性是指癌细胞易于发生上皮-间充质表型转换的亚稳态性,其大大增强肿瘤的转移和化疗耐受性。EMT相关转录因子Twist、Snail等异常激活可引起细胞基因水平的上皮标志E-钙黏蛋白(E-cadherin)、上皮黏附分子(EpCAM)等缺失和间质标志物波形蛋白(Vimentin)、N-钙黏蛋白(N-cadherin)等过表达,使得上皮性肿瘤的细胞间极性减弱,细胞连接变得疏松导致黏附能力下降,迁移运动能力增加易于转移[15]。因此检测E-cadherin和Vimentin在癌细胞中的表达,有助于了解癌细胞 EMT 的发生及进展。Mani 等[16]研究证实具有迁移侵袭能力的乳腺癌细胞EMT化后获得了干细胞样潜能,产生对化疗药物的耐药性。 通过本实验可见FOXC1和HIF-1α在TNBC的进展中都起到了重要作用,但作用的机制可能存在差异。但可以明确的是两者的表达都与肿瘤的转移密切相关,淋巴结转移是TNBC的一个重要生物学特性。淋巴结转移尤其是结外侵犯不利于局部病灶的控制和患者生存率的改善。在本组TNBC病例中,EMT相关因子E-cadherin明显下调而Vimentin显著上调,并且与FOXC1,HIF-1α蛋白的表达具有相关性,说明FOXC1和HIF-1α在TNBC转移中的作用可能都和上皮间质转化有关。EMT现象的发生可能是促进TNBC侵袭转移的重要途径之一。结合本研究,可认为在三阴性乳腺癌中 EMT 的异常激活提高了细胞生存力,增强其侵袭转移能力,使其对常规治疗更具有抵抗性。这可能也是三阴型乳腺癌易发生转移、化疗后复发率高的原因之一。未来可通过靶向调控FOXC1和HIF-1α基因来降低TNBC的侵袭性,为TNBC的基因靶向治疗创造有利条件。2 结果


3 讨论

