新城疫病毒V蛋白亚细胞定位
阎武勇,谢 鹏,梁健鹏,林秋燕,崔小欣,丁 铲,廖 明,向 斌*,任 涛*
(1.华南农业大学 兽医学院,广东 广州 510000;2.中国农业科学院 上海兽医研究所,上海 200241)
新城疫(Newcastle disease,ND)是一种危害养禽业的病毒性传染病,其病原体新城疫病毒(Newcastle disease virus,NDV)属于副黏病毒科(Paramyxoviridae)禽腮腺炎病毒属(Avulavirus),为单股、负链、有囊膜的RNA病毒[1]。NDV基因组编码NP、P、M、F、HN、L等6种结构蛋白,其中P蛋白基因通过RNA编辑机制在特定位点插入1个鸟嘌呤(G)产生非结构蛋白V蛋白,2种蛋白具有相同的氨基端和不同的羧基端序列[2]。V蛋白羧基端结构域高度保守,含由组氨酸和7个半胱氨酸形成的锌指结构,可与2个锌原子结合成锌指序列,其对V蛋白拮抗干扰素作用极为重要[3]。NDV V蛋白是一种多功能病毒蛋白,能够调控宿主细胞周期和蛋白翻译、影响病毒组织嗜性、促进病毒复制及增强病毒致病性[4-7]。目前,关于V蛋白亚细胞定位的研究较少,其依托的结构基础和生物学意义有待进一步阐明。因此,本试验通过核质分离、Western blot和激光共聚焦等试验,检测了V蛋白在DF-1细胞中的亚细胞定位,结合基因片段缺失和点突变方法分析其结构基础,并初步探索了其亚细胞定位相关序列与V蛋白干扰素拮抗之间的关系,进一步解析了V蛋白结构与功能的联系。
1 材料与方法
1.1 病毒、细胞和质粒本试验所用到的NDV基因Ⅶ型GM毒株(GenBank:DQ486859)由本实验室分离保存;真核表达质粒pEGFP-N1-3×FLAG(简称N1F)、N1F-V以及荧光素酶报告质粒IFN-β-luc由本实验室构建并保存。DF-1细胞系由本实验室保存。
1.2 主要试剂Flag标签抗体、聚肌胞苷酸(poly(I∶C))为Sigma公司产品;细胞核内参Anti-LMNB2 antibody为生工生物工程(上海)股份有限公司产品;细胞质内参Anti-alpha Tubulin antibody为Abcam公司产品;荧光二抗Goat Anti-rabbit IgG/Cy3为博奥森生物技术公司产品;V蛋白特异性抗体由本实验室保存;DMEM、0.25% EDTA胰酶、胎牛血清和LipofectamineTM2000转染试剂均为Gibco公司产品;去内毒素质粒小量提取试剂盒、胶回收试剂盒均为OMEGA公司产品;双荧光素酶报告基因检测试剂盒为Promega公司产品;细胞核蛋白与细胞浆蛋白抽提试剂盒和QuickMutation基因定点突变试剂盒为碧云天公司产品;ClonExpress®ⅡOne Step Cloning Kit为南京诺唯赞生物科技有限公司产品;Western blot所需相关试剂均为北京鼎国昌盛生物技术有限公司产品。
1.3 V蛋白NLS的预测利用cNLS Mapper在线预测工具对新城疫病毒GM株V蛋白ORF序列进行分析,获得3个可能的核定位序列,分别命名为NLS-1、NLS-2和NLS-3(表1)。
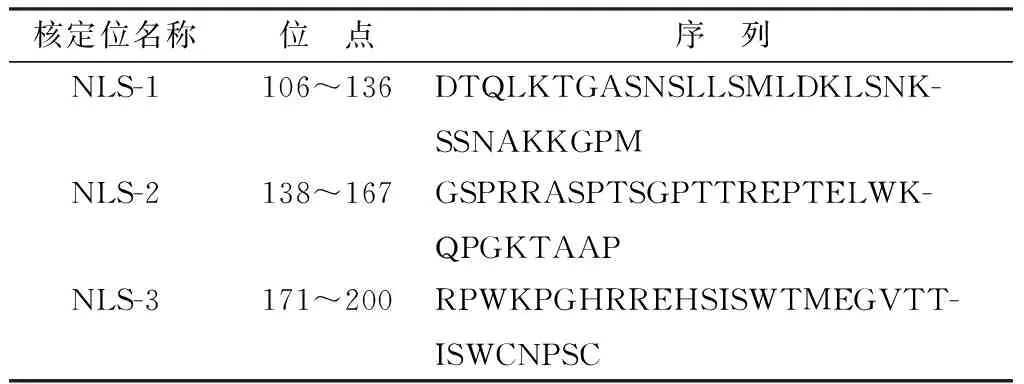
表1 核定位信号序列预测
1.4 V-ΔNLS真核表达质粒的构建将缺失NLS的GM-V序列分成2段扩增,利用同源重组的方法将扩增出的各基因片段重组到表达载体N1F中,再将重组产物转化至DH5α感受态细胞并涂布于含卡那霉素的LB平板上,37℃培养箱倒置培养12~16 h,将菌液PCR鉴定后的阳性菌液送生工生物工程有限公司测序。测序正确后,阳性重组质粒(即缺失型V)分别命名V-ΔNLS1、V-ΔNLS2、V-ΔNLS3。扩增V-ΔNLS引物序列见(表2)。
1.5 核质分离及Western blot检测NDV感染DF-1细胞后V蛋白的亚细胞定位用0.1 MOI 剂量的GM株感染DF-1细胞,收取感染后24 h细胞样品,按照核质分离说明书抽提细胞核蛋白与细胞浆蛋白,并用V蛋白特异性抗体Anti-V(1∶400倍稀释)检测V蛋白的核质分布。
1.6 V蛋白真核表达产物的亚细胞定位
1.6.1激光共聚焦检测V蛋白的核质分布 将真核表达质粒N1F-V转染DF-1细胞,同时设置对照组,24 h后弃掉培养基用预冷PBS洗细胞2遍,4%多聚甲醛室温固定15 min;弃去固定液,PBST洗3次后用0.25% Triton X-100通透5 min;加入5%的BSA溶液室温孵育1 h进行封闭;洗去封闭液后加入1∶1 000倍稀释的一抗Anti-Flag 并37℃孵育2 h; PBST洗3次后加入1∶500倍稀释的荧光二抗Goat Anti-rabbit IgG/Cy3避光孵育30 min;DAPI进行细胞核染色,最后封片并用激光共聚焦显微镜观察V蛋白的亚细胞定位情况。

表2 扩增V-ΔNLS引物序列及长度
1.6.2Western blot检测V蛋白的核质分布 将真核表达质粒N1F-V转染DF-1细胞24 h后,收取样品进行细胞核与细胞质抽提,应用Flag抗体(1∶1 000倍稀释)、核内参Anti-Lamin B2(1∶1 000倍稀释)、质内参Anti-Tubulin(1∶5 000倍稀释)检测V蛋白的分布。
1.7 V-ΔNLS真核表达产物的亚细胞定位将真核表达质粒N1F-V、V-ΔNLS1、V-ΔNLS2、V-ΔNLS3转染DF-1细胞24 h后,收取样品进行细胞核与细胞质抽提,Western blot检测各质粒真核表达产物的分布。
1.8 V-ΔNLS入核关键氨基酸位点的初步探究由于碱性氨基酸在核定位信号中发挥重要作用,所以在引物中引入突变碱基,以N1F-V为模板运用点突变技术将NLS-2中R141、R142、R152、K159以及 NLS-3中R171、K174、R178、R179碱性氨基酸突变为丙氨酸,在同源重组酶作用下将2个片段重组到载体上,最后成功构建出突变型V的真核表达质粒并命名为V2-NLSm和V3-NLSm。将V2-NLSm和V3-NLSm转染DF-1细胞24 h后,运用核质分离及Western blot等技术检测突变型V能否入核。
1.9 NLS对V蛋白拮抗干扰素β功能的影响将N1F、N1F-V、V-ΔNLS1、V-ΔNLS2、V-ΔNLS3和IFN-β-luc、pRL-TK(报告基因质粒∶内参基因质粒=20∶1)转染DF-1细胞,每个样品做3个重复,转染24 h后,用1 mg/L poly(I∶C)分别刺激12,24 h 后收取样品;用预冷的PBS洗涤细胞2次,加入1×PLB裂解液,室温摇床裂解15 min;将裂解物转移到EP管,4℃ 12 000 r/min离心2 min,取上清至新的EP管;每20 μL上清加到100 μL LARII检测试剂,用枪头吹打混匀进行萤火虫荧光素酶活性(RLUS1)的测定;记录读数后,加Stop试剂100 μL,短暂吹打混匀后再次测定海肾荧光素酶数值即内参(RLUS2),用RLUS1/RLUS2数值比较不同样品报告基因的激活程度。
2 结果
2.1 NDV感染DF-1细胞的核质分布以0.1 MOI剂量的GM株感染DF-1细胞24 h,将提取的细胞浆蛋白与细胞核蛋白进行Western blot检测,结果显示NDV感染DF-1细胞后,胞浆蛋白(Cyt)和胞核蛋白(Nuc)中均可检测到V蛋白(图1),表明NDV感染DF-1细胞后,V蛋白在细胞质和细胞核中均有分布。

图1 NDV感染24 h后核质分布 A.Anti-V;B.Anti-Lamin B2;C.Anti-Tubulin
2.2 V真核表达产物的亚细胞定位
2.2.1激光共聚焦检测V蛋白的亚细胞定位 将N1F-V转染DF-1细胞,24 h后进行间接免疫荧光试验,最后用激光共聚焦显微镜观察V的核质分布。红色荧光代表N1F-V,蓝色荧光代表细胞核(图2)。检测结果说明过表达N1F-V 24 h后,V蛋白大部分定位到细胞质,少部分也能定位到细胞核。
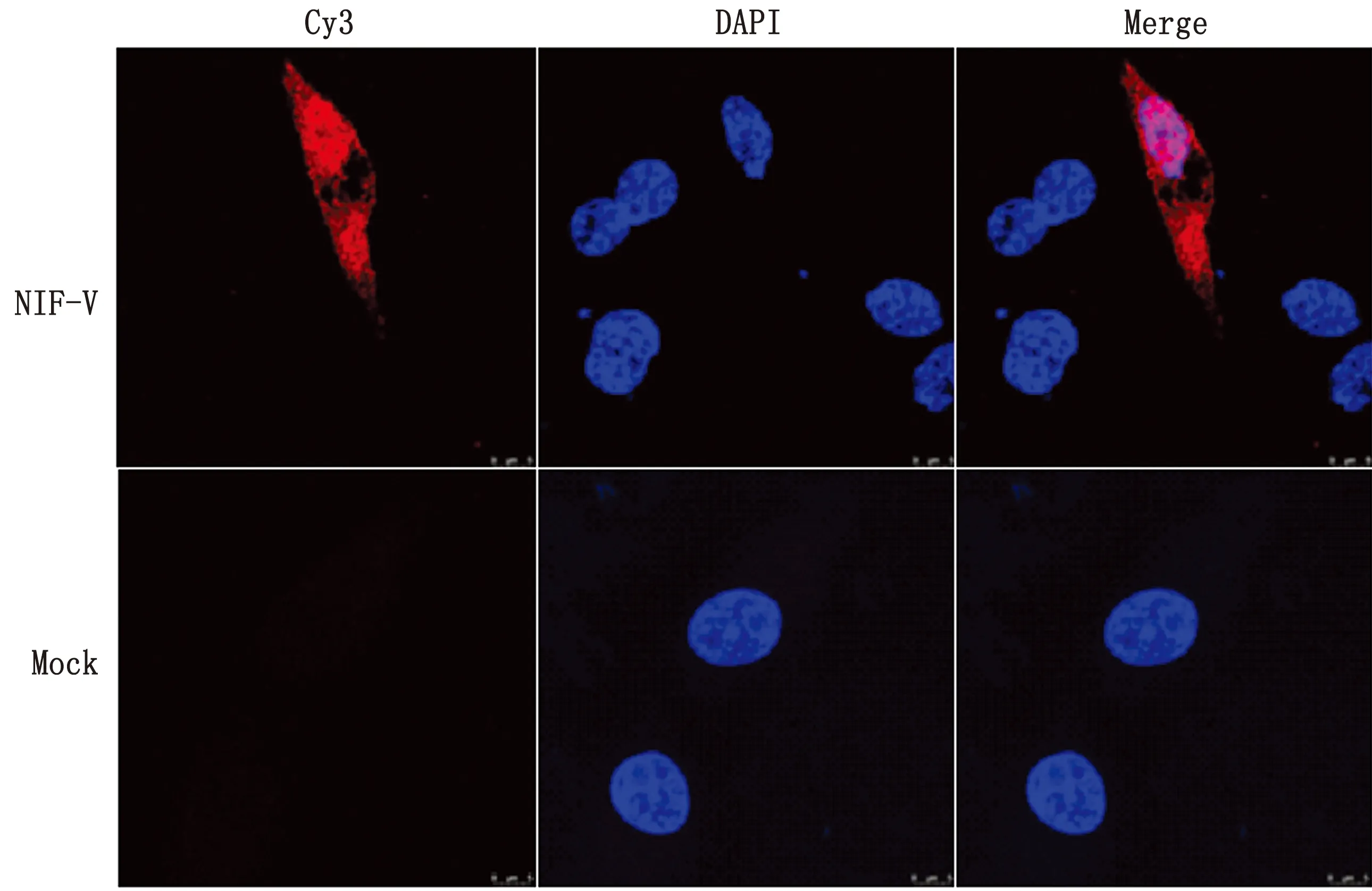
图2 激光共聚焦检测V蛋白亚细胞定位
2.2.2Western blot检测V真核表达产物的核质分布 将N1F-V转染DF-1细胞24 h后抽提细胞浆与细胞核蛋白,将分离得到的胞浆胞核蛋白进行Western blot检测。结果显示,过表达N1F-V 24 h后在胞浆胞核中均检测到V蛋白,说明V蛋白能够入核(图3)。
2.3 V-ΔNLS真核表达质粒的构建
2.3.1PCR扩增V-ΔNLS各基因片段 以N1F-V为模板,分别扩增V-ΔNLS各片段,V-ΔNLS-1 的2个片段长为315,312 bp(图4A);V-ΔNLS-2的2个片段长为411,219 bp(图4B);V-ΔNLS-3的2个片段长为510,120 bp,扩增得到的片段大小与预期相符(图4C)。
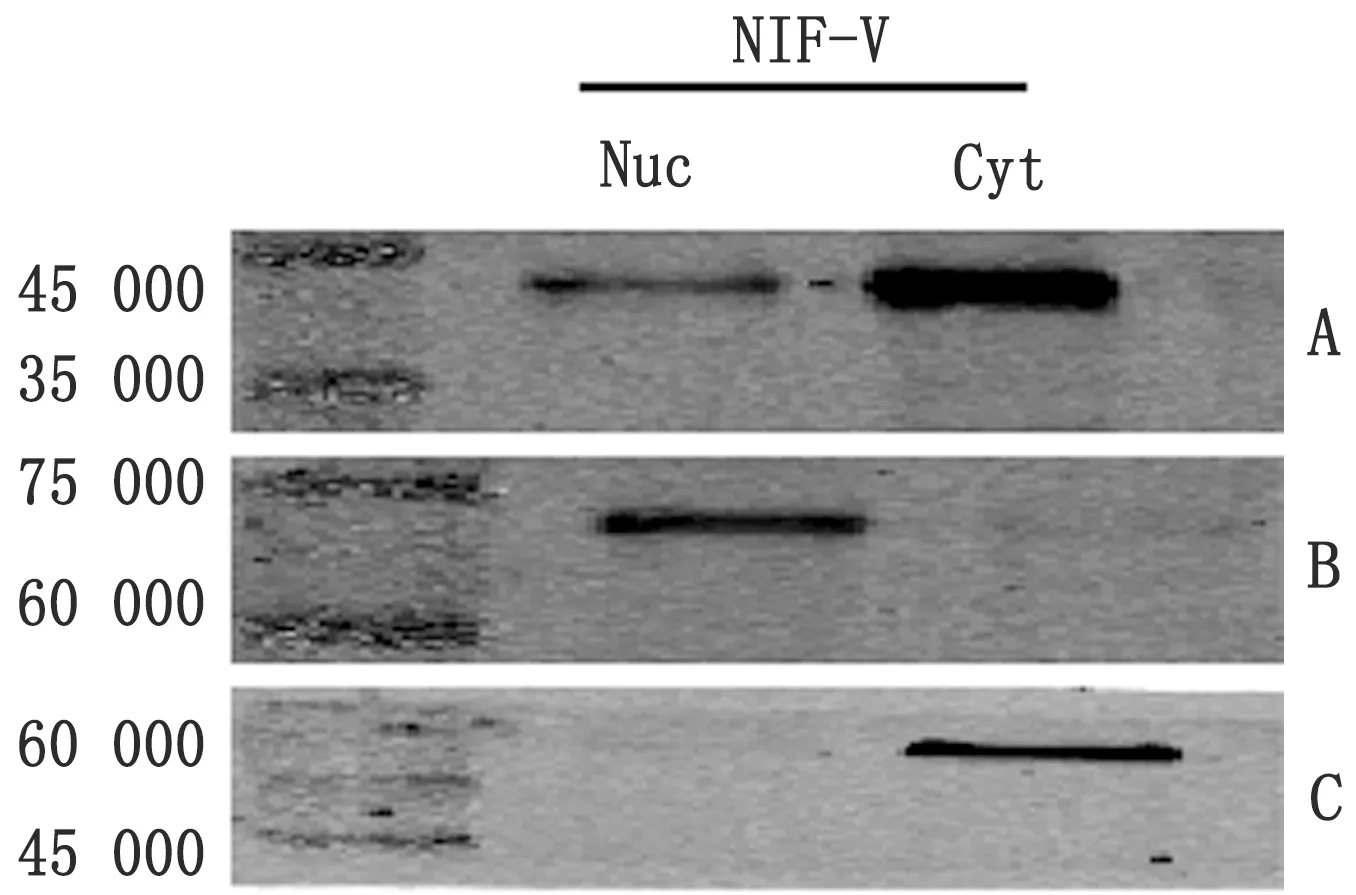
图3 V真核表达产物的核质分布 A.Anti-Flag;B.Anti-Lamin B2;C.Anti-Tubulin

图4 ΔV-NLS各基因片段扩增结果 M.DL500 DNA Marker;A.V-ΔNLS-1;B.V-ΔNLS-2;C.V-ΔNLS-3。1,2.ΔV-NLS各基因片段;3.阴性对照
2.3.2ΔV-NLS真核表达质粒的表达验证 将测序正确的阳性质粒转染至DF-1细胞,24 h后收取细胞制作全蛋白样品,Western blot检测蛋白表达是否正确,结果显示V-ΔNLS1、V-ΔNLS2、V-ΔNLS3蛋白大小与预期相符,真核表达质粒构建成功(图5)。
2.4 V-ΔNLS真核表达产物的亚细胞定位将N1F-V和V-ΔNLS转染至DF-1细胞,转染24 h后进行核质分离,Western blot检测缺失型V的核定位情况,结果显示当V缺失NLS-2或NLS-3后,入核能力大大减弱,缺失NLS-1后入核能力没有明显变化,因此NLS-2或NLS-3是V蛋白入核的关键结构域(图6)。

图5 V-ΔNLS真核表达质粒的表达验证 M.蛋白Marker;1.N1F-V;2.V-ΔNLS1;3.V-ΔNLS2;4.V-ΔNLS3;5.N1F空载体

图6 V-ΔNLS真核表达产物核质分布 1.N1F-V;2.V-ΔNLS1;3.V-ΔNLS2;4.V-ΔNLS3。A.Anti-Flag;B.Anti-Lamin B2;C.Anti-Tubulin
2.5 ΔV-NLS入核关键氨基酸位点的初步探究确定NLS-2或NLS-3是V蛋白入核的关键结构域后,进一步对影响两者入核的关键氨基酸进行探究。Western blot检测结果显示,同时突变V-NLS-2中R141、R142、R152、K159为丙氨酸后,其入核能力大大减弱;但是突变V-NLS-3中R171、K174、R178、R179为丙氨酸后,其入核能力并未减弱;因此,R141、R142、R152、K159可能是影响V-NLS-2入核的关键氨基酸位点(图7)。
2.6 核定位信号对V蛋白拮抗干扰素功能的影响双荧光酶报告基因系统检测不同时间点poly(I∶C)激活的DF-1细胞中IFN-β启动子活性,结果显示与空载体组(A组)相比,N1F-V(B组)能够有效抑制poly(I∶C)诱导的DF-1细胞IFN-β启动子活性;V缺失NLS-1(C组)后依旧能有效抑制poly(I∶C)诱导IFN-β启动子活性;V缺失NLS-2(D组)后丧失抑制IFN-β启动子活性的功能;V缺失NLS-3(E组)后反而有增强IFN-β启动子活性。因此,推测NLS-2是V蛋白发挥拮抗IFN-β功能的关键结构域,NLS-3对于V蛋白发挥拮抗IFN-β功能可能是非必要的(图8,9)。

图7 突变型V真核表达产物核质分布 A.Anti-Flag;B.Anti-Lamin B2;C.Anti-Tubulin

图8 荧光素酶报告基因检测12 h IFN-β启动子活性 A.N1F;B.N1F-V;C.V-ΔNLS1;D.V-ΔNLS2;E.V-ΔNLS3。**.P<0.05;***.P<0.01;ns.P>0.05。下同

图9 荧光素酶报告基因检测24 h IFN-β启动子活性
3 讨论
多种病毒蛋白能够干扰宿主细胞转录和翻译系统以及抑制宿主免疫应答来促进病毒的复制和致病进程[8]。A型流感H1N1病毒非结构蛋白NS1细胞核定位对抗病毒免疫应答以及病毒复制和致病性均起重要作用[9];NDV的结构蛋白M蛋白NLS突变也会导致其细胞核定位特征丧失使NDV的毒力和复制增殖能力显著下降[10]。在副黏病毒家族中,许多非结构蛋白也被证明能够定位于细胞核。例如,尼帕病毒C蛋白部分分布于细胞核,失去NLS的突变体比完整结构C蛋白抑制干扰素活性更强[11]。亨德拉病毒V蛋白可通过转运蛋白importinα/β1和exportin-1进行活跃的核质运输,V蛋白的核聚集会增强对细胞的致病性[12]。而国内外关于NDV V蛋白细胞核定位及其功能的报道较少。已有的文章报道了NDV Ⅶ型毒株ZJ1感染DF-1细胞后,激光共聚焦检测到V蛋白呈现核周分布且主要定位于细胞质中[13]。WANG等[14]发现,将GFP-V真核表达质粒转染至DF-1细胞后,V蛋白可少部分分布于细胞核,但结果还需进一步证实。本试验结合核质分离、激光共聚焦等多种试验方法证实NDV GM株V蛋白能够入核;通过cNLS Mapper预测得到3个importin α/β核输入途径的NLS并验证了NLS对于V蛋白的入核过程是必需的。
核定位信号是蛋白进入细胞核的结构基础,本试验使用的预测网站参考的NLS谱是由芽殖酵母中的核输入测定产生的,但是importin α/β途径在真核生物中是高度保守的[15],预测得到的核定位信号序列可信度较高。核输入受体蛋白通过识别并结合靶蛋白的NLS形成货物-转运蛋白复合体形式进入细胞核。NLS通常由碱性氨基酸残基组成,碱性氨基酸的分布对于其核定位至关重要[16]。本试验分别对V-NLS-2或V-NLS-3中碱性氨基酸进行点突变,其中V-NLS-2中R141、R142、R152、K159突变为丙氨酸后,入核能力大大减弱;V-NLS-3中R171、K174、R178、R179突变为丙氨酸后,其入核能力无明显改变,可能其受到多个转运受体的调控或其他氨基酸对入核也起重要作用。
NDV V蛋白的重要功能之一是拮抗干扰素,本试验通过双荧光素酶报告基因试验检测了完整结构的V蛋白以及缺失NLS的V蛋白对IFN-β的影响,结果显示V蛋白缺失NLS-2后抑制IFN-β的活性丧失,说明核定位信号对V蛋白发挥拮抗IFN-β有着重要作用。V蛋白缺失NLS-3后反而有促进IFN-β的活性,表明V蛋白在调控干扰素过程中可能存在平衡机制。许多参与副黏病毒干扰素信号通路中的转录因子只有完成入核后才能激活相关基因[17-18],V蛋白的细胞核定位能否抑制干扰素相关转录因子从而发挥拮抗干扰素的作用有待探究。
总之,本试验证实了NDV V蛋白能够定位于细胞核,并鉴定出决定其入核的核定位信号以及关键氨基酸,同时初步探索出V蛋白发挥拮抗IFN-β的作用与核定位信号有关,为解析V蛋白的功能提供了新思路。

