产琥珀酸菌LW-2的筛选、鉴定及发酵条件优化
李瑞玲,罗倚坪,刘晓风,孙 勇,,李 东,
(1.东北农业大学工程学院,黑龙江省寒地农业可再生资源利用技术及装备重点实验室,黑龙江 哈尔滨 150030;2.中国科学院成都生物研究所,环境与应用微生物重点实验室,环境微生物四川省重点实验室,四川 成都 610041)
琥珀酸是一种重要的四碳二元羧酸,在2004年,它被美国能源部列为12 种最有潜力的大宗生物基化学品之首。琥珀酸是一种新型、灵活性高、环境友好的生物基平台化合物,可作为生产高附加值产品的原料,如四氢呋喃、己二酸、γ-丁内酯和1,4-丁二醇等。因而它在食品、农业和制药等许多领域具有广泛的应用前景[1-3]。
在食品领域,琥珀酸是影响啤酒口味的重要有机酸,还可用作奶类制品的铁强化剂以及新型乳化剂,琥珀酸还可作为食品的鲜味剂和酸味剂等[4-5]。目前,琥珀酸的制备方法主要为化学合成法和微生物发酵法[6-7]。由于化学法制备过程复杂、分离成本高、污染环境,且价格十分昂贵,故此法限制了琥珀酸的扩大应用[8]。微生物发酵法利用可再生资源,生产成本低廉,发酵过程对环境无污染且能固定二氧化碳,为解决温室气体开辟了新途径[9-11]。因此利用微生物发酵法生产琥珀酸的生物技术路线替代化学路线具有更长远的意义[12-13]。
琥珀酸是厌氧或兼性厌氧微生物通过厌氧发酵获得的最终产物之一[14]。目前,关于产琥珀酸微生物菌株研究较多的有产琥珀酸厌氧螺菌(Anaerobiospirillum succiniproducens)、产琥珀酸放线杆菌(Actinobacillus succinogenes)、产琥珀酸曼海姆氏菌(Mannheimia succiniciproducens)和大肠杆菌(Escherichia coli)[9-11]。大肠杆菌由于其遗传背景简单、生长速率快、易培养等诸多优点而受到越来越多的重视,被认为是最有潜力的琥珀酸生产菌株[15-16]。Clark[17]以野生型大肠杆菌W1485为出发菌株,利用葡萄糖进行厌氧发酵,所得琥珀酸产率为(琥珀酸与葡萄糖物质的量比)0.15~0.2 mol/mol。Millard等[18]以葡萄糖作为碳源,利用野生型大肠杆菌JCL1208发酵生产琥珀酸,所得琥珀酸产量为3.0 g/L。
本研究以牛瘤胃内容物作为菌源,用富马酸钠为碳源,在高浓度二氧化碳气氛下富集筛选获得产琥珀酸菌株,以期实现葡萄糖和木糖高效转化制备琥珀酸的目的。目前已报道的菌株多以葡萄糖为碳源发酵产琥珀酸,但很少有菌株利用木糖为碳源,或既可利用葡萄糖也可利用木糖为碳源厌氧发酵产琥珀酸[19-20],研究旨在为木质纤维生物质原料(水解后同时含有葡萄糖和木糖)生产琥珀酸提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
样品取于四川省成都市双流区现场屠宰的牛瘤胃内容物。
1.1.2 培养基
富集培养基[21]:玉米浆10 g,富马酸钠15 g,K2HPO43 g,碱式碳酸镁1.5 g,NaCl 1.0 g,(NH4)2SO41.0 g,CaCl20.2 g,MgCl20.2 g,另外添加莫能菌素干粉剂0.2 g,去离子水1 000 mL。
筛选培养基[21]:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,葡萄糖5 g,酵母提取物5 g,溴甲酚绿0.1 g,琼脂18 g,pH 6.5,去离子水1 000 mL。
活化培养基TSB[22]:葡萄糖2.5 g,胰蛋白胨17 g,大豆蛋白胨3 g,NaCl 5 g,K2HPO42.5 g,pH 7.3±0.2,去离子水1 000 mL。
发酵培养基[22]:葡萄糖/木糖30 g,酵母提取物5 g,NaH2PO41.16 g,Na2HPO40.31 g,NaCl 1 g,CaCl20.2 g,MgCl20.2 g,碱式碳酸镁30 g,VB121 μg,生物素20 μg,叶酸20 μg,硫胺素50 μg,核黄素50 μg,烟酸50 μg,泛酸50 μg,对氨基苯甲酸50 μg,硫辛酸50 μg,VB6100 μg,硅酮消泡剂1 mL,去离子水1 000 mL,pH 7.0。
实验中所用培养基均在115 ℃灭菌30 min。
1.1.3 试剂
琥珀酸标准品 西格玛奥德里奇(上海)贸易有限公司;糖标准品 北京索莱宝科技有限公司;其他试剂均为分析纯或生化试剂。
1.2 仪器与设备
E500厌氧工作站、Anaerobox IV厌氧培养箱 美国Gene Science公司;LC-20A高效液相色谱仪 日本岛津公司;TU-1810SPC紫外分光光度计 北京普析通用公司;Pro台式扫描电子显微镜 荷兰Phenom公司;S1000双槽梯度聚合酶链式反应(polymerase chain reaction,PCR)仪美国Bio-Rad公司。
1.3 方法
1.3.1 分析测定方法
有机酸测定:高效液相色谱法,自动进样器,色谱柱为Aminex HPX-87H(300 mm×7.8 mm),流动相为5 mmol/L H2SO4溶液,pH 2.5,柱温50 ℃,进样量20 μL,流速0.6 mL/min,紫外检测器波长210 nm。
残糖测定:高效液相色谱法,示差检测器,柱温50 ℃(色谱柱与色谱条件与有机酸测定相同,采用紫外与示差检测器联用检测模式)。
生物量测定[22]:将发酵液用7% HCl溶液稀释,使A660nm值在0.2~0.8之间,用紫外-可见分光光度计测定。生物量(OD660nm)=A660nm×稀释倍数。
1.3.2 菌株鉴定
形态特征和生理生化特征测定参照《常见细菌系统鉴定手册》[23]。利用试剂盒提取菌体总DNA,以菌体总DNA为模板,采用通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)进行PCR扩增。将扩增得到的PCR产物交至生工生物工程(上海)有限公司进行测序,将测序所得基因序列提交GenBank数据库,用BLAST进行序列对比分析。利用MEGA 6.0软件选取同源性高的相关序列进行比对分析,用邻近法构建进化树。
1.3.3 产琥珀酸菌的富集
在厌氧工作站中将瘤胃液经4 层纱布过滤,600 r/min离心10 min,去掉饲料颗粒及纤毛虫,留上清液,8 000 r/min离心15 min,弃上清液,用生理盐水溶解沉淀。以10%接种量接入装有100 mL富集培养基的250 mL厌氧瓶中,37 ℃、180 r/min摇瓶培养,每隔24 h转接一次,连续转接3 次。
1.3.4 产琥珀酸菌的筛选
将最后一次所得的富集培养液按十倍稀释法稀释10-5、10-6、10-7、10-8四个稀释度,各取0.1 mL涂布到筛选培养基上,37 ℃恒温培养24~36 h。观察菌落周围溴甲酚绿的变色情况,确定该菌株有无产酸能力,挑取黄色变色圈中央的典型单菌落,纯化多次至纯菌株。
将纯种分离得到的菌株活化24 h后,以10%的接种量接入装有45 mL发酵培养基的250 mL厌氧瓶中,在100% CO2、37 ℃、150 r/min条件下厌氧培养。培养48 h后,10 000 r/min离心10 min,0.22 μm滤膜过滤,采用高效液相色谱测定每个样品中琥珀酸的产量,选取琥珀酸产量较高菌株进行发酵条件优化实验。
1.3.5 菌种发酵条件
将体积分数10%的种子液接种至装有45 mL发酵培养基的250 mL厌氧瓶中,分别以初始糖质量浓度为30 g/L的葡萄糖和木糖为碳源,在37 ℃条件下,通入CO2进行厌氧培养,葡萄糖发酵24 h,木糖发酵66 h。对菌体OD660nm、糖消耗、琥珀酸积累进行分析。
1.3.6 琥珀酸产率(还原糖对琥珀酸的转化率)的计算
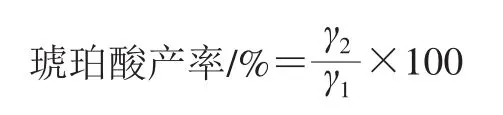
式中:γ1为初始还原糖质量浓度/(g/L);γ2为琥珀酸质量浓度/(g/L)。
2 结果与分析
2.1 琥珀酸产生菌筛选
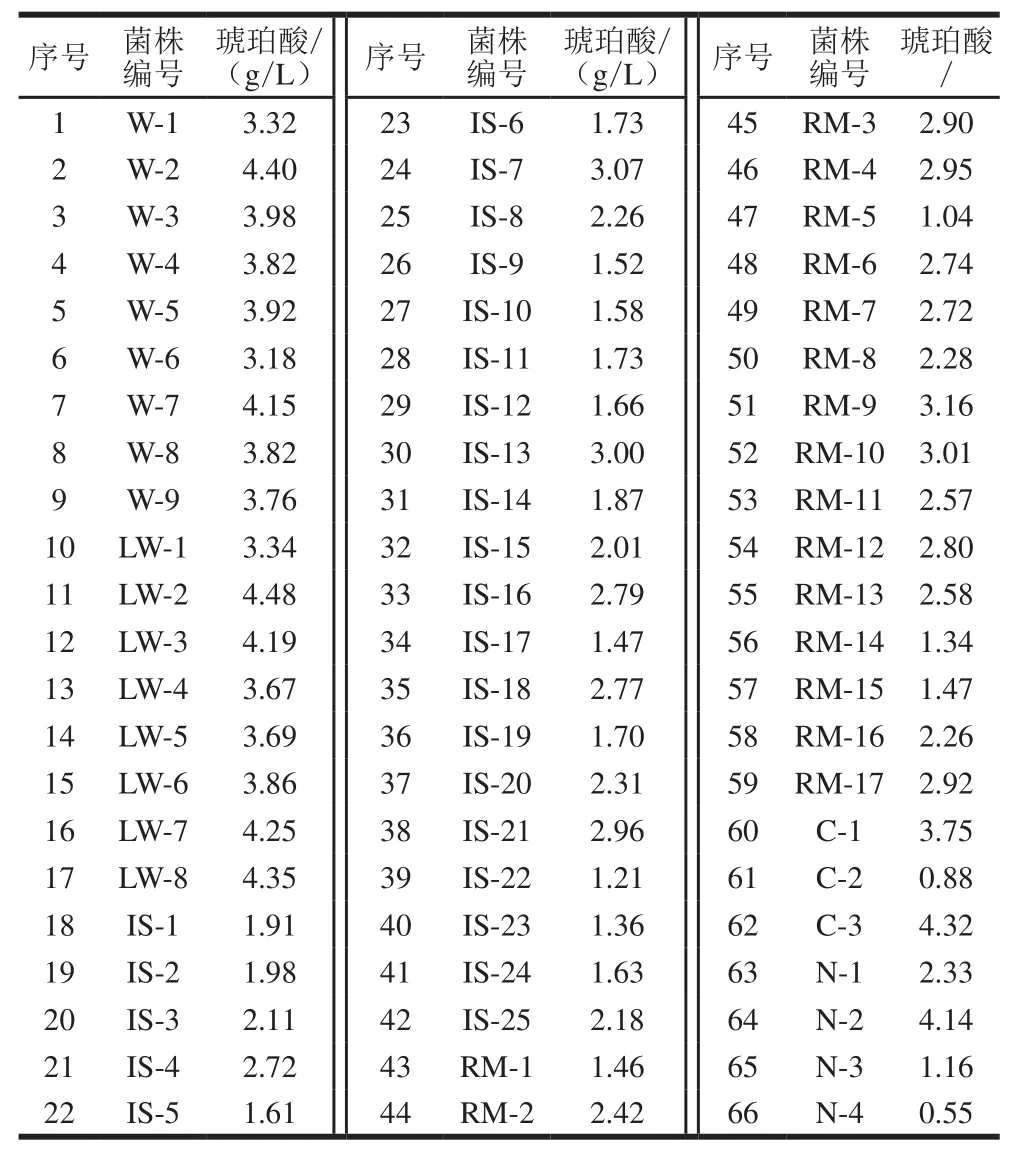
表1 葡萄糖碳源发酵所筛选菌株产琥珀酸质量浓度Table 1 oncentrations of succinic acid produced by 66 isolates using glucose as carbon source
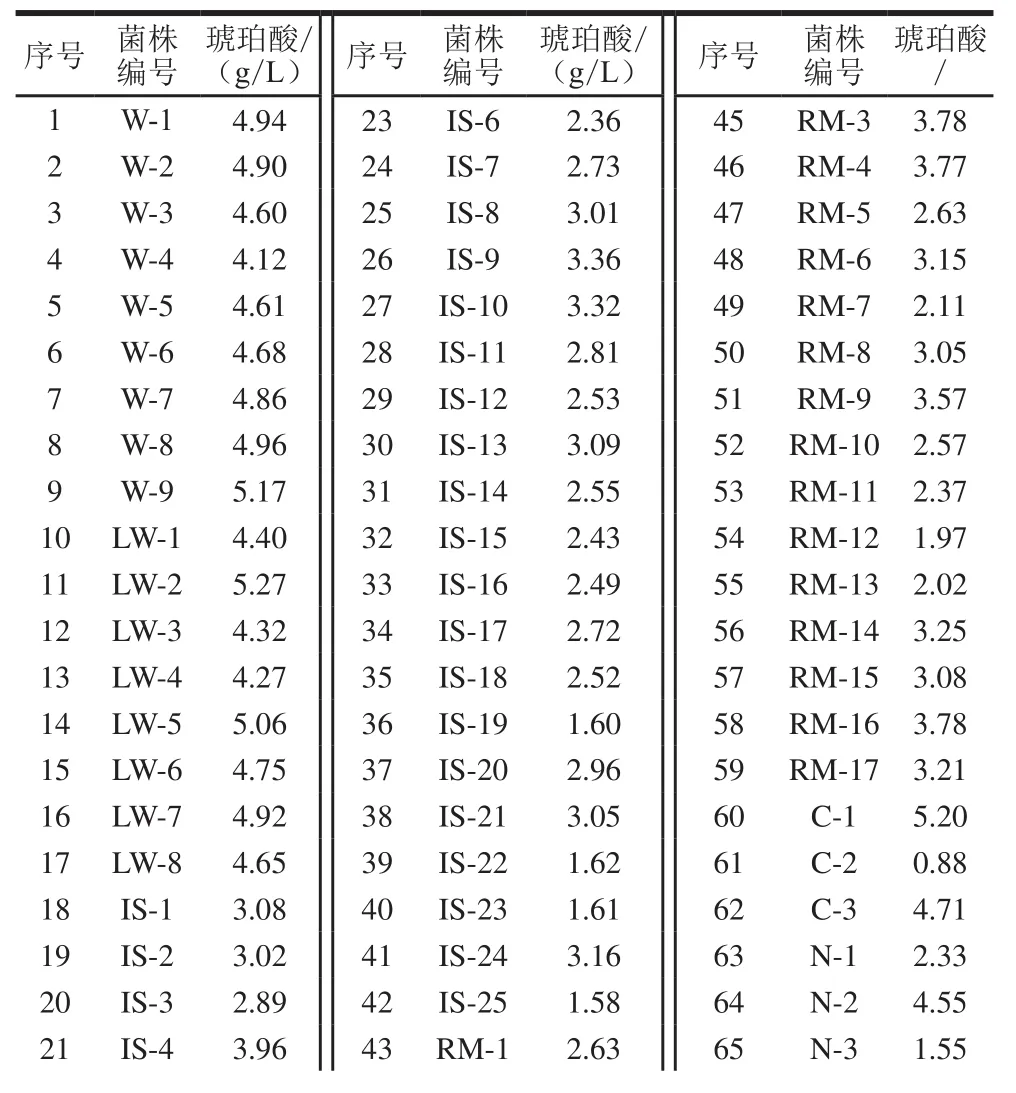
表2 木糖碳源发酵所筛选菌株产琥珀酸质量浓度Table 2 Concentrations of succinic acid produced by 66 isolates using xylose as carbon source

22 IS-5 2.89 44 RM-2 4.09 66 N-4 0.87
经过对瘤胃内容物大量菌株的筛选分离获得产酸菌株66 株。分别以葡萄糖和木糖为碳源进行琥珀酸发酵,其中菌株LW-2利用葡萄糖和木糖产琥珀酸质量浓度最高,分别为4.48 g/L和5.27 g/L(表1、2),表明该菌株具有较好利用葡萄糖和木糖发酵生产琥珀酸的能力。因此,选取菌株LW-2进行下一步形态、生理生化鉴定和发酵条件优化实验。
2.2 菌种鉴定

图1 菌株LW-2扫描电镜图Fig.1 Scanning electron micrographs of strain LW-2

表3 菌株LW-2生理生化鉴定结果Table 3Physiological and biochemical identification of strain LW-2
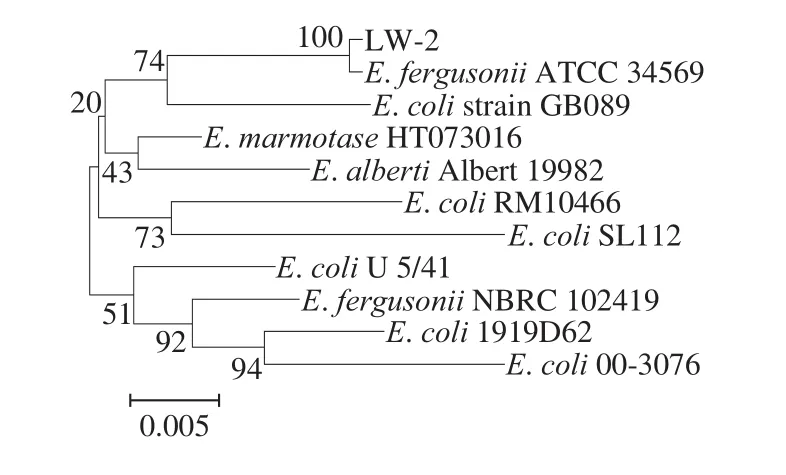
图2 菌株LW-2的系统进化树Fig.2 Phylogenetic tree of strain LW-2
菌株LW-2菌落呈圆形、微凸、无色、边缘规则整齐、半透明、表面光滑湿润。扫描电镜观测菌体呈短直杆状、不产芽孢、菌体大小为0.53~0.61 μm×0.96~1.71 μm(图1);该菌有荚膜、有鞭毛、能运动、革兰氏阴性,在好氧和厌氧条件下均能生长,最适生长温度为37 ℃,其他生理生化特征见表3。测序结果显示菌株LW-2的16S rDNA基因序列长度为1 479 bp,在BLAST 数据库进行相似性比对,并使用MEGA 6.0构建系统发育树(图2),菌株LW-2与肠杆菌科弗格森埃希菌(Escherichia fergusonii)的相似性达99.98%,并且在系统发育树上亲缘关系最近。根据菌株LW-2的形态特征、生理生化特征以及其16S rDNA序列分析,鉴定菌株LW-2为弗格森埃希菌。
2.3 以葡萄糖和木糖分别为碳源的发酵
微生物发酵的生产水平不仅取决于生产菌种本身的性能,还要赋以合适的环境条件,如培养时间、培养温度、接种量等[24]。分别以葡萄糖和木糖为碳源,按照1.1.2节的发酵培养基,对菌株LW-2的发酵时间、发酵温度、接种量、pH值调节剂及其用量等进行单因素优化,增加菌体细胞密度,提高琥珀酸的产量,为进一步利用该菌株奠定基础。
2.3.1 发酵时间对菌体生长及发酵琥珀酸产量的影响
以葡萄糖为碳源(图3A),OD660nm在12 h达到最高值5.15,琥珀酸最终产量在24 h达到最高值为4.71 g/L,琥珀酸产率为15.70%。Millard等[18]以葡萄糖为碳源利用野生型大肠杆菌JCL1208发酵获得的琥珀酸产量为3.27 g/L;Goldberg等[25]以葡萄糖为碳源利用大肠杆菌CA79发酵得到的琥珀酸产率仅为9.0%。与其结果相比,本实验所用菌株LW-2以葡萄糖为碳源发酵获得的琥珀酸产量为大肠杆菌JCL1208的1.44 倍,获得的琥珀酸产率为大肠杆菌CA79的1.74 倍。以木糖为碳源(图3B),OD660nm在24 h达到最高值4.85,琥珀酸最终产量在66 h达到最高值为6.21 g/L,琥珀酸产率为20.70%。Liu Rongming等[26]以木糖为碳源,利用野生型大肠杆菌K12厌氧发酵48 h,琥珀酸产量仅为(0.87±0.12)g/L,琥珀酸产率仅为0.14%。因此,本实验所用野生型菌株LW-2具有更好的利用木糖发酵产琥珀酸能力。
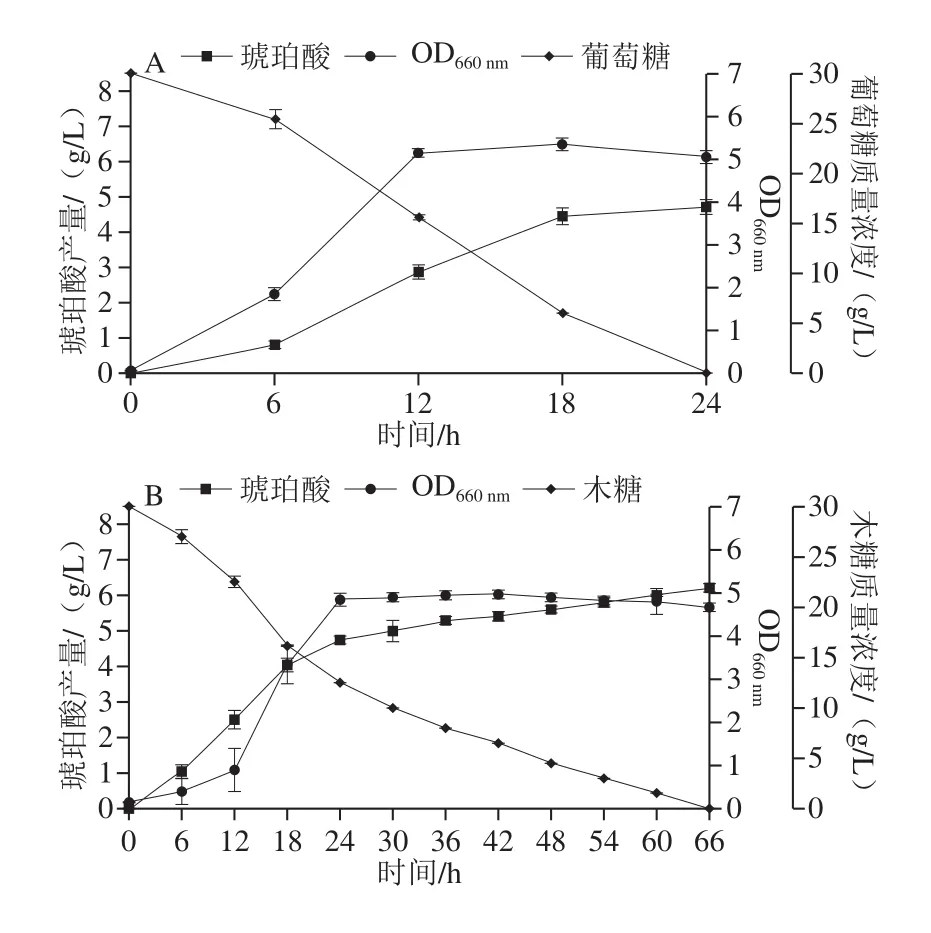
图3 发酵时间对OD660 nm和琥珀酸产量的影响Fig.3 Effect of fermentation time on OD660 nm and succinic acid production
2.3.2 温度对菌体生长及发酵琥珀酸产量的影响
琥珀酸发酵时需要通入CO2,温度既影响CO2的溶解度,又影响菌株的生长及产物的合成。据文献报道,琥珀酸发酵的温度一般在37 ℃左右[27-29]。以葡萄糖为碳源(图4A),当培养温度为40 ℃,发酵24 h,菌体生物量最高,琥珀酸产量也达到最高为5.44 g/L,琥珀酸产率为18.13%,该最适温度与瘤胃相似39~41 ℃。Wang Dan等[30]以葡萄糖为碳源利用野生型大肠杆菌发酵获得的琥珀酸产率为4%。与该结果相比,菌株LW-2以葡萄糖为碳源发酵获得的琥珀酸产率是其4.5 倍。以木糖为碳源(图4B),当培养温度为37 ℃,发酵66 h,此时菌体生物量值最大,琥珀酸产量也达到最高为6.21 g/L,琥珀酸产率为20.70%。唐绪位等[31]以木糖为碳源,在37 ℃条件下利用野生型大肠杆菌MG1655发酵生产琥珀酸,所得琥珀酸产量为4.92 g/L。与其结果相比,菌株LW-2在37 ℃条件下以木糖为碳源发酵获得的琥珀酸产量提高了21%。
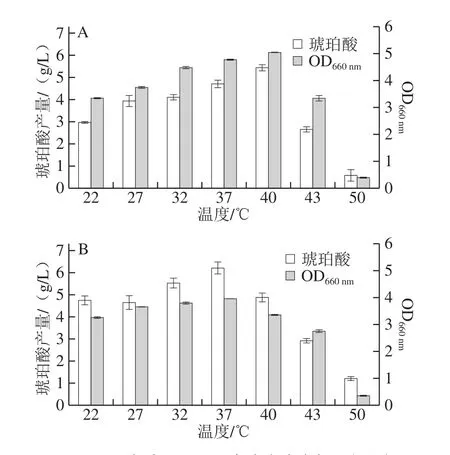
图4 温度对OD660 nm及发酵琥珀酸产量的影响Fig.4 Effect of fermentation temperature on OD660 nm and succinic acid production
2.3.3 接种量对菌体生长及发酵琥珀酸产量的影响
接种量过大会影响产物合成,而且会过多移入代谢废物,经济性差;过小会延长培养时间,降低发酵效率。据文献报道[29,32],琥珀酸发酵的接种量大多在5%~10%之间。本实验不同接种量对琥珀酸发酵的影响见图5。
以葡萄糖为碳源(图5A),当接种量为1%~2.5%时,琥珀酸产量和菌体生物量缓慢增加;当接种量超过2.5%时,琥珀酸产量未呈现增加的趋势。该结果说明葡萄糖主要被用于大量菌体的自身生长代谢,而对琥珀酸的积累不益;当接种量为2.5%时,发酵24 h,OD660nm及琥珀酸产量最高分别为4.05和6.36 g/L,琥珀酸产率为21.2%。李宜奎等[33]利用大肠杆菌突变株QQS101以葡萄糖为碳源,1%的接种量厌氧发酵,积累琥珀酸0.951 g/L;于丽等[34]利用大肠杆菌JM001以葡萄糖为碳源,10%的接种量厌氧发酵,琥珀酸产率为14.4%。与其结果相比,本实验虽然利用菌株LW-2以2.5%的接种量厌氧发酵,但是获得的琥珀酸产量却是大肠杆菌突变株QQS101的6.69 倍,获得的琥珀酸产率是大肠杆菌JM001的1.47 倍。
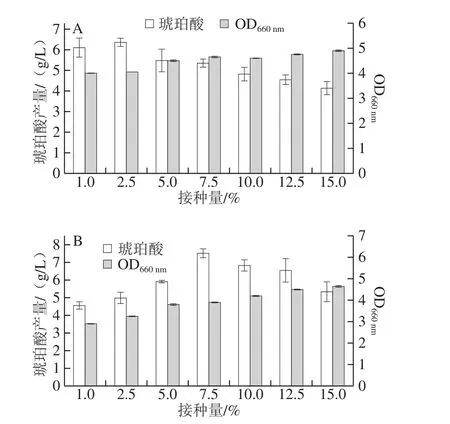
图5 接种量对OD660 nm及发酵琥珀酸产量的影响Fig.5 Effect of inoculum amount on OD660 nm and succinic acid production
以木糖为碳源(图5B),接种量低于7.5%时,发酵液发酵不充分,产琥珀酸量较低。随着接种量的增加,琥珀酸产生量逐渐增多。当发酵接种量高于7.5%时,随着接种量的加大,菌体生物量缓慢增加并趋于平稳,说明菌体此时已进入对数生长期,菌体生物量几乎不变,而琥珀酸产量呈现减少的趋势,表明此时发酵液中的木糖多消耗在菌体细胞生长繁殖上,使琥珀酸产量减少。当发酵接种量为7.5%时,发酵66 h,琥珀酸产量最高可达7.51 g/L,琥珀酸产率为25.03%。万青等[35]采用常压室温等离子体射流诱变产琥珀酸大肠杆菌菌株,在厌氧条件下,利用以木糖为碳源的培养基,筛选得到1 株可以代谢木糖并积累琥珀酸的突变株DA111,该突变菌株利用木糖以10%的接种量发酵72 h可以产生1.02 g/L的琥珀酸,琥珀酸产率为24.38%。与该结果相比,当使用7.5%的接种量时,本实验可获得更高产量、更高产率的琥珀酸。
2.3.4 培养基中pH值调节剂对菌体生长及发酵琥珀酸产量的影响
供给二氧化碳或一些碳酸盐类化合物可获得高产量琥珀酸盐。当二氧化碳或碳酸盐溶于水与水反应时,生成之间的平衡由培养基pH值决定。随着菌体发酵产酸的进行,发酵液的pH值逐渐降低,为了维持菌体最适的发酵条件,需要加入调节剂[36]。不同的pH值调节剂溶于水时有不同的特性,不同调节剂对琥珀酸发酵的影响见图6。
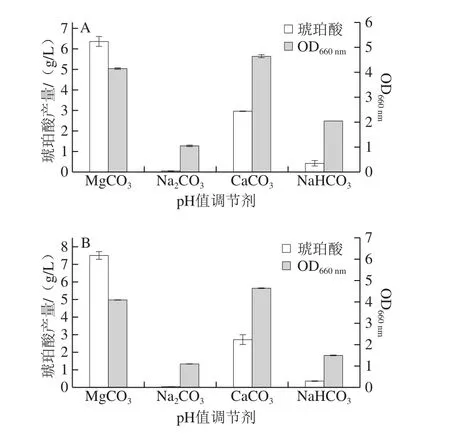
图6 pH值调节剂对OD660 nm及发酵琥珀酸产量的影响Fig.6 Effect of pH regulators on OD660 nm and succinic acid production
分别以葡萄糖和木糖为碳源时,4 种调节剂MgCO3、CaCO3、Na2CO3、NaHCO3对琥珀酸发酵的影响相似。当Na2CO3和NaHCO3作为pH值调节剂时,琥珀酸产量和菌体生物量均较低;当CaCO3作为pH值调节剂时,菌体生长较好,但琥珀酸产量较低。而当以MgCO3作为pH值调节剂时琥珀酸产量最高,分别为6.36 g/L和7.51 g/L;琥珀酸产率分别为21.20%和25.03%。但是菌体生物量不及CaCO3作为pH值调节剂时高。根据文献报道[37],加入CaCO3可以中和发酵产生的酸,但是CaCO3会抑制产酸微生物产琥珀酸。加入Na2CO3和NaHCO3中和有机酸,由于Na2CO3和NaHCO3溶在发酵液中会使发酵液的pH值维持在8~10左右,而且过量的Na+也不利于产琥珀酸菌的生长。加入MgCO3中和发酵所产生的有机酸,整个发酵过程菌体代谢旺盛,发酵效果较佳[29]。本实验不同pH值调节剂在琥珀酸发酵过程中的作用与文献报道的相似,且反应过程中MgCO3可以释放出CO2,维持琥珀酸发酵所需的CO2环境。另外,Mg2+在维持细胞新陈代谢方面起重要作用,且Mg2+是磷酸烯醇式丙酮酸羧化酶的一种辅助因子,对代谢流的分布起着关键的作用。因此,当分别以葡萄糖和木糖作为碳源发酵时,均选定MgCO3作为发酵过程的pH值调节剂。
2.3.5 培养基中MgCO3用量对菌体生长及发酵琥珀酸产量的影响
在琥珀酸发酵过程中,有机酸的积累会导致发酵过程中pH值下降,因此维持发酵体系内pH值的稳定至关重要。不同质量浓度MgCO3对琥珀酸发酵的影响见图7。不管是以葡萄糖还是木糖为碳源,均为MgCO3用量为30 g/L时,菌体生长最好,琥珀酸产量最高,分别为6.36 g/L和7.51 g/L,琥珀酸产率分别为21.20%和25.03%。MgCO3用量可能影响代谢流分布。当MgCO3用量低于30 g/L时,随着MgCO3用量的增加,流向琥珀酸的代谢流增加。但是当MgCO3用量高于30 g/L时,过量的MgCO3对菌体造成抑制。MgCO3不仅是琥珀酸的合成来源,也是影响厌氧代谢流向的重要因素。Hyohak等[29]研究结果表明,适量增加pH值调节剂碳酸氢盐的用量可提高CO2溶解浓度,过量添加对细胞生长有负面影响,进而影响琥珀酸产量。本实验结果与Hyohak等[29]获得的结果一致。
3 结 论
本研究筛选获得1 株尚未被报道的产琥珀酸菌——弗格森埃希菌,且利用木糖发酵获得的琥珀酸产量高于葡萄糖。该菌株利用葡萄糖产琥珀酸的最佳工艺条件为发酵时间24 h、发酵温度40 ℃、接种量2.5%、pH值调节剂MgCO3、MgCO3用量30 g/L,在该条件下所得琥珀酸产量为6.36 g/L,比优化前提高了41.96%;利用木糖产琥珀酸的最佳工艺条件为发酵时间66 h、发酵温度37 ℃、接种量7.5%、pH值调节剂MgCO3、MgCO3用量30 g/L,在该条件下所得琥珀酸产量为7.51 g/L,比优化前提高了42.50%。研究为进一步利用该菌株以木质纤维生物质原料(水解后主要含有葡萄糖和木糖)生产琥珀酸提供参考。

