基于生物信息学定向制备柠条籽蛋白抗氧化肽的工艺优化
頡 宇,胡锦灵,赵宏飞,张柏林
(北京林业大学生物科学与技术学院,北京 100083)
活性肽的商业化应用与其制备有很大关系,取决于蛋白原料的选择和蛋白酶的筛选[1-3]。作为一种生物活性肽,抗氧化肽的研究报道很多。基于抗氧化肽构效关系的研究表明,酸性氨基酸与抗氧化肽减缓油脂氧化显著相关[4-6]。因此,选择适宜的富含酸性氨基酸的蛋白原料,并确定适宜的蛋白酶类型,可以有目的地制备减缓油脂氧化的抗氧化肽。
柠条是豆科锦鸡儿属植物栽培种的统称[7],主要分布亚洲和欧洲的干旱和半干旱地区,我国大约有70多种,遍布东北、华北和西北地区,种植面积超过上亿亩[8-9]。柠条根系粗壮发达,能够有效控制土地荒漠化,是我国三北地区重要的生态保护植物[10];柠条籽年产量约292.5 kg/hm2,蛋白质含量为35.5%[11-12],其蛋白质富含谷氨酸和天冬氨酸[13],因此,柠条籽可以作为酸性氨基酸蛋白原料的重要来源之一。
生物信息学是用于管理、规划和解释与生物系统相关信息的计算方法,它利用各种数据库,在线工具和软件等获取目标功能[14]。BIOPEP是一个由波兰Warmia Mazury大学开发的软件工具,它不仅是一个包含蛋白质序列、生物活性肽和敏感肽的数据库,而且也内置了预测程序,可以帮助预测水解蛋白酶的酶切位点[15]。因此,本实验以柠条籽为酸性氨基酸蛋白来源,通过借助BIOPEP筛选适合的蛋白酶类型,从选定的蛋白原料中筛选抗氧化肽,形成一种新的抗氧化肽制备工艺,以期研究定向制备延缓油脂氧化抗氧化肽的新工艺和新策略,为推动抗氧化肽产业化发展提供创新性的理论依据。
1 材料与方法
1.1 材料与试剂
柠条籽采自内蒙古赤峰市,自然风干后粉碎过筛,静置备用。四硼酸钠、十二烷基磺酸钠(sodium laurylsulfonate,SDS)、邻苯二甲醛(o-phthalaldehyde,OPA)、丝氨酸、吐温-20、特丁基对苯二酚(tertiary butylhydroquinone,TBHQ)、硫氰酸氨、过硫酸钾、铁氰化钾(均为分析纯) 北京化学试剂公司;蛋白Marker SM1811 美国Thermo Fisher公司;木瓜蛋白酶、胃蛋白酶、碱性蛋白酶、二硫苏糖醇、亚油酸均为国产分析纯或优级纯。
1.2 仪器与设备
T6紫外-可见分光光度计 新世纪北京市普析通用仪器有限责任公司;HH-2数显恒温水浴 金坛市荣华仪器制造有限公司;TGL-16G台式高速离心机 上海市菲恰尔分析仪器有限公司;GL-20G-II高速冷冻离心机上海市安亭科学仪器厂;FD-1冷冻干燥机 北京市德天佑科技发展有限公司;PowerPac Basic电泳仪 美国伯乐公司;PHS-3C pH计 上海市仪电科学仪器股份有限公司;SHP-250生化培养箱 上海市森信实验仪器有限责任公司;液相色谱-质谱联用仪 美国Thermo Fisher公司。
1.3 方法
1.3.1 柠条籽的营养成分测定
水分测定采用GB 5009.3—2010《食品中水分的测定》第一法;灰分测定参照GB 5009.4—2010《食品中灰分的测定》;蛋白质测定参照GB 5009.5—2010《食品中蛋白质的测定》第一法;脂肪测定参照GB/T 5009.6—2003《食品中脂肪的测定》第一法;碳水化合物测定按GB 28050—2011《预包装食品营养标签通则》;氨基酸测定参照GB/T 5009.124—2003《食品中氨基酸的测定》。
1.3.2 柠条籽蛋白的提取
将柠条籽脱皮、去脂并烘干至质量恒定,粉碎过筛,静置备用。参照Osborne法[16]用H2O、10% NaCl、70%乙醇溶液、0.2% NaOH溶液分别提取柠条籽中清蛋白、球蛋白、醇溶蛋白、谷蛋白,将提取得到的各类蛋白冷冻干燥保存备用。另外称取脱脂柠条籽粉,采用碱提酸沉法[17],用0.1 mol/L NaOH溶液调节溶液pH值至9.0,随后置于70 ℃恒温水浴1 h;离心取上清液,用0.1 mol/L HCl溶液将pH值调至4.0,随后静置0.5 h;再次离心取沉淀,将沉淀物清洗至pH 7.0后,经过冷冻干燥后即得产物柠条籽蛋白。
1.3.3 SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)
将柠条籽清蛋白、球蛋白、醇溶蛋白、谷蛋白及碱提酸沉所得柠条籽蛋白样品分别用蒸馏水溶解为1 mg/mL的溶液。分别取各蛋白溶液以5∶1(V/V)加入上样缓冲液,沸水浴5 min,离心取上清液,进行15% SDSPAGE。电泳条件:恒流14 mA,电泳时间90 min;考马斯亮蓝染色。蛋白Marker为SM1811。
1.3.4 蛋白酶的确定
采用BIOPEP(http://www.uwm.edu.pl/biochemia/index.php/pl/biopep#opennewwindow)对已知蛋白进行计算机虚拟水解,以筛选柠条籽蛋白的水解蛋白酶。实验以谷蛋白作为柠条籽蛋白的生物信息模板,在BIOPEP数据库内搜索已知谷蛋白序列5 条,并利用数据库中内置软件对其进行在线虚拟水解,即选择木瓜蛋白酶(EC 3.4.22.2)、胃蛋白酶(EC 3.4.23.1)、胰蛋白酶(EC 3.4.21.4)、V-8蛋白酶(EC 3.4.21.19)、木瓜蛋白酶+V-8蛋白酶分别对5 条谷蛋白序列虚拟水解,内置软件经计算自动得出各蛋白酶相应的水解度,选取结果中水解度较高的蛋白酶进行后续实验。
1.3.5 多肽质量浓度测定
柠条籽蛋白水解物中多肽质量浓度的测定采用双缩脲法[18]。称取样品10 mg,定容至10 mL,取2.5 mL样品溶液,加入2.5 mL 0.1 mg/mL的三氯乙酸溶液,混合均匀,静置20 min,3 500 r/min离心10 min。取1.0 mL上清液于试管,加入双缩脲试剂3.0 mL,混合均匀后在60 ℃水浴中显色5 min,2 000 r/min离心10 min。取上清液于310 nm波长处测定OD值,可得样品溶液中的多肽质量浓度(mg/mL)。
1.3.6 水解度测定
水解度测定采用OPA法[19]。将0.4 mL的柠条籽蛋白水解物溶液加入到3 mL OPA试剂中,混匀并静置2 min,用紫外-可见分光光度计在340 nm波长处测定OD值,记为OD样品。以超纯水和0.1 mg/mL的丝氨酸标准溶液代替样品溶液分别作为空白组和标准组,其340 nm波长处的OD值分别记为OD空白和OD标准。丝氨酸的氨基当量(Ser(NH2))和水解度值计算如下:
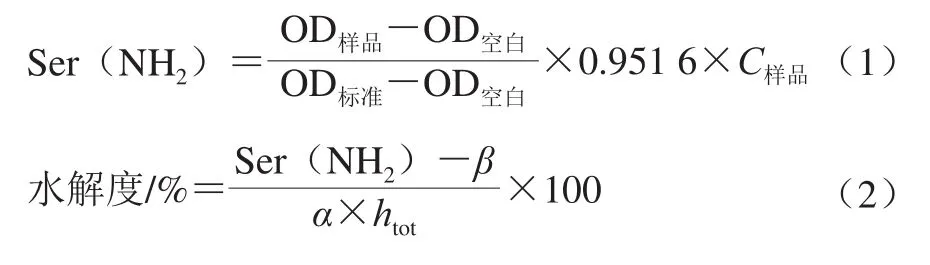
式中:0.951 6为丝氨酸标准溶液的浓度/(mmol/L);C样品为样品溶液质量浓度/(mg/mL);α、β、htot为常数,谷蛋白中的常数值分别为α=1.0、β=0.4、htot=8.0[19]。
1.3.7 蛋白水解物抑制亚油酸能力测定
以抑制亚油酸氧化能力作为评价柠条籽蛋白水解物的抗氧化指标。抑制亚油酸氧化的测定采用硫氰酸铁法[20]。首先取亚油酸和等量的吐温-20,用磷酸缓冲溶液定容至50 mL制得亚油酸乳化液;然后将未加入柠条籽蛋白水解物和加入柠条籽蛋白水解物的亚油酸乳化液分别置于37 ℃进行氧化。取上述氧化液各0.1 mL,分别加入4.7 mL 75%乙醇溶液,0.1 mL 3.9 mol/L硫氰酸铵和0.1 mL 0.02 mol/L硫酸亚铁(溶于0.1 mol/L HCl溶液),室温下放置3 min,在500 nm波长下测定OD值。亚油酸氧化抑制率按式(3)计算:
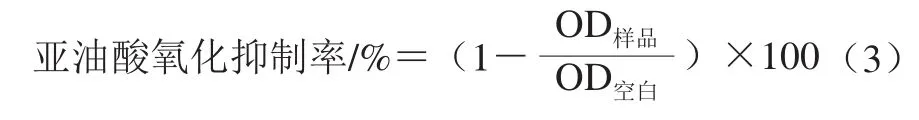
1.3.8 水解条件单因素试验
1.3.8.1 温度的选择
将5 份等量柠条籽蛋白样品分别用蒸馏水溶解,90 ℃预处理5 min,加入2%的蛋白酶并将其pH值调至7.0,分别在35、45、55、65、75 ℃酶解1 h,在80 ℃灭酶15 min,然后离心取上清液,冷冻干燥后备用。
1.3.8.2 pH值的选择
将5 份等量柠条籽蛋白样品分别用蒸馏水溶解,90 ℃预处理5 min,加入2%的蛋白酶并将pH值分别调至4.0、5.0、6.0、7.0、8.0,然后在55 ℃酶解1 h,在80 ℃灭酶15 min,离心取上清液,冷冻干燥后备用。
1.3.8.3 时间的选择
将5 份等量柠条籽蛋白样品分别用蒸馏水溶解,90 ℃预处理5 min,加入2%的蛋白酶并将pH值调至7.0,在55 ℃分别酶解1、2、3、4、5 h,然后80 ℃灭酶15 min,离心取上清液,冷冻干燥后备用。
1.3.8.4 蛋白酶添加量(酶与底物比)的选择
将5 份等量柠条籽蛋白样品分别用蒸馏水溶解,90 ℃预处理5 min,分别加入1%、2%、3%、4%、5%的蛋白酶并将其pH值调至7.0,在55 ℃酶解1 h,然后80 ℃灭酶15 min,离心取上清液,冷冻干燥后备用。
1.3.9 水解条件正交试验
为研究不同水解温度、pH值、水解时间、酶添加量对柠条籽蛋白水解效果的影响,以选择最佳水解工艺条件,根据单因素试验结果,进行4因素3水平正交试验,为得到的酶解产物是具有较强抗油脂氧化能力的小分子质量短肽,而不只是单纯地追求高水解度指标,以亚油酸氧化抑制率为正交指标,因素与水平设计见表1。
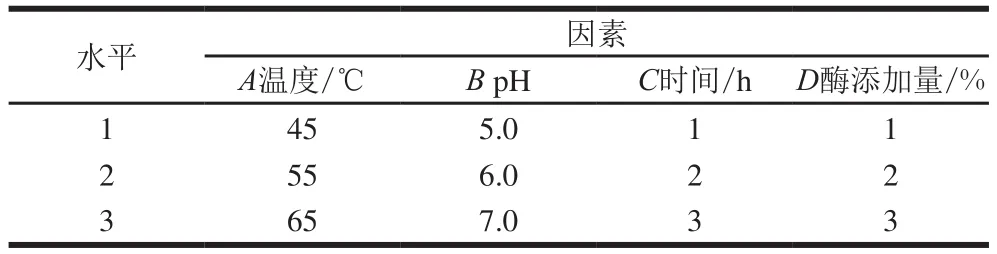
表1 正交试验因素与水平Table 1 Code and level of independent variables used in orthogonal array design
1.3.10 质谱鉴定多肽序列
以筛选所得蛋白酶,配合确定的水解条件,水解柠条籽蛋白,水解物超滤至3 kDa,利用液相色谱-质谱联用,进行多肽序列的测定,将采集到的原始数据用De Novo软件进行分析、鉴定序列。序列采集采用高效液相色谱仪,色谱柱采用C18(75 μm×15 cm)。采用流动相A为0.1%甲酸溶液,B为0.1%甲酸-80%乙腈溶液,进行梯度洗脱(表2)。质谱条件为喷雾电压2.1 kV;毛细管温度320 ℃;母离子扫描范围m/z350~1 550;子离子扫描m/z110。

表2 多肽序列测定色谱梯度Table 2 Gradient elution program for HPLC determination of peptide sequence
1.3.11 柠条籽抗氧化肽油脂抗氧化评价
为验证计算机辅助定向制备柠条籽抗氧化肽新工艺的可行性,从质谱鉴定的柠条籽多肽序列中选取含有活性片段的柠条籽抗氧化肽进行验证,以抑制亚油酸氧化能力作为评价柠条籽抗氧化肽抗油脂氧化指标,以商业抗氧化剂TBHQ为对照。将加入1 mg/mL柠条籽抗氧化肽和加入1 mg/mL TBHQ的亚油酸乳化液分别置于37 ℃进行氧化。各取氧化液0.1 mL,分别与4.7 mL 75%乙醇溶液、0.1 mL 3.9 mol/L硫氰酸铵溶液和0.1 mL 0.02 mol/L硫酸亚铁溶液(溶于0.1 mol/L HCl溶液)混合,室温下放置3 min,在500 nm波长下测定OD值,按式(3)计算抑制率。
1.4 数据处理
所有数据均为3 次平行测定结果的平均值。Microsoft Office Excel 2010软件用于数据分析。
2 结果与分析
2.1 柠条籽主要营养成分
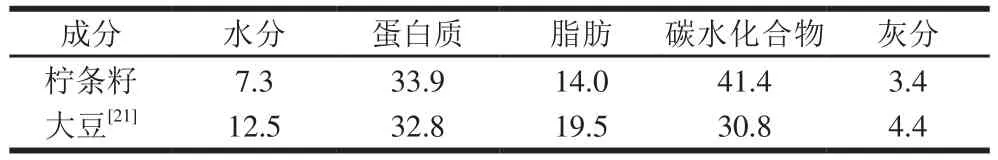
表3 柠条籽的主要营养成分及质量分数Table 3 Main nutrient components and their contents in Caragana seeds%
如表3所示,柠条籽的蛋白质和碳水化合物含量较为丰富,灰分含量较少。与大豆主要营养成分的含量相比,柠条籽的蛋白质、脂肪、碳水化合物含量均与大豆相似,大豆的粗蛋白质量分数平均为40%,脂肪质量分数约为18%~22%,碳水化合物质量分数为22%~35%[21]。由此看来,柠条籽可效仿大豆进行开发,提供丰富的蛋白资源。
柠条籽蛋白的分子质量集中分布于10~70 kDa之间(图1),由柠条籽中分离所得的谷蛋白、醇溶蛋白、球蛋白、清蛋白,4 种类型蛋白与柠条籽蛋白分布相同,其中谷蛋白的分子质量分布与柠条籽蛋白最为贴合,因此可以得出谷蛋白是柠条籽蛋白的主要蛋白类型。谷蛋白中以谷氨酸含量最为丰富[22],通过测定柠条籽蛋白中的氨基酸组成及含量(表4),证实了谷氨酸和天冬氨酸是其含量最高的2 种氨基酸,分别为4.4%和2.5%,说明柠条籽蛋白是制备富含酸性氨基酸抗氧化肽的理想蛋白原料。
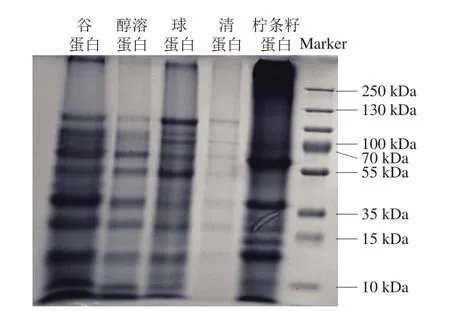
图1 柠条籽蛋白及各组分蛋白的分子质量分布Fig.1 Molecular mass distribution of Caragana seed protein components
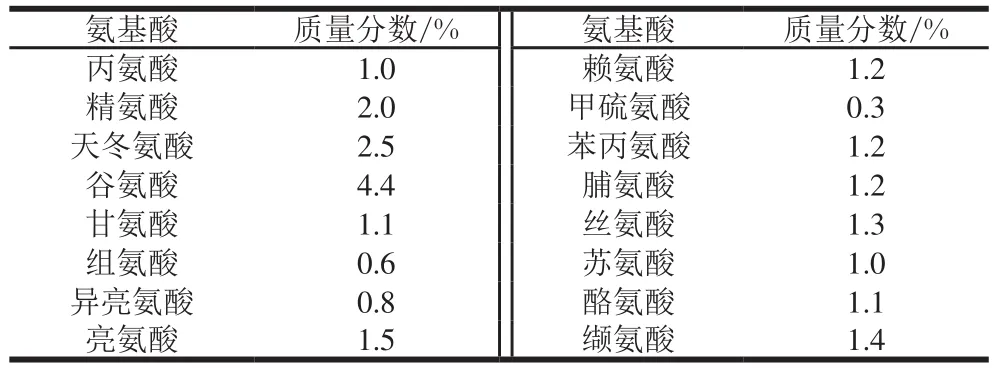
表4 柠条籽蛋白的氨基酸组成Table 4 Amino acid composition of Caragana seed protein
2.2 水解酶的选择
谷蛋白富含酸性氨酸,且是柠条籽蛋白主要蛋白类型,因此,本研究以谷蛋白作为柠条籽蛋白的生物信息模板,在BIOPEP数据库内搜索已知谷蛋白序列5 条,并选择木瓜蛋白酶、胃蛋白酶、胰蛋白酶、V-8蛋白酶、木瓜蛋白酶+V-8蛋白酶分别对5 条谷蛋白序列虚拟水解,选取水解度较高的蛋白酶水解柠条籽蛋白。木瓜蛋白酶、胃蛋白酶、胰蛋白酶均为水解植物蛋白时常用的蛋白酶。通过表5可以看出,木瓜蛋白酶对几种谷蛋白的水解度均超过40%,而胃蛋白酶、胰蛋白酶的水解度平均为10%。这是由于木瓜蛋白酶具有更广泛的水解位点,根据BIOPEP的数据,木瓜蛋白酶的酶切位点主要是蛋白N端的谷氨酰胺和丙氨酸,蛋白C端的精氨酸、苯丙氨酸、亮氨酸、甘氨酸及苏氨酸;胃蛋白酶主要作用于蛋白C端的苯丙氨酸和亮氨酸;胰蛋白酶切割位点为蛋白C端的赖氨酸和精氨酸。所以,木瓜蛋白酶的水解度较其他两个蛋白酶更高一些,本实验将选用木瓜蛋白酶作为主要蛋白酶来水解柠条籽蛋白。
为制备富含酸性氨基酸的抗氧化肽,实验还选取了酶切位点为蛋白C端谷氨酸和天冬氨酸的V-8蛋白酶,与木瓜蛋白酶共同水解柠条籽蛋白。经在线软件虚拟水解,木瓜蛋白酶与V-8蛋白酶复合对水解度的提高影响不大(表5)。

表5 不同蛋白酶对谷蛋白水解度Table 5 Hydrolysis degrees of gluten by different proteases%
为验证数据库软件模拟结果并确定V-8蛋白酶的添加量,将V-8蛋白酶以0%的添加量为起始,与木瓜蛋白酶进行复配,以10%为增加幅度,不断增加添加量至与木瓜蛋白酶等量即50%,对柠条籽蛋白进行水解,所得的水解度、蛋白水解物的亚油酸氧化抑制率如图2所示。
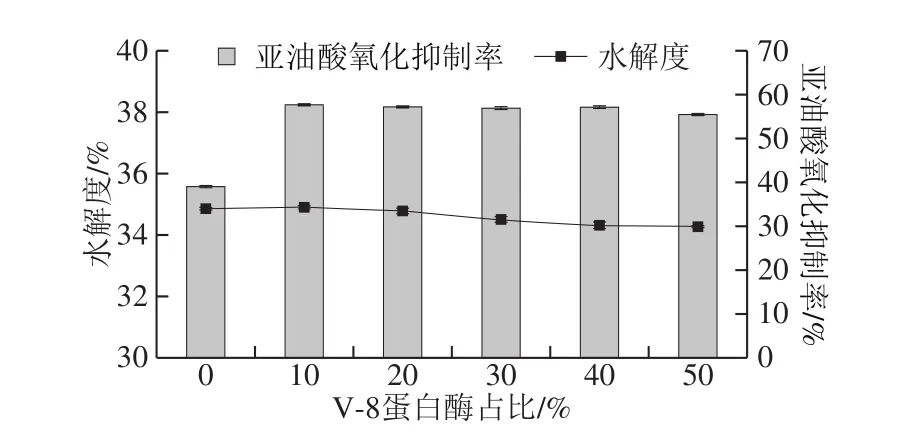
图2 水解度及亚油酸氧化抑制率随V-8蛋白酶占比的变化趋势Fig.2 Effect of papain and V-8 protease mixtures on degree of hydrolysis and inhibito rate ags llc cd xd
从水解度方面看,只添加木瓜蛋白酶时,水解度为34.8%,接近40%,与数据库软件模拟得到的结果类似。而V-8蛋白酶的加入对水解度没有提高,这与模拟结果相同,说明数据库软件模拟结果是可信的。加入10% V-8蛋白酶后水解度为34.9%,随着V-8蛋白酶的逐渐增加,水解度未升高反而有所下降(图2),说明木瓜蛋白酶的减少对水解度有一定影响,因此用木瓜蛋白酶作为主要水解蛋白酶是正确的。
从亚油酸氧化抑制率方面看(图2),未加入V-8蛋白酶时,木瓜蛋白水解物的亚油酸氧化抑制率为38.9%,而加入10% V-8蛋白酶后,亚油酸氧化抑制率提升至57.4%,但随着V-8蛋白酶的添加量增加,其亚油酸氧化抑制率却没有再提高。
综合上述两方面的数据,数据库软件模拟水解可以应用于筛选目标蛋白酶,且V-8蛋白酶的加入确实有助于提高蛋白水解物的抗油脂氧化活性。据此,本实验将选用木瓜蛋白酶为主要蛋白酶,并复配10%的V-8蛋白酶作为辅助,定向水解柠条籽蛋白,以获得高活性抗氧化肽。
2.3 最佳水解工艺的确定
本研究确定选用木瓜蛋白酶和V-8蛋白酶共同作为水解酶,以水解度为指标,讨论温度、pH值、水解时间以及酶添加量4 个因素对水解效果的影响,在单因素试验的基础上,进行4因素3水平的正交试验,并以亚油酸氧化抑制率为评价指标,确定最佳的水解工艺。
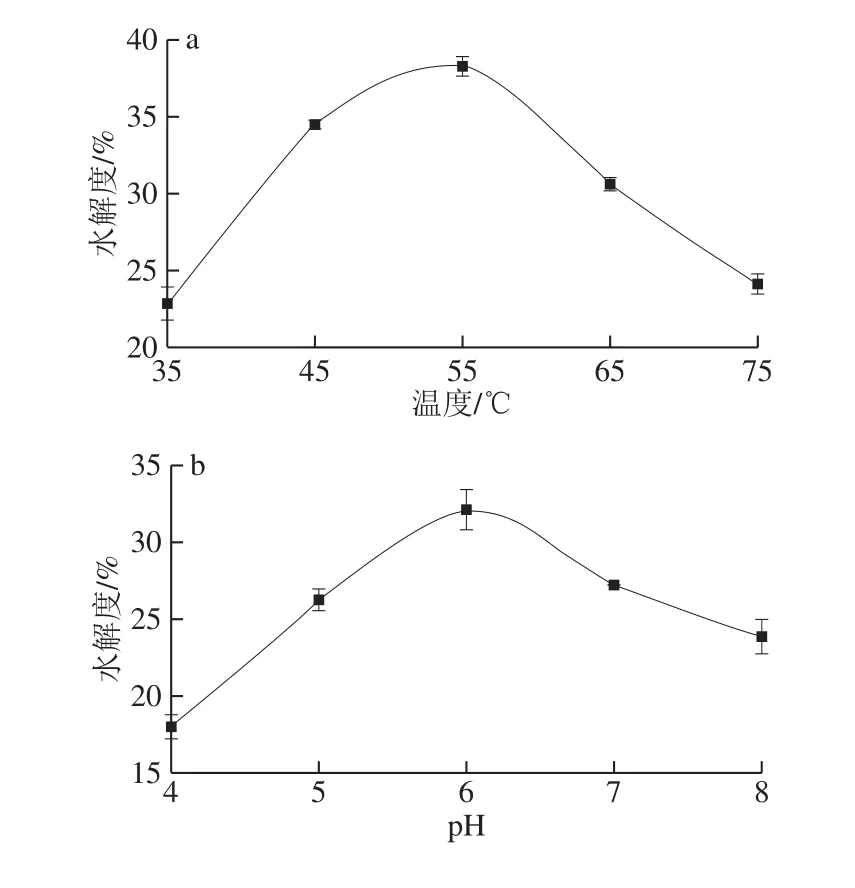
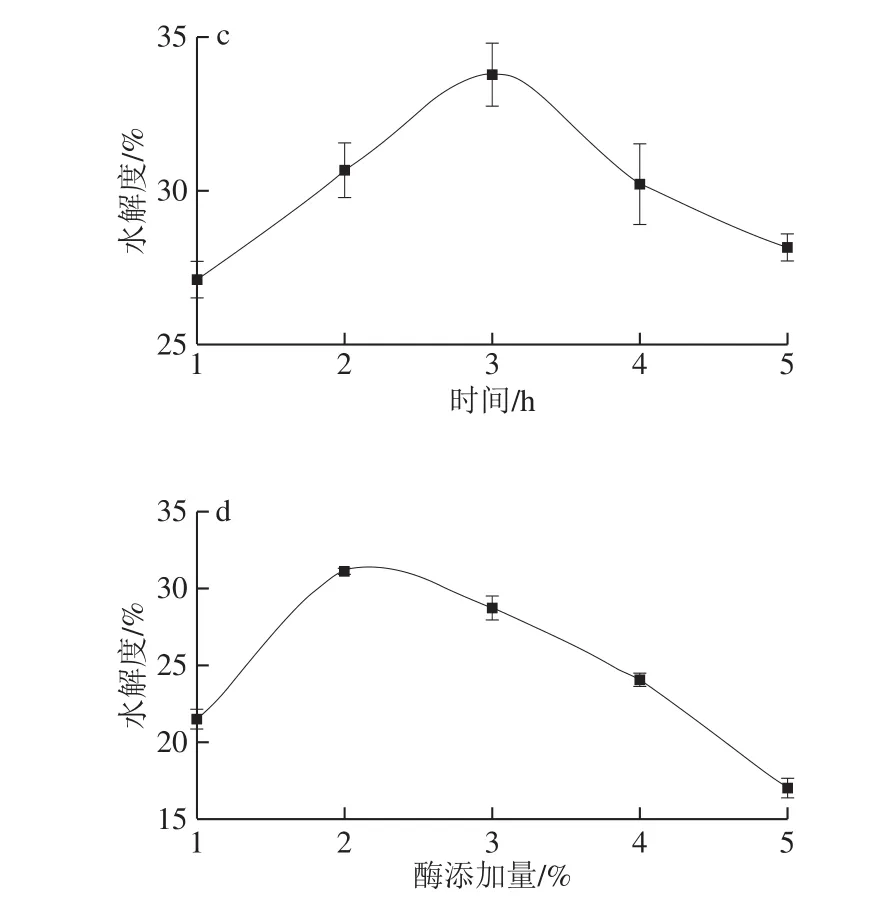
图3 水解度随温度(a)、pH值(b)、时间(c)和酶添加量(d)变化曲线Fig.3 Effect of temperature (a), pH (b), time (c) and enzyme dosage (d) on degree of hydrolysis
如图3a所示,温度对水解效果影响较大,随着温度不断升高,水解度不断增加,55 ℃达到最大值,继续升高则水解度下降,表明最适水解温度为55 ℃。如图3b所示,pH值对水解效果影响较显著,各类蛋白酶等电点不一样,均有最适pH值范围,只有在最适范围内,酶的活性才能达到最大值。结果表明,木瓜蛋白酶与V-8蛋白酶的组合水解的最适pH值为6.0。如图3c所示,随着水解时间的延长,水解度呈缓慢增长趋势,3 h时达到最高值。如图3d所示,随着酶与底物浓度之比的增加,水解度先增加后减小,酶添加量为2%时,水解度最高,随后呈下降趋势。
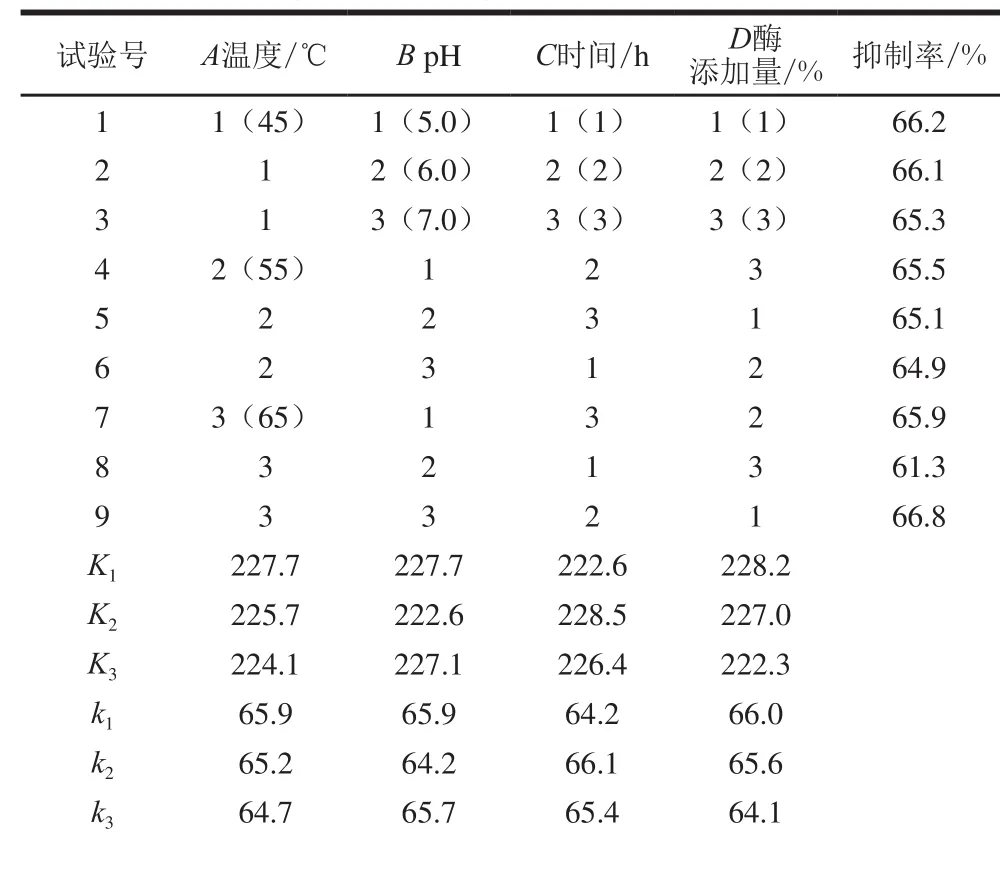
表6 正交试验设计与结果Table 6 Orthogonal array design and analysis of experimental results

极差R 1.2 1.7 1.9 1.9最优水平 A1 B1 C2 D1影响顺序 D>C>B>A
通过正交试验的结果分析(表6),最优水平为A1B1C2D1,即温度45 ℃、pH 5.0、时间2 h、酶添加量1%,与图3单因素试验中以水解度作为水解效果指标得到的结果,正交试验的工艺条件均降低了一个水平,这说明仅用水解度为评价指标优化柠条籽蛋白水解工艺条件是片面的,高水解度会导致蛋白水解物中含有较多的游离氨基酸,不利于制备具有特定功能的小分子肽[23],应配合抗氧化能力大小对水解效果进行综合评定。吕桂善等[23]在水解酪蛋白过程中发现水解度与血管紧张素转化酶抑制肽活性之间无相关性;张强等[24]也发现水解度与玉米肽清除自由基能力之间无线性关系。所以本研究以亚油酸氧化抑制率作为优化水解柠条籽蛋白的指标是正确的。
根据极差结果,影响亚油酸氧化抑制率的因素顺序为:酶添加量>时间>pH值>温度。由方差分析也可看出(表7),酶添加量对柠条籽蛋白的水解效果具有显著性差异,水解时间与pH值次之,具有较显著差异,温度的影响较小,方差分析显示结果差异不显著。
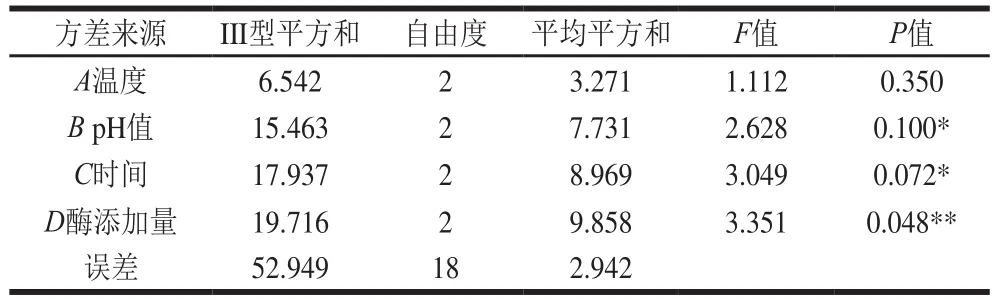
表7 方差分析Table 7 Analysis of variance
2.4 柠条籽抗氧化肽油脂抗氧化评价
利用优化水解工艺得到柠条籽蛋白水解物,经液相色谱-质谱联用及软件分析,鉴定到多肽序列7 199 条,其中包含数据库软件模拟活性片段的序列占90%,这些多肽序列中含有30%以上酸性氨基酸的序列约占40%。表8列出了部分柠条籽多肽序列,可以看出,这些序列都包含了虚拟水解得到的活性片段Q、QE、QYE、E、D、AE、QG等。

表8 柠条籽蛋白酶解物序列信息Table 8 Sequences of antioxidant peptides derived from Caragana seeds protein hydrolysate

AE- KFLEREADEPVSD
实验选取了一条包含活性片段的柠条籽抗氧化肽LDEPDPL进行油脂抗氧化的评价。油脂的自动氧化是指室温下,油脂中不饱和脂肪酸与空气中氧未经直接光照,未加催化剂的条件下完全自发进行的反应[25]。亚油酸分子含有2 个双键,是一种极易被氧化的不饱和脂肪酸,因此亚油酸体系的自动氧化反应常作为油脂抗氧化的评价[26]。如图4所示,柠条籽抗氧化肽的亚油酸氧化抑制率可达到50.3%,与同等浓度化学抗氧化剂TBHQ有类似效果,说明根据数据库软件虚拟水解结果筛选抗氧化肽是一种可行的方法。
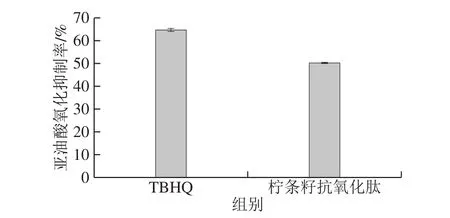
图4 柠条籽抗氧化肽对亚油酸氧化的抑制率Fig.4 Linoleic acid oxidation inhibitory rate of the selected antioxidant peptide derived from Caragana seed protein
3 讨 论
制备食源性活性肽的经典途径是利用多种酶水解不同来源的蛋白质,优化水解过程,然后根据活性进行多步分离和纯化,最后鉴定结构[27]。该方法耗时且劳动强度大,对蛋白质来源、蛋白酶的选择缺乏目的性[27]。生物信息学方法已广泛应用于医学的药物功效评价与种类筛选中,如血管紧张素转化酶抑制肽的筛选。Lafarga等[28]利用计算机辅助鉴定新的二肽基肽酶-IV和血管紧张素-I-转换酶抑制肽。首先从数据库中确定所选肉蛋白的序列,然后比较这些序列的共性。之后进行计算机模拟消化,通过与已知蛋白质序列对比,筛选出未知序列,然后预测这些序列的潜在生物活性和毒性,最后合成所选序列并鉴定其活性。
由于抗氧化能力测定标准缺乏统一性[29-31],因此通过生物信息学方法筛选抗氧化肽的研究报道很少。鉴于抗氧化肽序列中含有酸性氨基酸可以提升其延缓油脂氧化的能力[4-5],本实验借助生物信息学建立了一个筛选延缓油脂氧化的抗氧化肽的方法。通过检测柠条籽蛋白的类型及氨基酸组成,首先确定了柠条籽蛋白作为筛选酸性氨基酸抗氧化肽的蛋白来源。之后利用数据库软件虚拟水解,选定了水解柠条籽蛋白的目标蛋白酶,即木瓜蛋白酶复配V-8蛋白酶,并用实验证实了模拟结果,确定了V-8蛋白酶的使用量。木瓜蛋白酶作为主要水解酶,具有广泛的水解位点,主要负责提升水解度;V-8蛋白酶的加入,释放了大量酸性氨基酸,提升了柠条籽水解物的亚油酸氧化抑制率,酸性氨基酸能够螯合金属离子[4]、清除自由基、阻止油脂进一步氧化。为进一步确定该方法可以筛选目标抗氧化肽的可行性,借助实验鉴定了水解后的柠条籽抗氧化肽,结果与数据库软件模拟的一致,证实柠条籽抗氧化肽序列包含了模拟得到的活性片段,确实具有延缓油脂氧化的效果,说明该方法可以作为筛选和制备抗氧化肽的一种应用技术。
综上,本研究结论如下:1)选择富含酸性氨基酸的柠条籽蛋白,结合计算机辅助水解法可以筛选延缓油脂抗氧化肽的蛋白酶组合,即木瓜蛋白酶+10% V-8蛋白酶;该组合酶的水解度为34.9%,适宜水解条件为温度45 ℃、pH 5.0、时间2 h和酶添加量1%。经过此水解工艺获得的抗氧化肽LDEPDPL的亚油酸氧化抑制率为50.3%,与相同浓度化学抗氧化剂TBHQ有类似的抗氧化效果。2)通过选择富含酸性氨基酸的蛋白来源,结合生物信息手段筛选目标蛋白酶,可以建立定向制备延缓油脂氧化的抗氧化肽工艺,获得目标抗氧化肽,这种工艺不仅简化了抗氧化肽的制备方式,而且为利用柠条籽蛋白开发抗氧化活性肽提供了依据。

