喹啉杂合体的抗耐药肿瘤活性
王丽平,邓桂英,徐沙丽
(华中科技大学同济医学院附属梨园医院神经内科,武汉 100191)
1 前言
肿瘤细胞的耐药性可分为原发性耐药和获得性耐药,耐药机制包括靶基因突变、靶基因扩增、DNA损伤修复能力差异和药物进入肿瘤细胞内浓度减少等[1-2]。肿瘤细胞耐药性的产生是化疗失败的主要原因之一,严重影响癌症患者的寿命和生活质量[3]。因此,研发对耐药肿瘤细胞具有优秀活性的新型抗肿瘤药物显得尤为重要。
喹啉(图1)类化合物广泛存在于自然界中,具有抗疟疾[4]、抗病毒[5]、抗菌[6]、抗结核[7]和抗肿瘤[8]等广谱生物活性。研究发现,这类化合物可通过抑制血管生成、细胞凋亡、细胞周期停滞和破坏细胞迁移等多种作用机制发挥抗肿瘤活性,对包括耐药肿瘤细胞在内的多种肿瘤细胞具有良好的活性[9-10]。值得一提的是,多个喹啉类化合物如Voreloxin (可用于治疗耐顺铂卵巢癌患者)和Tasquinimod (可用于治疗耐药性前列腺癌)已用于临床治疗耐药肿瘤[11-12]。此外,喹啉母核可供修饰的位点较多,在发现全新结构骨架愈发困难的今天,喹啉已成为各国竞相研究的热点结构片段。
近年来,杂合体策略在抗肿瘤新药研发领域得到了广泛应用,这是由于杂合体分子具有克服耐药性和降低毒副作用的潜力[13-14]。事实上,喹啉类杂合体如安罗替尼(喹啉-吲哚杂合体)、来那替尼(喹啉-吡啶杂合体)、吡咯替尼(喹啉-吡啶杂合体)和宁格替尼(喹啉-吡唑酮杂合体)已用于临床治疗各种癌症或正处于临床研究阶段。显然,合理设计喹啉类杂合体是寻找新型抗耐药肿瘤药物的有效途径。本文将着重介绍喹啉杂合体在抗耐药肿瘤领域的最新研究进展,以期为设计和开发具有高活性的喹啉杂合体指明方向。
图1 喹啉母核的化学结构
2 喹啉杂合体的抗耐药肿瘤活性
喹啉-咔唑杂合体1(图2,IC50:0.9~3.0nmol/L)具有极为优秀的抗药敏型HCT116,A549,U87-MG和K562及耐药型K562R (耐阿霉素)和HT-29 (耐考布他汀)肿瘤细胞活性,其抗药敏型肿瘤细胞活性是对照药考布他汀(IC50:2.8~>200 nmol/L)的1.4->66.6倍,抗耐药肿瘤细胞活性是考布他汀(IC50:25和>8000 nmol/L)的27.7和>2666.6倍[15]。不仅如此,该杂合体对耐药肿瘤细胞K562R的活性(IC50:0.9 nmol/L)优于对相应药敏型K562肿瘤细胞活性(IC50:2.0 nmol/L)。构-效关系研究发现,用吲哚取代咔唑时将会导致活性降低,尤其对耐药肿瘤细胞活性下降的最为明显;用氰基代替喹啉C-2位的甲基所得的杂合体也具有良好的活性,提示此位置的甲基并非高活性所必需;喹啉片段也并非高活性所必需,可被多个芳香环取代。作用机制研究结果表明,该杂合体可抑制微管蛋白聚合,阻滞肿瘤细胞G2/M期,诱导细胞凋亡。该杂合体(IC50:0.81nmol/L)对人脐静脉内皮细胞(HUVEC)的活性极高,优于考布他汀(IC50:1.7nmol/L)。肝微粒体代谢稳定性试验结果表明,该杂合体代谢稳定性良好。显然,此类化合物极具进一步开发前景。
初步研究表明,两个碳和五个碳链接的5H-吲哚并[2,3-b]喹-O-氨基糖苷杂合体2a,b(IC50:0.264~2.76μmol/L)和3a,b(IC50:0.35~3.06μmol/L)对药敏型KB、A549、MCF-7和Hs294T肿瘤细胞具有潜在的活性,但杂合体2a,b(IC50:0.316和0.28μmol/L)对正常BALB/3T3细胞的毒性远高于杂合体3a,b(IC50:2.20和1.20μmol/L)[16]。进一步研究发现,杂合体3a,b(IC50:0.122~3.58μmol/L)还对药敏型HL-60,MESSA和LoVo及其对应耐多药HL-60/MX2,MESSA/DX5和LoVo/DX肿瘤细胞具有潜在的活性。因此,杂合体3a,b可作为先导物进一步优化。
7-苯基-6,9-二氢-3H-吡咯并[3,2-f]喹啉-9-酮4具有潜在的抗药敏型HeLa、HepG2、H295R、Ovcar-3、MCF-7、Aro、A549、HT-29、PT-45、OE-19、OE-33及耐紫杉醇A549-T12和A549-T24肿瘤细胞活性,IC50为0.007~2.0μmol/L[17-18]。构-效关系研究结果表明,将喹啉C-7位的苯环移至C-2位对活性不利[19]。代表物4a,b(IC50:7~70nmol/L)对所测所有药敏型和耐药型肿瘤细胞的活性极高,IC50在纳摩尔级,且对大多数尤其是耐药肿瘤细胞的活性与紫杉醇(IC50:0.2~102nmol/L)相当或更优。作用机制研究发现,这类杂合体可阻滞A549肿瘤细胞的G2/M期,导致肿瘤细胞凋亡。

图2 喹啉杂合体1~6的化学结构
喹啉并呋喃杂合体5(IC50:28.40~110.86μmol/L)也具有潜在的抗药敏型CCRF-CEM、MDA-MB-231、HCT116(p53+/+)、UG87MG及其对应耐药型CEM/ADR5000、MDA-MB-231/BCRP、HCT116(p53-/-)和UG87MG.ΔEGFR肿瘤细胞活性,但活性普遍弱于对照药阿霉素(IC50:0.02~66.83μmol/L)[20]。1,3,4-噁二唑连接的喹啉-呋喃杂合体STX-0119(6)具有潜在的抗药敏型GB-SCC010、GB-SCC026、GB-SCC028、U87和耐替莫唑胺U87肿瘤细胞活性,IC50分别为6.6~26.1μmol/L和43μmol/L[21-23]。作用机制研究结果显示,该杂合体可抑制信号传导及转录激活蛋白3 (STAT3),诱导肿瘤细胞凋亡。在移植GB-SCC010和耐替莫唑胺U87肿瘤细胞的小鼠模型中,该杂合体也显示出良好的体内活性。与替莫唑胺组相比,STX-0119组(口服给药,40mg/kg)可抑制小鼠体内>50%的肿瘤细胞生长,同时将小鼠的寿命由53.0d延长至87.2d。
喹啉-噻唑杂合体Capzimin(7,图3)是潜在的蛋白酶体异肽酶Rpn11抑制剂,其对源自白血病、非小细胞肺癌、中枢神经系统癌、结肠癌、乳腺癌、肾癌、前列腺癌、卵巢癌和黑色素瘤等60株肿瘤细胞和耐硼替佐米肿瘤细胞具有广谱活性,其平均50%生长抑制所需的药物浓度(GI50)为3.3μmol/L[24]。研究发现,间变性淋巴瘤激酶(ALK)是非小细胞肺癌的关键启动癌基因之一[25]。喹啉-吡唑杂合体8(半抑制浓度/IC50:7.1~29.6nmol/L)不仅对野生型和突变型ALK具有极为优秀的活性,而且可通过抑制磷酸化蛋白激酶B(p-AKT)和磷酸化的细胞外信号调节激酶(p-ERK)发挥抗耐克唑替尼肿瘤细胞活性[26]。含有咪唑酮的喹啉杂合体Dactolisib(9)是由诺华开发的双重PI3K和mTOR抑制剂,可作用于p110α/γ/δ/β和mTOR[27-30]。研究表明,该杂合体不仅对药敏型LNCaP、DU145、PC3、A549、耐多西他赛PC3DR2和耐雷帕霉素A549肿瘤细胞具有良好的活性,而且与舒尼替尼、阿糖胞苷、地塞米松和环磷酰胺等化疗药物具有协同抗肿瘤作用。目前,该杂合体正处于II期临床试验阶段,有望于不久的将来为人类健康服务。
杂合体10a(IC50:0.6~17.4μmol/L)具有潜在的抗药敏型HCT-15、HCT-116、PC3、DU-145、MCF-7、MDA-MB-231、OV2008、A2780、HepG2、HT-29、LS-180、LS-174、LoVo和耐羧基喜树碱(SN-38) S1-M1-80肿瘤细胞活性[31]。其中,该杂合体(IC50:0.8μmol/L)对耐羧基喜树碱S1-M1-80肿瘤细胞的活性是羧基喜树碱(IC50:2.4μmol/L)和拓扑替康(IC50:4.0μmol/L)的3和5倍,且该杂合体(IC50:7.8~23.6μmol/L)对正常MDCK,NIH/3T3和HEK293细胞的毒性较低。进一步研究发现,用二甲/乙基胺基丙基取代嘧啶上的氯原子所得的杂合体10b(IC50:800.4和247.7nmol/L)和10c (IC50:680.1和200.5nmol/L)也具有极为优秀的抗耐药S1-M1-80和NCI-H460/MX-20肿瘤细胞活性[32]。作用机制研究结果发现,这类化合物可通过改变细胞线粒体膜电位诱导染色体DNA断裂和肿瘤细胞凋亡。
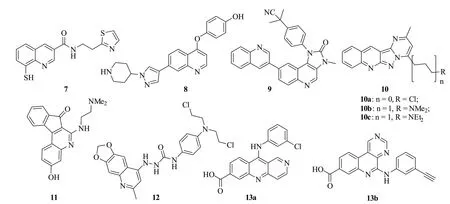
图3 喹啉杂合体7~13的化学结构
喹啉并茚酮杂合体TAS-103(11,IC50:0.033~2.70μmol/L)不仅对药敏型SBC-3、HL60和H69及耐药型SBC-3/ADM、SBC-3/CDDP、H-69/VP和耐米托蒽醌HL60/MX2肿瘤细胞具有潜在的体外活性,而且在移植耐多药SCLC肿瘤细胞的小鼠模型中也显示出了良好的活性(肿瘤生长抑制率>50%)[33-35]。显然,该杂合体极具进一步研究价值。
杂合体SL-1(12,IC50:0.14~5.49μmol/L)具有良好的抗HCT116、RKO、LS174T、LoVo、Colo205、DLD-1、HT-29、SW620、Caco-2、H3346和耐奥沙利铂RKO-E6肿瘤细胞活性,其活性为对照药顺铂(IC50:0.91~29.63μmol/L)、奥沙利铂(IC50:0.62~>50μmol/L)和5-氟尿嘧啶(IC50:2.27~>50μmol/L)的1.8~≥132.1倍[36]。在RKO肿瘤细胞移植的小鼠模型中,该杂合体 SL-1(静脉注射,30mg/kg)可抑制61.8%的肿瘤细胞生长,活性远优于对照药奥沙利铂(35.1%)和5-氟尿嘧啶(18.7%)。值得一提的是,当该杂合体与5-氟尿嘧啶联合给药时具有协同作用,可抑制体内77.5%的肿瘤细胞生长。不仅如此,该杂合体不会引起小鼠体重的变化,提示该杂合体安全性良好。优秀的体内外活性和良好的安全性使得该杂合体极具进一步开发前景。
Silmitasertib(CX-4945,13a,IC50:1.92~8.62μmol/L)和CX-5011(13b,IC50:2.01~>10μmol/L)对药敏型CEM,CEM*,U2OS,OV2008,LAMA84,K562,KCL22肿瘤细胞及其相应的耐药型肿瘤细胞也具有良好的体外活性,且Silmitasertib 对耐药肿瘤细胞的活性优于相应的药敏型肿瘤细胞,故该杂合体值得进一步研究[37-39]。
喹啉-砜杂合体B 392(14,图4,IC50:0.02~0.03μmol/L和0.32~14.03μmol/L)具有优秀的抗药敏型HL60,MOLT-4,CCRF-CEM和耐西罗莫司HL60,MV4-11,MOLM-13,MOLT-4,CCRF-CEM肿瘤细胞活性[40]。作用机制研究结果显示,该杂合体可通过抑制肿瘤细胞的有丝分裂和降低线粒体膜电位等诱导肿瘤细胞凋亡。在MOLT-4肿瘤细胞移植的小鼠模型中,该杂合体(口服给药,100mg/kg)可抑制体内83.3%的肿瘤细胞生长。
杂合体VR23(15,IC50:1.81~2.94μmol/L)不仅对药敏型naїve RPMI 8226,naїve ANBL6和耐硼替佐米RPMI 8226及ANBL6肿瘤细胞具有良好的体外抑制活性,而且在移植MDA-MB-231(肿瘤体积减小78.4%)和RPMI 8226(肿瘤体积减小80.9%)肿瘤细胞模型中也显示出极为优秀的体内活性[41-42]。进一步研究发现,该杂合体与紫杉醇联合使用时可显著地提高紫杉醇的体内活性。有趣的是,该杂合体不仅自身未对所试验小鼠的肝、脾、肾和肺器官产生任何可见的形态学改变,而且与紫杉醇联合使用时还可降低紫杉醇的毒性。显然,优良的体内外活性和良好的安全性及与紫杉醇的协同作用,使得该杂合体既可作为新型抗肿瘤药物单独开发,也可作为联合药物进行研究。
喹啉-多西他赛杂合体(IC50:8.8~49.3nmol/L)具有极为优异的抗HeLa、A549、A2780、MCF-7和耐多药A2780-MDR,MCF-7-MDR肿瘤细胞活性,且活性与母药多西他赛(IC50:33~180nmol/L)相当或更优[43]。其中,杂合体16a(IC50:8.8nmol/L)和16b(IC50:12.2nmol/L)分别是抗耐多药A2780-MDR和MCF-7-MDR肿瘤细胞活性最高的化合物,二者的活性分别是多西他赛(IC50:180和126nmol/L)的20.4和10.3倍,可作为先导物进一步研究。
5 结束语
化疗是治疗癌症最常用的策略之一,但是化疗往往会由于肿瘤细胞耐药性的产生而被迫终止。因此,研发对耐药肿瘤具有良好活性的新型抗肿瘤药物显得尤为重要。

图4 喹啉杂合体14~16的化学结构
喹啉类杂合体如安罗替尼和来那替尼已用于临床治疗各种癌症,而多个具有治疗耐药肿瘤潜力的杂合体也正处于临床评价阶段,有望于不久的将来为人类健康服务。显然,这类杂合体对开发尤其是对耐药肿瘤具有良好活性的新型抗肿瘤药物至关重要。本文综述了近年来喹啉类杂合体在抗耐药肿瘤领域的最新研究进展,发现多个杂合体具有良好的体内外活性和安全性,值得进一步研究。

