查耳酮-唑杂合体的抗肿瘤活性研究进展
樊静,王超,刘娜,张彦,张杰
(衡水学院,衡水 053000)
据统计,世界范围内每年近2000万人罹患癌症,与癌症相关的死亡每年高达近千万[1-2]。显然,癌症给世界各国医疗系统带来了沉重的负担。更为严峻的是,癌症对药物的耐药性日益严重,耐药肿瘤已成为临床医师所必需经常面对的棘手问题[3]。目前,已有多款候选物处于临床前或临床研究阶段,有望于不久的将来为人类健康服务。然而,候选物的数目仍不能满足人们日益增长的需求。因此,研发新型尤其是对耐药肿瘤具有优秀活性的抗肿瘤药物迫在眉睫。
查耳酮衍生物普遍存在于自然界中,在新药开发领域有着广泛的应用[4]。研究表明,这类化合物可作用于肿瘤细胞的核因子活化B细胞κ轻链增强子(NF-κB)、血管内皮生长因子(VEGF)、三磷酸腺苷结合转运蛋白G超家族成员2和乳腺癌耐药蛋白等多个靶点[5-6]。因此,此类化合物对耐药甚至耐多药肿瘤细胞具有潜在的活性[7-8]。唑类化合物包括1,2,3-三氮唑、1,2,4-三氮唑、咪唑、吡唑、噻唑、噻二唑、噁唑和四氮唑等可通过各种非共价键作用与药物靶点如极光激酶、细胞周期蛋白依赖性激酶、环氧化酶和热休克蛋白等相结合,具有包括抗肿瘤在内的多种生物活性[9-12]。特别值得一提的是,多个唑类衍生物如来曲唑、噻唑羧胺核苷何陶扎色替等已用于临床治疗各种癌症或处于临床评价阶段。显然,唑类化合物也是新型抗肿瘤药物的重要来源。
查耳酮-唑杂合体(图1)可能能够同时作用于查耳酮和唑的作用靶点,显示出协同作用,故有可能从中筛选出对包括耐药肿瘤在内的多种肿瘤具有良好活性的新型抗肿瘤药物候选物。基于此,近年来药物化学家设计合成并评价了多个系列查耳酮-唑的抗肿瘤活性,并筛选得到了若干具有优秀体内外抗肿瘤活性的候选物。本文将综述查耳酮-唑杂合体在抗肿瘤领域的最新研究进展,并总结构-效关系(SAR)和作用机制,为进一步研究提供理论支持。
1 查耳酮-吡唑杂合体
查耳酮-吡唑杂合体1a~d(图2,IC50:0.3~4.8μmol/L)具有良好的体外抗Huh7、MCF-7、HepG2、Mahlavu、SNU-475和HCT-116肿瘤细胞活性,且活性与克拉屈滨(IC50:0.3~2.0μmol/L)相当,优于5-氟尿嘧啶(IC50:1.4~21.0μmol/L)[13]。作用机制研究结果显示,这类杂合体可通过调控细胞周期相关蛋白和阻滞肿瘤细胞G2/M期诱导细胞凋亡。杂合体2(IC50:0.69~25.09μmol/L)也显示出潜在的抗HCT-116细胞活性,且代表物2a,b(IC50:0.69和0.93μmol/L)的活性与阿霉素(IC50:0.42μmol/L)相当[14]。SAR研究结果表明,与相应的无取代衍生物相比,向R1和R2位引入供电子基对活性有利,而吸电子基则对活性不利[14-16]。杂合体3a,b(IC50:3.30~9.91μg/mL)的抗MCF-7,HepG2和HCT-116肿瘤细胞活性也较强,且作用机制研究结果表明,二者可向上调节p53抑癌基因,阻滞MCF-7细胞的S-G2/M期,进而导致肿瘤细胞凋亡[17]。

图1 查耳酮-唑杂合体
对查耳酮-1,4-二氢茚并[1,2-c]吡唑杂合体4(IC50:3.82~20.50μmol/L)的体外抗MCF-7、A549、MDAMB-231、HCT-116和SKBR3肿瘤细胞SAR研究结果显示,R1和R2位为甲氧基时对活性有利[18]。进一步研究发现,R1位甲氧基的个数与活性正相关。作用机制研究结果表明,这类杂合体可抑制EGFR和蛋白激酶B (Akt)信号通路,阻滞A549细胞的G2/M期,进而导致肿瘤细胞死亡。代表物4a~c(IC50:3.82~6.94μmol/L)的抗MCF-7、A549、HCT-116和SKBR3肿瘤细胞略优于对照药厄洛替尼(IC50:3.98~12.42μmol/L),值得进一步研究。
含有1,2,3-三氮唑结构片段的查耳酮-吡唑杂合体5(IC50:3.2~57.9μmol/L)对人乳腺癌细胞MCF-7和MDA-MB-231具有潜在的活性,对正常VERO和MCF-10A细胞未显示出任何毒性(IC50:>100μmol/L)[19]。其中,杂合体5a,b(IC50:3.2~8.7μmol/L)的活性最高,但略弱于对照药阿霉素(IC50:0.9和1.1μmol/L)。

图2 查耳酮-吡唑杂合体1~5的化学结构
2 查耳酮-1,2,3-三氮唑杂合体
查耳酮-1,2,3-三氮唑杂合体6(图3,IC50:3.1~78.3μmol/L)与杂合体5相似对乳腺癌细胞MCF-7和MDA-MB-231也显示出潜在的活性,且对正常VERO和MCF-10A细胞无毒(IC50:>100μmol/L)[19-21]。SAR显示,与无取代的衍生物相比,无论向苯环引入吸电子基还是供电子基均可提高活性,且对位最适合引入取代基。进一步研究发现,卤素为最优取代基,但向苯环引入第二个卤素则会导致活性降低。其中,杂合体6a,b(图3,IC50:3.1~8.3μmol/L)的活性最高,可作为先导物进一步优化。
查耳酮-1,2,3-三氮唑杂合体7a,b(在浓度为10μmol/L时的生长抑制率分别为12.45%~99.73%和4.89%~92.41%)对源自白血病、非小细胞肺癌、中枢神经系统癌、结肠癌、乳腺癌、肾癌、前列腺癌、卵巢癌和黑色素瘤等60株肿瘤细胞具有广谱活性[22]。进一步研究发现,杂合体7a(IC50:240~960nmol/L)抑制RPMI-8226、SR、K562、M14、MCF-7和HCT-116肿瘤细胞的IC50在纳摩尔级,而对正常PCS-800-011,WS1,MCF-10A和CCD-18的毒性较低(IC50:17.15~30.09μmol/L),选择性指数为30.3~104.1。作用机制研究结果表明,杂合体7a可通过产生活性氧(ROS)和激活半胱天冬酶-3,-7和-9等激发基线粒体凋亡通路,阻滞G2/M期,诱导细胞凋亡。

图3 查耳酮-1,2,3-三氮唑杂合体6~17的化学结构
醚键连接的查耳酮-1,2,3-三氮唑杂合体8(IC50:0.9~6.2μmol/L)具有良好的抗肝癌细胞HepG2、SNU-423、SMMC7221和SNU-398活性,且活性明显高于对照药5-氟尿嘧啶(IC50:9.2~17.9μmol/L)[23]。作用机制研究结果表明,该杂合体可抑制微管蛋白聚合。在HepG2抑制小鼠模型中,该杂合体可抑制体内60.03%的HepG2细胞生长,且所测试小鼠体重与对照组无显著差异。优秀的体内外活性和良好的安全性,使得杂合体8可作为抗肝癌候选物进一步研究。
杂合体9a,b(GI50:1.3~8.2μmol/L)具有潜在的抗A549、HeLa、DU145和HepG2肿瘤细胞活性,但活性弱于对照药CA-4(GI50:0.06~0.08μmol/L)[24]。作用机制研究结果表明,这类杂合体可抑制微管蛋白聚合、降低线粒体膜电位及激活半胱天冬酶-3和-9,阻滞G2/M期,导致细胞死亡。杂合体10(IC50:4~11μmol/L)的抗MCF-7,MIA-Pa-Ca-2,A549和HepG2肿瘤细胞活性与对照药PI-103(IC50:3~8μmol/L)相当,且作用机制研究结果表明,此化合物可降低线粒体膜电位,阻滞MIA-Pa-Ca-2细胞G2/M期,诱导细胞凋亡[25]。杂合体11a,b(IC50:<100nmol/L)具有极为优秀的抗KO-AS45-1细胞活性,且对正常WI-26-VA4细胞无毒(IC50:>100μmol/L),选择性指数>1000[26]。作用机制研究结果表明,这类化合物可诱导TP3致癌基因表达,进而诱导细胞凋亡。杂合体12a~c(IC50:1.52~10.42μmol/L)的抗EC-109,SK-NSH和MGC-803肿瘤细胞活性不亚于5-氟尿嘧啶(IC50:7.22~10.32μmol/L),可作为先导物进一步优化[27]。
杂合体13(IC50:1.53~17.13μmol/L)的抗SK-N-SH,HepG2和MGC-803肿瘤细胞活性高于其衍生物14(IC50:5.47~>64μmol/L),提示查耳酮母核中的吡啶片段对活性有利[28-29]。SAR显示,1,2,3-三氮唑与查耳酮之间为胺基连接子时活性优于相应的醚基衍生物,且向1,2,3-三氮唑相连的苄基上引入吸电子基时对活性有利。代表物13a(IC50:1.53~2.73μmol/L)不仅活性是对照药5-氟尿嘧啶(IC50:7.22~10.32μmol/L)的2.6~6.7倍,而且其(IC50:31.13μmol/L)对正常GES-1细胞的毒性也低于5-氟尿嘧啶(IC50:7.22μmol/L)。作用机制研究结果表明,此杂合体可阻滞肿瘤细胞G1期,进而诱导细胞凋亡。杂合体15(IC50:17.11~69.90μmol/L)的抗IMR-32,DU-145和A549肿瘤细胞活性与对照药阿霉素(IC50:17.69~69.33μmol/L)相当,可作为先导物进一步研究[30]。
大多数查耳酮-苯并咪唑-1,2,3-三氮唑杂合体16(IC50:5.64~87.6μmol/L)对T47D,MDA-MB-231和PC3肿瘤细胞具有一定的活性,其中,化合物16a(IC50:5.89~10.7μmol/L)的活性最高,但仍弱于对照药阿霉素(IC50:0.13~1.51μmol/L)[31]。查耳酮-吲哚-1,2,3-三氮唑杂合体17(IC50:48.96~171.89μmol/L)的抗SiHa和SW-620肿瘤细胞活性也弱于阿霉素(IC50:1.39和1.86μmol/L),提示向查耳酮与1,2,3-三氮唑之间引入其它药效团似乎对活性不利[32]。
3 查耳酮-1,2,4-三氮唑杂合体
查耳酮-1,2,4-三氮唑杂合体18(图4,IC50:0.15~23.30μmol/L)对源自白血病、非小细胞肺癌、中枢神经系统癌、结肠癌、乳腺癌、肾癌、前列腺癌、卵巢癌和黑色素瘤的60株肿瘤细胞具有广谱活性[33]。SAR显示向R1和R3位引入供电子基对活性有利,向R2位引入烯丙基比苯基更优。作用机制研究结果表明,这类杂合体可通过提高促凋亡蛋白Bax水平、释放线粒体细胞色素c和激活半胱天冬酶-3,-8和-9等诱导细胞凋亡。代表物18a(IC50:0.15~6.58μmol/L)对所测的所有60株肿瘤细胞均敏感,对包括所有白血病、中枢神经系统癌、结肠癌和乳腺癌细胞在内的49株肿瘤细胞的IC50在纳摩尔级,值得进一步研究。
顺式查耳酮-1,2,4-三氮唑杂合体19(IC50:2.6~98.0μmol/L)的抗HeLa,A549和MCF-7肿瘤细胞活性略高于相应的反式衍生物20(IC50:3.0~>100μmol/L),且向R1位引入长烷基链和向苯环的对位(R2位)引入吸电子基对活性有利[34]。作用机制研究结果表明,这类杂合体可通过阻滞细胞G2/M和S期诱导细胞凋亡。代表物20a(IC50:3.3~4.5μmol/L)不仅对所测3株肿瘤细胞的活性是对照药紫杉醇(IC50:14.0~21.0μmol/L)的4倍以上,而且对正常HEK293细胞无毒(IC50:>100μmol/L),可作为先导物进一步优化。

图4 查耳酮-1,2,4-三氮唑杂合体18~20的化学结构
4 查耳酮-噻唑杂合体
查耳酮-噻唑杂合体21(图5,IC50:1.66~199.56μmol/L)对所测的9株药敏性(CCRF-CEM,MDA-MB-231,HCT-116(p53+/+),U87MG和HepG2)和耐药性(CEM/ADR5000,MDA-MB-231/BCRP,U87MG/ΔEGFR和HCT-116(p53-/-)肿瘤细胞具有潜在的活性,且抗CEM/ADR5000细胞活性(IC50:2.72~41.04μmol/L)高于阿霉素(IC50:66.83μmol/L)[35]。其中,代表物21a~d对所测9株肿瘤细胞的IC50<75μmol/L,可作为先导物进一步优化。
查耳酮-咪唑并[2,1-b]噻唑杂合体22对源自白血病、非小细胞肺癌、中枢神经系统癌、结肠癌、乳腺癌、肾癌、前列腺癌、卵巢癌和黑色素瘤的60株肿瘤细胞具有广谱活性,如代表物22a(IC50:0.26~4.74μmol/L)对所测的大多数肿瘤细胞具有优秀的活性[36]。作用机制研究结果表明,这类杂合体可通过阻滞细胞G0/G1期诱导细胞凋亡。杂合体23(IC50:0.64~1.44μmol/L)的抗MCF-7、A549、HeLa、DU-145和HT-29肿瘤细胞活性与阿霉素(IC50:0.81~1.65μmol/L)相当,作用机制研究结果表明,这类杂合体可通过阻滞细胞G2/M期诱导细胞凋亡[37]。
查耳酮-咪唑[2,1-b][1,3,4]噻二唑杂合体24(IC50:0.65~4.28μmol/L)的抗DU-145、MDA-MB-231、MCF-7和A549肿瘤细胞活性优于其位置异构体25(IC50:3.25~19.32μmol/L),提示查耳酮母核中羰基所处位置对活性有显著影响[38]。代表物24a,b (IC50:0.65~2.25μmol/L)和25a,b(IC50:3.25~6.68μmol/L)的活性最高,且杂合体24a,b的活性高于阿霉素(IC50:2.10~3.41μmol/L)。作用机制研究结果表明,杂合体24a,b可通过阻滞细胞G1/S期诱导细胞凋亡。
5 查尔酮-咪唑杂合体
查耳酮-咪唑杂合体26(图6,IC50:4.2~17.1μmol/L)、27(IC50:2.9~48.4μmol/L)和28(IC50:15.9~48.1μmol/L)具有潜在的抗HT29,MDA-MB-231和LNCaP肿瘤细胞活性[39]。其中,杂合体26(IC50:4.2~5.0μmol/L)和27(IC50:2.9~4.8μmol/L)的抗HT29和MDA-MB-231肿瘤细胞活性最高,但弱于阿霉素(IC50:0.164和0.120μmol/L)。杂合体29(IC50:5.39~14.67μmol/L)的抗HepG2,SK-N-SH和MGC-803肿瘤细胞活性与5-氟尿嘧啶(IC50:7.22~10.32μmol/L)相当[40],进一步研究发现,向查耳酮和咪唑之间引入醚键对活性影响不大,如杂合体30(IC50:2.99~12.56μmol/L)也具有潜在的抗肿瘤细胞活性[41]。
查耳酮-咪唑酮杂合体31(GI50:0.31~31.4μmol/L)对源自白血病、非小细胞肺癌、中枢神经系统癌、结肠癌、乳腺癌、肾癌、前列腺癌、卵巢癌和黑色素瘤的53株肿瘤细胞具有广谱活性,其中化合物31a~c(GI50:1.26~13.9μmol/L)的活性最高[42]。作用机制研究结果表明,这类杂合体可损伤肿瘤细胞DNA,并在 G0/G1期累积,阻滞G2/M期[43]。
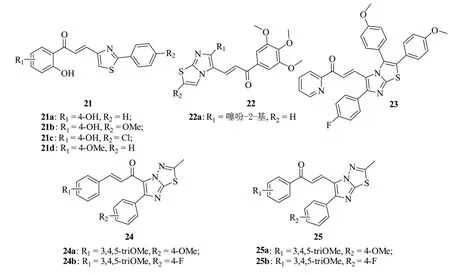
图5 查耳酮-噻唑杂合体21~25的化学结构
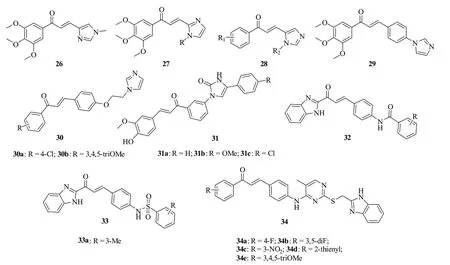
图6 查耳酮-咪唑杂合体26~34的化学结构
查耳酮-苯并咪唑杂合体32 (IC50:1.123~20.134μ mol/L ) 和33 (IC50:0.597~19.995μmol/L)的抗HCT116,MCF-7和143B肿瘤细胞SAR显示,磺酰胺比酰胺对活性更有利[44-45]。代表物33a(IC50:0.597~0.886μmol/L)的抗HCT116,MCF-7和143B肿瘤细胞活性是5-氟尿嘧啶(IC50:8.638~32.626μmol/L)的14.4~36.8倍,抗MCF-7和143B肿瘤细胞活性是紫杉醇(IC50:1.428和5.560μmol/L)的1.6和7.0倍,极具进一步研究价值。查耳酮-嘧啶-苯并咪唑杂合体34 (IC50:0.99~21.19μmol/L)的抗MGC-803,HepG2,EC-105和MDA-MB-231肿瘤细胞活性与5-氟尿嘧啶(IC50:6.58~16.64μmol/L)相当或更优,可作为先导物进一步优化[46]。
6 其它查尔酮-唑杂合体
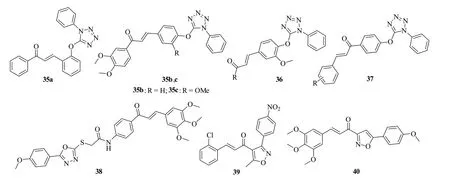
图7 查耳酮-唑杂合体35~40的化学结构
查耳酮-四氮唑杂合体35(图7,IC50:0.6~3.7μg/mL),36(IC50:2.5~31.4μg/mL)和37(IC50:12.0-42.4μg/mL)具有潜在的抗HCT-116,PC-3和MCF-7肿瘤细胞活性,且杂合体35(IC50:0.6~3.7μg/mL)和36(IC50:2.5~7.0μg/mL)的抗HCT-116和PC-3肿瘤活性与对照药顺铂(IC50:20.0和5.0μg/mL)和5-氟尿嘧啶(IC50:17.3和21.4μg/mL)相当或更优[47]。
查耳酮-噁二唑杂合体38对源自白血病、非小细胞肺癌、中枢神经系统癌、结肠癌、乳腺癌、肾癌、前列腺癌、卵巢癌和黑色素瘤的60株肿瘤细胞中的58株具有广谱活性,GI50为0.32~11.0μmol/L[48]。进一步研究发现,该杂合体(IC50:1.95~3.45μmol/L)对白血病细胞K-562,KG-1a和Jurkat的活性是对照药顺铂(IC50:3.21~15.12μmol/L)的1.6~6.4倍,值得进一步研究。
查耳酮-异噁唑杂合体39(IC50:1.35~2.07μmol/L)可通过死亡受体介导的凋亡途径诱导肿瘤细胞凋亡,具有潜在的抗肺癌细胞H175,A549和Calu-1活性,可作为治疗肺癌的先导物进一步优化[49]。杂合体40具有优秀的抗DU145、MDA MB-231、MCF-7和A549肿瘤细胞活性,IC50为0.96~3.29μmol/L,值得进一步研究[50]。
7 结束语
查耳酮和唑类化合物均具有潜在的抗肿瘤活性,而查耳酮-唑杂合体可能能同时作用于查耳酮和唑的作用靶点,故查耳酮-唑杂合体具有提高抗肿瘤活性、拓展抗肿瘤活性谱和克服耐药性的潜力。近年来,药物化学家设计合成并评价了多个系列查耳酮-唑杂合体的体内外抗肿瘤活性,发现(1)杂合体7a,11a,b和33a具有极高的体外抗肿瘤细胞活性,IC50在纳摩尔级;(2)杂合体18a、22a、31a~c和33a具有广谱活性;(3)杂合体21a~d对耐药肿瘤细胞敏感;(4)杂合体8具有良好的体内活性。基于此,查耳酮-唑杂合体可能在抗肿瘤领域大有作为,值得进一步研究。

