具有优秀体内外抗肿瘤活性的1,2,3-三氮唑杂合体的研究进展
(浙江仙居君业药业有限公司,仙居 317300)
1 前言
癌症是仅次于心脑血管疾病的第二大类致死性疾病[1]。据世界卫生组织(WHO)估计,仅2018年全球就新增1840万癌症病例,960万人因此死亡[2-3]。近年来受多种因素的影响,癌症的发病率和死亡率呈不断上升之势,据预计,2030年全球将会新增癌症病例超过2410万人,死亡1300万人[4]。我国也是癌症的高发国,10多年来,我国癌症发病率每年保持约3.9%的增幅,死亡率每年保持2.5%的增幅。2019年全国最新癌症报告指出,癌症死亡占据我国居民全部死亡人数的23.91%[5]。因此,癌症是严重威胁人类生命健康的重大疾病。但是,癌症不等于死亡:国际抗癌联盟认为,1/3的癌症可以预防、1/3的癌症患者如能早期诊断可以治愈、1/3的癌症患者可以通过治疗减轻痛苦、延长生命[6]。其中,抗肿瘤药物对癌症的防治至关重要。目前已上市的抗肿瘤药物有上百种[7-8],然而这些药物的特异性普遍较差,往往会导致各种副作用[9]。不仅如此,耐药性也是临床医生所必需的经常面对的棘手问题[10]。因此亟需开发特异性高、毒副作用低且对耐药肿瘤有效的新型抗肿瘤药物。
1,2,3-三氮唑药效团不仅合成方便,可由叠氮和炔基通过“点击化学”制得而且是羧酸、酯和酰胺等基团的生物电子等排体,可与多个生物靶点形成多种非共价键作用[11-12]。1,2,3-三氮唑衍生物具有抗菌[13-14]、抗结核[15-16]、抗病毒[17-18]、抗疟疾[19-20]和抗肿瘤[21-22]等多种生物活性,在新药研发领域占据重要地位。值得一提的是,某些含有1,2,3-三氮唑结构片段的药物已用于临床治疗各种疾病[23-24]。其中,非细胞毒抗肿瘤药物羧胺三唑(carboxyamidotriazole,CAI)具有抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡和抑制血管形成等作用[25-26],目前正处于临床评价阶段,有望于不久的将来为人类健康服务。
杂合体是将两个或多个药效团嵌入到一个全新分子中,使其与原分子相比具有更广的生物活性谱、更高的特异性、更强的抗耐药致病菌活性、更优秀的药代动力学性质和更低的毒副作用等诸多优点[27-28]。经过近30年的发展,杂合体策略日臻成熟,目前已有多个杂合体候选物进入临床评价阶段。因此,杂合体策略已成为目前新药研发领域的常用策略。
将具有抗肿瘤活性的1,2,3-三氮唑药效团与其它抗肿瘤药效团杂合无疑是获取新型抗肿瘤候选物的有效途径,故近年来药物化学家设计合成和评价了众多1,2,3-三氮唑杂合体的体内外抗肿瘤活性并从中筛选出了若干有苗头的候选物。本文将重点介绍具有优秀体外(半抑制浓度/IC50或50%生长抑制所需的药物浓度/GI50在纳摩尔级)或体内抗肿瘤活性的1,2,3-三氮唑杂合体的最新研究进展,以指导药物化学家更合理的设计此类杂合体。
2 1,2,3-三氮唑-唑杂合体
唑为含氮五元杂环芳香化合物,在新药研发领域有着极为广泛的应用。多个抗肿瘤药物如阿那曲唑、来曲唑和三唑巴坦等均含有唑结构片段,故有必要将1,2,3-三氮唑结构片段与唑杂合已获得新型抗肿瘤药物。
1,2,3-三氮唑-苯并咪唑杂合体1~3 (图1,IC50:50~62,140 nmol/L)具有潜在的体外抗A549,HeLa,CFPAC-1和SW620肿瘤细胞活性,且部分杂合体的IC50在纳摩尔级[29,30]。其中,代表物化合物1a (IC50:320~2,090 nmol/L)的活性与5-氟尿嘧啶(IC50:80~8,810 nmol/L)相当,可作为先导物进一步优化。对杂合体4(IC50:510~47,640 nmol/L)的抗A549,DU-145,HCT-116和MDA-MB-231肿瘤细胞系构-效关系(SAR)研究结果表明,除向R2位引入卤素对活性有利外,向R1和R2位引入其他取代基均对活性不利[31-32]。活性最强的杂合体4a,b (IC50:510~3,980 nmol/L)不仅活性不亚于诺考达唑(IC50:1,380~1,650 nmol/L),而且对正常人胚肾细胞HEK 293的毒性极低,IC50分别为63.53和91.25 μmol/L,选择性指数(SI)>20。部分杂合体5(IC50:788~63,090 nmol/L)的抗HeLa,DU-145,MCF-7和HepG2 肿瘤细胞活性也在纳摩尔级,且代表物5a,b (IC50:788~6,456 nmol/L)的活性与阿霉素(IC50:1,428~2,594 nmol/L)相当,值得进一步研究[33]。
1,2,3-三氮唑-吡唑杂合体6a~c (IC50:860~3,710 nmol/L)具有良好的抗A549,HT-29,PC3和U87MG肿瘤细胞活性,且活性可与5-氟尿嘧啶(IC50:2,420~3,610 nmol/L)相媲美[34]。而杂合体6d,e (GI50:130~730 nmol/L)的抗HeLa,MCF-7和MIAPaCa-2 肿瘤活性极高,优于诺考达唑(GI50:810~950 nmol/L)[35-36]。显然,这类杂合体具有进一步研究价值。
1,2,3-三氮唑-苯并[d]咪唑并[2,1-b]噻唑杂合体7 (IC50:607~35,7700 nmol/L)具有优秀的抗DU-145,HeLa,MCF-7,HepG2和A549肿瘤细胞系活性[37]。SAR显示,向R1位引入供电子基和R2位引入吸电子基均可提高抗肿瘤活性。其中,化合物7a,b (IC50:607~7,413 nmol/L)的活性最高,可作为先导物进一步优化。1,2,3-三氮唑-1,2,4-三氮唑杂合体8 (IC50:310~600 nmol/L)的抗ABC-DLBCL肿瘤细胞活性极高,且SAR显示2-氯乙酰胺基结构单元为高活性所必需的[38]。
某些1,2,3-三氮唑-1,3,4-噁二唑-2-酮杂合体9 (GI50:820~10,220 nmol/L)也具有潜在的抗HeLa,MDA-MB-231,DU-145和HepG2肿瘤细胞活性[39]。SAR显示,向R1位引入甲基对活性有利,而氯和溴将会导致活性降低。对R2位取代基而言,2-氟可提高活性,而4-甲基和4-硝基则对活性不利。其中,化合物9a~c (GI50:820~2,390 nmol/L)的活性最高,但仍远逊于紫杉醇(GI50:<16~50 nmol/L)和诺考达唑(GI50:<11~34 nmol/L)。
1,2,3-三氮唑-噁唑杂合体10 (IC50:10~510 nmol/L)抗Colo-205肿瘤细胞活性与依托泊苷(IC50:130 nmol/L)相当,而抗MCF-7,A549和A2780肿瘤细胞系活性则是依托泊苷(IC50:1.31~3.08μmol/L)的2.5~308.0倍[40]。1,2,3-三氮唑-吡唑杂合体11(IC50:340~890nmol/L)具有优秀的抗MCF-7,A549和A375肿瘤细胞系活性,其活性是对照药阿霉素(IC50:2.02~5.51μmol/L)的2.8~6.1倍,可作为先导物进一步研究[41]。
3 1,2,3-三氮唑-香豆素/黄酮杂合体
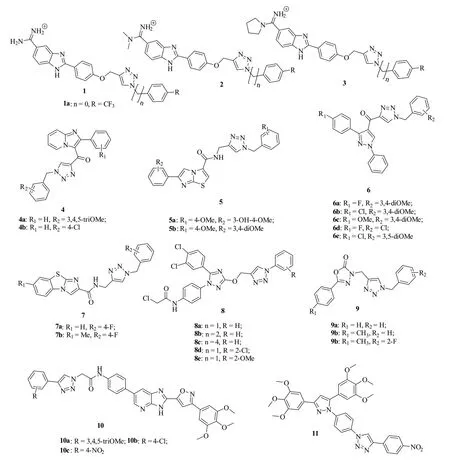
图1 1,2,3-三氮唑-唑杂合体1~11的化学结构
1,2,3-三氮唑-香豆素杂合体12(图2,IC50:30nmol/L)具有极为优秀的抗MDA-MB-231肿瘤细胞活性,其活性是阿霉素(IC50:600nmol/L)和顺铂(IC50:4680nmol/L)的20和156倍,极具进一步研究价值[42]。1,2,3-三氮唑-香豆素杂合体13(IC50:130~1740nmol/L)的抗PC3,MGC803和MepG2肿瘤细胞系活性是秋水仙碱(IC50:270~4600nmol/L)的约2倍[43-44],而含有磺胺药效团的1,2,3-三氮唑-香豆素杂合体14(图3,IC50:400~3500nmol/L)不仅体外抗MGC-803,BGC-823和SGC-7901肿瘤细胞系优于5-氟尿嘧啶(IC50:6.9~26.3μmol/L),而且在MGC-803肿瘤移植小鼠模型中在给药剂量为60mg/kg可抑制64.18%的肿瘤生长[45]。不仅如此,该杂合体并不会影响小鼠的体重,提示安全性良好。
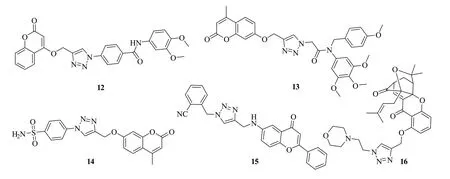
图2 1,2,3-三氮唑-香豆素/黄酮杂合体12~16的化学结构

图3 1,2,3-三氮唑-吲哚/吡啶/嘧啶杂合体17~26的化学结构
某些1,2,3-三氮唑-黄酮杂合体如化合物15(GI50:110~1000nmol/L)对MIA PaCa,IMR 32和MDAMB-231等肿瘤细胞也具有良好的活性,但活性弱于阿霉素(GI50:23-97nmol/L)和紫杉醇(GI50:25~91nmol/L)[46]。杂合体16(IC50:310~3750nmol/L)对药敏型A549、HepG2、HCT-116、U251及耐紫杉醇A549和耐顺铂A549均显示出潜在的活性,且活性与藤黄酸(IC50:290~4670nmol/L)相当[47]。在抑制A549的小鼠模型中,该杂合体可在静脉注射给药剂量为2*20mg/kg时可抑制71.32%的体内肿瘤细胞生长,优于5-氟尿嘧啶(给药剂量为2*20mg/kg时可抑制64.71%的肿瘤细胞生长)。进一步研究显示,口服给药剂量为50mg/kg时,该杂合体仍显示出显著地活性,对肿瘤细胞的抑制率为66.43%。不仅如此,该化合物未显示出明显的体内毒性。优秀的体内外活性及良好的安全性使得该杂合体极具进一步研究潜力,可作为临床前候选物进一步研究。
4 1,2,3-三氮唑-吲哚/吡啶/嘧啶杂合体
1,2,3-三氮唑-吲哚杂合体17a,b对所测的60株源自白血病、非小细胞肺癌、中枢神经系统癌、结肠癌、乳腺癌、肾癌、前列腺癌、卵巢癌和黑色素瘤等肿瘤细胞具有广谱活性,平均GI50分别为424和856nmol/L,可作为先导物进一步研究[48]。杂合体18在免疫低下的小鼠模型中可抑制90%乳腺瘤生长和转移,具有治疗乳腺癌的潜力[49]。杂合体19a,b(IC50:42~478nmol/L)对MDA-MB-231,U-87和IMR-32肿瘤细胞具有良好的体外活性,其活性与阿霉素(IC50:80~425nmol/L)相当,值得深入研究[50]。
尽管1,2,3-三氮唑-吡啶杂合体20(IC50:2.4~10μmol/L)的抗HCT116,MDA-MB-231和HepG2肿瘤细胞系的IC50在微摩尔级,但活性仍优于伏立诺他(IC50:3.1~>100μmol/L)[51]。在移植HCT116的小鼠模型中,该杂合体(25mg/kg,腹腔注射给药,每日2次)也显示出良好的体内活性,其可抑制体内69%的肿瘤细胞生长,而伏立诺他仅可抑制33%的肿瘤细胞生长。药代动力学性质研究结果表明,该杂合体的半衰期、达峰浓度、血清清除速率和吸收分布体积分别为1.8h,745ng/mL,6173mL/(kg·h)和6229mL/kg。良好的体内外活性和药代动力学性质使得该杂合体极具进一步研究价值。
杂合体21(IC50:200~840nmol/L)具有良好的抗HT-29和MCF-7肿瘤细胞活性,且其活性是对照药索拉非尼(IC50:5.29和43.30μmol/L)的6.2~131.2倍[52]。杂合体22(IC50:850和360nmol/L)的抗PC-3和LNCaP肿瘤细胞活性则是对照药比卡鲁胺(IC50:58和30μmol/L)的68.2和83.3倍[53],而杂合体23a(IC50:20~1040nmol/L)和23b(IC50:20~1270nmol/L)的抗K562,HL60和KG1a肿瘤细胞活性则是伊马替尼(IC50:30~16700nmol/L)的1.5~13.1倍[54]。
嘧啶类化合物是绝大多数细胞赖以生存的基础,且抗肿瘤药物色瑞替尼和乌拉莫司汀均含有一个嘧啶结构片段[55]。因此,将1,2,3-三氮唑与嘧啶杂合也具有获得优秀抗肿瘤活性候选物的潜力。1,2,3-三氮唑-嘧啶杂合体24a~c(图4,IC50:21~96nmol/L)对所测的ALCL、KARPAS299、NSCLC、HLAC、A549和H460肿瘤细胞系显示出良好的活性,且活性优于克唑替尼(IC50:87~>1000nmol/L)和色瑞替尼(IC50:26~>1000nmol/L)[56]。进一步研究发现,这类杂合体可同时抑制ALK和ROS1,可作为双重抑制剂深入研究。1,2,3-三氮唑-嘧啶杂合体25 (IC50:850~1770nmol/L)不仅具有潜在的抗MGC-803,MCF-和EC-109肿瘤细胞活性,活性是5-氟尿嘧啶(IC50:7.35~10.59μmol/L)的5.9~9.7倍,且对正常GES-1细胞的细胞毒性(IC50:56.17μmol/L)极低,SI>31.7[57]。

图4 1,2,3-三氮唑-喹啉/喹唑啉/喹诺酮杂合体27~32的化学结构
1,2,3-三氮唑-吡咯并嘧啶、咪唑并嘧啶及噻吩并嘧啶杂合体也显示出一定的抗肿瘤活性,某些化合物的活性甚至可与Foretinib(IC50:2.4~4.7μmol/L)媲美[58-60]。代表物26(IC50:500~1000nmol/L)对A549,HepG2和MCF-7肿瘤细胞的活性是对照药Foretinib的3.6~5.2倍,可作为先导物进一步优化。
5 1,2,3-三氮唑-喹啉/喹唑啉/喹诺酮杂合体
喹啉/喹唑啉/喹诺酮均属于苯并六元含氮杂环化合物,其衍生物具有优秀的体内外抗肿瘤活性。不仅如此,代表物卡博替尼、吉非替尼、厄洛替尼和Quarfloxin等已被批准用于临床治疗各种癌症或正处于临床评价阶段[61-63]。显然,将1,2,3-三氮唑与喹啉/喹唑啉/喹诺酮杂合可能会获得新型抗肿瘤药物。
1,2,3-三氮唑-奎宁杂合体27 (IC50:530~6400nmol/L)具有优秀的抗HT-29、MCF-7、A549、DU-145和MV-4-11肿瘤细胞系活性,其活性与顺铂(IC50:5500~18900nmol/L)相当或更优[64]。而杂合体28(IC50:<10~503nmol/L)对所测的59株源自白血病、非小细胞肺癌、中枢神经系统癌、结肠癌、乳腺癌、肾癌、前列腺癌、卵巢癌和黑色素瘤等肿瘤细胞具有广谱活性,极具进一步研究价值[65-66]。杂合体29(IC50:30~180nmol/L)的抗HT-29,H460,A549和MKN-45肿瘤细胞系活性是对照药Foretinib(IC50:32~210nmol/L)的1.1~1.9倍,且该杂合体可作用于c-kit,Flt-3,c-Met激酶,VEGFR-2,Ron和EGFR (IC50:2.27~529.4 nmol/L)等多可靶点,可作为多靶点抗肿瘤候选物进一步研究[67]。1,2,3-三氮唑-四氢异喹啉杂合体30(EC50:127.5nmol/L)不仅抗耐阿霉素K562/A02肿瘤细胞的活性极高,而且与紫杉醇、长春碱和柔红霉素具有协同作用[68]。进一步研究显示,该杂合体对细胞色素CYP3A4无抑制作用,提示其安全性良好。
1,2,3-三氮唑-喹唑啉杂合体31(IC50:40~5670nmol/L)具有良好的抗HepG2,KB和SK-Lu-1肿瘤细胞活性,且活性与对照药玫瑰树碱(IC50:1.38~2.72μmol/L)和厄洛替尼(IC50:13.01~99.76μmol/L)相当或更优[69]。进一步研究显示,此类杂合体对L858R突变的EGFR也具有潜在的抑制活性,提示其具有抗耐药肿瘤的潜力。杂合体32(IC50:570~7130nmol/L)的抗MCF-7、MGC-803、EC-109和HGC-27肿瘤细胞活性高于对照药5-氟尿嘧啶(IC50:6.50~14.61μmol/L),可作为先导物进一步研究[70]。
6 其它1,2,3-三氮唑杂合体
1,2,3-三氮唑-萘醌杂合体33(图5,IC50:70~1390nmol/L)的抗HL-60,HCT-116,PC3,SF295,MDA-MB-435和OVCAR-8肿瘤细胞活性与阿霉素(IC50:20~960nmol/L)相当[71]。作用机制研究结果表明,这类杂合体可通过产生活性氧发挥抗肿瘤活性。杂合体34(IC50:410~1590nmol/L)具有优异的抗OBMC、PC3、HCT-116、HL-60、MDA-MB435和SF-295肿瘤细胞活性,且活性与对照药阿霉素(IC50:20~880nmol/L)和β-拉帕醌(IC50:0.25~>20.6μmol/L)相当或更优[72]。
1,2,3-三氮唑-甾体杂合体35(IC50:50~90nmol/L)具有极为优秀的抗T47D,MCF-7和SNB-19肿瘤细胞活性,是对照药顺铂(IC50:2.3~24.9μmol/L)的25.5~498倍,极具进一步开发前景[73]。杂合体36(IC50:540~2660nmol/L)的抗PC3、HT29、HepG2、A549、HL60和U937肿瘤细胞活性是对照药5-氟尿嘧啶(IC50:8.45~69.07μmol/L)和Hederacolchiside A1(IC50:0.85~5.41μmol/L)的2.0~109.4倍[74]。作用机制研究结果显示,该杂合体可使HepG2肿瘤细胞的G1和S期阻滞,进而诱导肿瘤细胞凋亡。
1,2,3-三氮唑-D-呋喃核糖杂合体37(G I50:1.22~12.20μmol/L)对源自白血病、非小细胞肺癌、中枢神经系统癌、结肠癌、乳腺癌、肾癌、前列腺癌、卵巢癌和黑色素瘤的60株肿瘤细胞具有广谱活性,对伊马替尼和氮杂胞苷敏感型及耐药型CML肿瘤细胞的IC50分别为340和500nmol/L[75]。在移植耐伊马替尼和氮杂胞苷MDS肿瘤细胞的小鼠模型中,与对照组相比,该杂合体(5mg/kg,皮下注射)在给药d35可使肿瘤体积减少50%,且不影响给药小鼠体重。广谱体外活性、优异的体内活性加之良好的安全性使得该杂合体极具进一步研究价值。
对一系列1,2,3-三氮唑-鬼臼毒素杂合体抗
A549、PC-3、MCF-7、K562、HCT-116、U251、SKBR-3、SMCC-7721、LNCaP和耐阿霉素K562/ADR肿瘤细胞系活性研究结果表明,杂合体38(IC50:19.6~55.3nmol/L)具有极为优秀的广谱活性[76-79]。而1,2,3-三氮唑-鬼臼毒素杂合体二聚体39 (IC50:430~3500nmol/L)等抗A-549、MCF-7、SW480和SMMC-7721肿瘤细胞活性是依托泊苷(IC50:8.12~32.82μmol/L)和顺铂(IC50:6.93~10.85μmol/L)的2.8~21.3倍,值得进一步研究[80]。

图5 1,2,3-三氮唑杂合体30~46的化学结构
1,2,3-三氮唑-五味子酯乙杂合体40(IC50:240~12800nmol/L)具有潜在的抗DU-145、A-549、PANC1、MDA-MB-231、SIHA和IMR32肿瘤细胞系活性,对大多数所测肿瘤细胞系的活性与阿霉素(IC50:1500~2400μmol/L)相当,而是五味子酯乙(IC50:51.2~66.8μmol/L)的5.0~213.3倍[81]。杂合体41(IC50:800~1700nmol/L)的抗MCF-7,MDA-MB-231和MDAMB-468乳腺癌细胞系活性是对照药5-氟尿嘧啶(IC50:7.5~12.7μmol/L)的6.2~15.8倍,可作为抗乳腺癌新药先导物进一步优化[82]。
杂合体42a,b(IC50:30~800nmol/L)具有良好的抗A549,THP-1和HCT-15肿瘤细胞系活性,活性是5-氟尿嘧啶(IC50:1~6μmol/L)的1.25~163.3倍,但二者(IC50:>50μmol/L)对IMR-32肿瘤细胞未显示出任何活性[83]。杂合体43(IC50:230~1130nmol/L)具有优秀的广谱抗A549、OVCAR-3、HepG2、A375和SW-620肿瘤细胞系活性,活性是瑞卡帕布(IC50:2.58~13.82μmol/L)的2.2~20.3倍,可作为先导物进一步优化[84]。对一系列1,2,3-三氮唑-哌啶杂合体44的抗SGC-7901,A549和HeLa肿瘤细胞系研究结果表明,化合物44a,b(IC50:84~684nmol/L)的IC50低至纳摩尔级[85]。其中,杂合体44a可阻滞SGC-7901肿瘤细胞的G2/M期,且可与微管蛋白秋水仙碱位点相结合。
1,2,3-三氮唑-Melampomagnolide B杂合体45a,b对源自白血病、非小细胞肺癌、中枢神经系统癌、结肠癌、乳腺癌、肾癌、前列腺癌、卵巢癌和黑色素瘤的60株肿瘤细胞具有广谱活性,GI50分别为160~3670nmol/L和20~1860nmol/L[86]。
1,2,3-三氮唑-CA-4杂合体46a,b(IC50:36~800nmol/L)具有良好的抗U87、HepG2、A549和HCT-116肿瘤细胞系活性,其中46b(IC50:36~4300nmol/L)对所测所有肿瘤细胞系的的活性均高于母药CA-4(IC50:390~930nmol/L)[87]。在免疫活性H22和免疫缺陷A549肿瘤移植小鼠模型中,杂合体46b(30mg/kg,静脉注射)可分别减小69.82%和64.29%的肿瘤体积,活性优于母药CA-4(58.85%)。不仅如此,所试验小鼠的体重未发生明显变化,提示杂合体46b的安全性良好。优异的体内外活性和良好的安全性使得该杂合体可作为候选物进一步研究。
7 结束语
1,2,3-三氮唑类化合物不仅易于合成,而且可与肿瘤细胞的各种酶和受体结合,进而发挥抗肿瘤活性。因此,1,2,3-三氮唑药效团在抗肿瘤药物的研发中占据重要地位。将1,2,3-三氮唑药效团与其它具有抗肿瘤活性的药效团杂合可能会获得活性更高、毒副作用更低和对耐药肿瘤具有优秀活性的候选物,是获得新型抗肿瘤药物的潜在途径。本文综述了近年来所开发的具有优秀体内外抗肿瘤活性的1,2,3-三氮唑杂合体的最新研究进展,以启迪科学家更合理的开展深入研究。

