单重PCR 鉴别犬4 种布鲁氏菌检测方法的建立
徐怀英,黄迪海,仉 伟,郝文娟,盛晓丹,秦卓明,2
(1.山东省农业科学院家禽研究所,山东济南 250100;2.山东省健牧生物药业有限公司,山东济南 250100;3.济南市动物生物药品工程技术研究中心,山东济南 250100;4.济南市动物园服务中心,山东济南 250031)
布鲁氏菌病(brucellosis)是一种人兽共患病,由布鲁氏菌属细菌侵入宿主机体引起,其临床发病特点为被感染人和动物长期发热、多汗、关节痛以及肝脾肿大等,且可引起生殖系统疾病,公共卫生意义巨大。
布鲁氏菌属的4 个种均可以感染犬,包括:羊种布鲁氏菌(B.melitensis)、牛种布鲁氏菌(B.abortus)、猪种布鲁氏菌(B.suis)和犬种布鲁氏菌(B.canis)[1]。犬种布鲁氏菌生长菌落为天然粗糙型,而牛种、羊种、猪种布鲁氏菌生长菌落一般是光滑型。由犬种布鲁氏菌引起的犬布鲁氏菌病称为最适寄生型,由其他3 种布鲁氏菌引起的犬布鲁氏菌病称为转移型。在牧区,由于犬多为散养,生食病死畜禽现象普遍存在,犬布鲁氏菌感染率较高,抗体阳性率介于8.16%~42.65%[2-3]。2016—2017 年的济南市宠物犬布鲁氏菌病血清学调查结果显示,光滑型布鲁氏菌抗体阳性率为8.76%,粗糙型布鲁氏菌为1.99%[4],表明在宠物犬中存在不同程度的布鲁氏菌感染,潜在传播风险较大。
聚合酶链式反应(PCR)是一种快速、特异、敏感的分子检测方法。我国已经建立了Bruce-Ladder PCR 检测布鲁氏菌的国家诊断技术标准(GB/T 18646—2018),但该方法需要首先对病原菌进行分离和纯培养,不适宜在基层推广应用。本研究根据粗糙型布鲁氏菌wbkD及wbkF基因序列缺失351 bp 的特点[5],通过设计1 对引物并优化反应条件建立了PCR 检测方法。该方法可同时鉴别诊断4 种布鲁氏菌(犬种、牛种、羊种和猪种),既适用于病原菌的纯培养物,又适合于感染犬的血液、流产或排泄物样品的检测,且能一次性区分光滑型(牛种、羊种和猪种)和粗糙型(犬种)布鲁氏菌,适合于基层推广和应用。
1 材料与方法
1.1 材料
1.1.1 菌株B.abortus、B.melitensis、B.suis和B.canis灭活菌液,由中国兽医药品监察所丁家波研究员惠赠;大肠杆菌及沙门氏菌,由山东省农业科学院家禽研究所保存。
1.1.2 犬布鲁氏菌阳性血液样品。经布鲁氏菌虎红平板凝集试验抗原检测为阳性的20 份犬布鲁氏菌血液样品。
1.1.3 主要试剂及仪器 10×PCR Buffer、TaqDNA 聚合酶、dNTP,均购自湖南艾科瑞生物工程有限公司;DL 2 000 bp DNA Marker、DL 1 000 bp DNA Marker,均购自宝生物(北京)有限公司;细菌基因组DNA 提取试剂盒,购自天根生化科技(北京)有限公司;琼脂糖,购自Biowest公司;NanoDropTMOne/OneC 超微量紫外分光光度计、PCR 仪,均购自Thermo Fisher 公司;Tanon 1600 凝胶图像分析系统,购自上海天能科技有限公司。
1.2 方法
1.2.1 细菌基因组DNA 的提取 按照细菌基因组DNA 提取试剂盒说明书,提取上述细菌的基因组DNA,-20 ℃保存备用。
1.2.2 引物设计 下载GenBank 中登录的B.abortus、B.melitensis、B.suis和B.canis基因组序列并进行比对,根据B.canis基因组中wbkD、wbkF基因序列差异,应 用Primer Premier 5.0 软件设计1 对引物(BF:5'-TCTA TTATTACGGACGGCTGGCTGAG-3';BR:5'-GTGGTGGCCCATGTGGCGCTT-3')。引物送北京六合华大基因科技股份有限公司合成。其中,牛种、羊种、猪种布鲁氏菌目的片段长度预计均为717 bp;犬种布鲁氏菌缺失351 bp,目的片段长度预计为366 bp。
1.2.3 反应体系建立及条件优化 PCR反应体系为:10×PCR Buffer 0.25 μL,dNTP(10 mmol/L)1 μL,待检DNA 模板2 μL,引物BF 和BR(10 mmol/L)各1 μL,TaqDNA 聚合酶(5 U/μL)0.25 μL,最后用RNA-free 补足反应体系至25 μL。PCR 反应条件为:95 ℃预变性3 min;98 ℃变性10 s,分别设置6 个退火温度(52、54、56、58、60 和62 ℃)退火30 s,72 ℃延伸40 s,共进行35 个循环;最后72 ℃延伸10 min。扩增产物于4 ℃保存备用。
1.2.4 特异性试验 按照优化的PCR 反应体系及反应条件,分别对4种布鲁氏菌、大肠杆菌和沙门氏菌基因组DNA 进行序列扩增,然后将PCR 反应产物进行1.5%琼脂糖凝胶电泳,验证反应的特异性。
1.2.5 敏感性试验 将4种基因组DNA(犬种、羊种、牛种和猪种)样品分别用NanoDrop ™ One/OneC 超微量紫外分光光度计进行含量和纯度测定,然后对各样品10 倍倍比稀释6 个梯度,各取2 μL不同含量的模板,使用引物BF 和BR 进行PCR 扩增,验证该检测方法的灵敏性。
1.2.6 临床应用 选择20 只发生过流产的布鲁氏菌血清学阳性雌犬,每只犬后肢静脉采集抗凝血1份。参照文献[6]中布鲁氏菌抗凝血样DNA 提取方法提取基因组DNA,利用设计的特异性引物进行PCR 检测,检测该方法在临床上的应用效果。
2 结果与分析
2.1 PCR 反应条件优化
在52、54 ℃退火温度下,PCR 反应条带较亮;56、58 ℃退火温度下,PCR 反应条带逐渐变暗;60、62 ℃退火温度下,未观察到PCR 条带(图1)。通过优化试验,确定该引物退火温度为54 ℃。最佳反应条件为:95 ℃预变性3 min;98 ℃变性10 s,54 ℃退火30 s,72 ℃延伸40 s,共进行35 个循环;然后72 ℃延伸10 min。
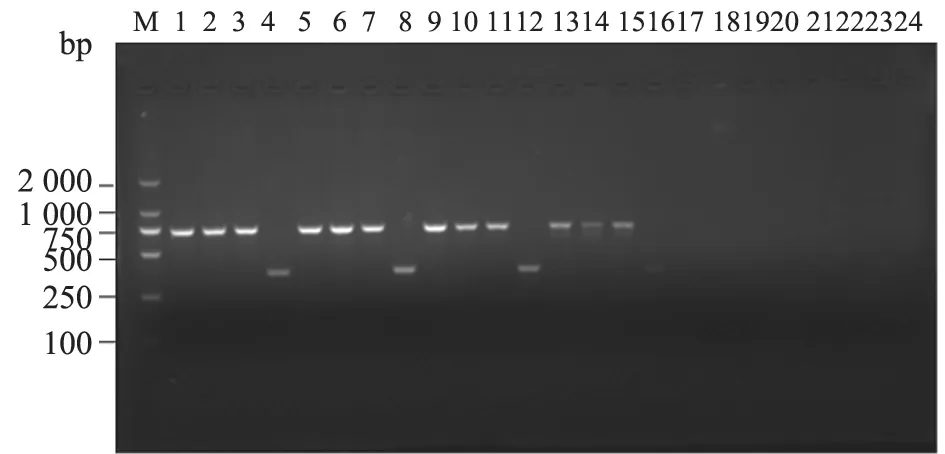
图1 不同退火温度对牛种、羊种、猪种和犬种布鲁氏菌PCR 反应的影响
2.2 特异性试验
利用建立的PCR 反应体系,对牛种、羊种和猪种布鲁氏菌均能扩增出预期的717 bp目的条带,对犬种布鲁氏菌能扩增出366 bp 目的条带,而对大肠杆菌、沙门氏菌,均未扩增出相应条带,表明建立的PCR 方法特异性较好(图2)。
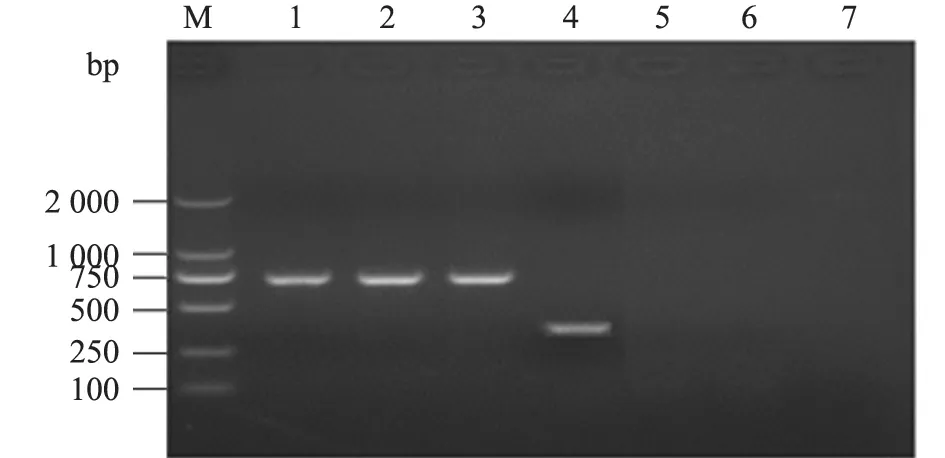
图2 PCR 方法的特异性试验结果
2.3 敏感性试验
经NanoDrop ™ One/OneC 超微量紫外分光光度计测定,犬种、羊种、猪种和牛种布鲁氏菌基因组DNA 浓度分别为50.7、62.0、78.0 及55.0 ng/μL,分别10 倍倍比稀释6 个梯度,然后进行PCR 并将反应产物进行琼脂糖凝胶电泳(图3)。

图3 4种布鲁氏菌PCR 反应的敏感性试验结果
从图3 可以看出,当犬种布鲁氏菌基因组DNA 浓度为5.07×(10-2~101)ng/μL 时,利用建立的PCR 方法扩增后均有明显特异性条带,扩增片段大小为366 bp;当浓度等于或小于5.07×10-3ng/μL时,均无扩增条带。当羊种布鲁氏菌基因组DNA浓度为6.20×(10-2~101)ng/μL 时,PCR 扩增后均有明显特异性条带,扩增片段大小为717 bp;当浓度等于或小于6.20×10-3ng/μL 时,均无扩增条带。当猪种布鲁氏菌基因组DNA 浓度为7.80×(10-3~101)ng/μL 时,PCR 扩增后均有明显特异性条带,扩增片段大小为717 bp;当浓度等于或小于7.80×10-4ng/μL 时,均无扩增条带。当牛种布鲁氏菌基因组DNA 浓度为5.50×(10-2~101)ng/μL 时,PCR 扩增后均有明显特异性条带,扩增片段大小为717 bp;当浓度等于或小于5.50×10-3ng/μL 时,均无扩增条带。
由此可见,该方法能检测到犬种、羊种、猪种和牛种布鲁氏菌基因组DNA 最低浓度分别为5.07×10-2、6.20×10-2、7.80×10-3和5.50×10-2ng/μL,表明本方法的检测灵敏度较高。
2.4 宠物犬布鲁氏菌临床检测
对20 份宠物犬布鲁氏菌血清学检测为阳性的血液样品进行PCR 检测,发现5、11 和15 号样品在366 bp 处扩增出特异性条带(图4),表明上述3 份样品犬种布鲁氏菌病原阳性。将这3 份抗凝血样品送中国兽药监察所进行细菌分离鉴定,共分离到2 株犬种布鲁氏菌。

图4 临床血液样品布鲁氏菌PCR 检测结果
3 讨论
感染犬的4 种布鲁氏菌均可感染人,其中以羊种布鲁氏菌毒力和传播性最强,牛种和猪种其次,犬种最弱[7]。伴随着人民生活水平的提高,城镇家庭饲养宠物犬数量庞大,截至2018 年12 月,我国宠物犬数量已高达7 400 万只,已有多例人通过密切接触犬而感染布鲁氏菌的报道[8-10]。因此,高度关注犬布鲁氏菌感染,对于保障人类和宠物健康意义重大。
细菌的分离培养和血清学诊断是布鲁氏菌病检测的主要手段,从血液、流产胎儿、阴道分泌物等材料中分离到布鲁氏菌是最具诊断性的“金标准”。但由于该病菌对人具有感染性,因此,必须在有资质的P3 实验室进行病原分离。同时该菌分离受采样时机等因素影响较大,分离率较低,不利于布鲁氏菌病的早期诊断。血清学诊断便捷简单,但虎红平板凝集试验(RBT)和试管凝集试验(SAT)易出现假阳性,常用于布鲁氏菌病流行病学调查时的初筛,而ELISA 抗体检测易出现假阴性[11]。本研究建立的单重PCR 可一次性鉴别粗糙型(犬种)与光滑型(羊种、牛种和猪种)布鲁氏菌,且在检测时可以直接采取病料组织,十分便捷,方便在基层推广应用。
利用本试验建立的单重PCR 方法对20 份布鲁氏菌血清学阳性犬血清进行检测,共检出3 份犬种布鲁氏菌阳性样品。将该批血液样品送中国兽医药品监察所布鲁氏菌检测实验室进行GB/T 18646—2018 引物的PCR 检测,结果一致。推测可能是由于犬种布鲁氏菌为粗糙型,而其种他为光滑型,不同生物型布鲁氏菌与机体作用机制不同。
布鲁氏菌不同种菌株间基因组同源性非常高[12-13],如布鲁氏菌16S rDNA 核苷酸序列相似性达99.6%~100%。已建立的聚合酶链反应-限制性片段长度多态性(PCR-RELP)需在单菌落纯化后进行[14],其他多重PCR 方法需要至少添加4 对以上的引物进行扩增[15]。本研究利用犬种布鲁氏菌在wbkD与wbkF基因序列缺失351 bp 的特点,通过犬种与其他3 种布鲁氏菌扩增长度的差异,确定是犬种还是其他布鲁氏菌种。该方法为犬布鲁氏菌病流行病学调查提供了便捷、特异性好、敏感性高的诊断技术,适于宠物门诊及基层研究单位对犬布鲁氏菌病尽早鉴别诊断,以尽快采取治疗或扑杀措施。

