煅烧骨与羧甲基壳聚糖复合材料修复家兔下颌骨缺损的成骨效果*
廖健,张霁文,程余婷,姚超,周倩,霍花,刘官娟
(1.贵州医科大学附属口腔医院 修复种植科, 贵州 贵阳 550004; 2.贵州医科大学 口腔医学院, 贵州 贵阳 550004; 3.贵阳市口腔医院, 贵州 贵阳 550002)
牙槽骨因肿瘤、炎症、外伤或发育不良等原因造成的骨量不足是口腔种植中的常见问题[1],目前主要采用骨移植材料来增加牙槽骨骨量,骨移植材料来源主要有自体骨、同种异体骨、异种骨及其它人工合成骨[2]。自体骨作为骨移植材料的“金标准”,移植效果最为理想[3-4],但存在需要开辟第二术区、增加患者痛苦及感染风险的问题;而异体骨和异种骨又可能携带病原体或在植入后发生免疫反应,并且处理成本相对较高,应用受到一定限制;人工合成骨替代材料,如羟基磷灰石、高分子聚合物、胶原、磷酸钙等,虽来源广泛,但成本及生产制造要求也相对较高,并且一部分合成材料在植入后吸收率较低,较难被自身组织所替代,影响骨组织的新生改建。因此各种骨替代材料均存在不可忽视的缺点[6],各种单一骨移植材料尚不能满足广大患者的需求[7]。理想的骨替代材料通常需具有良好的生物降解性及相容性、无免疫原性或低免疫原性、骨传导和骨诱导作用、一定的机械强度、能在植入后起到支架作用并保持稳定、利于新生组织沿其支架结构生长、能制备成各种形状、利于新生组织生长成所需的外形、利于细胞黏附生长的三维结构及高孔隙率等特点[8-10]。本课题组前期实验中将煅烧骨与壳聚糖复合制备得到煅烧骨/壳聚糖(CB/CS)复合材料,通过理化性能检测表明该复合材料的主要成分为羟基磷灰石和β-磷酸三钙,具备良好的三维结构及高孔隙率、合适的抗压强度及安全无毒[11],体外细胞实验证实该复合材料具有诱导骨髓间充质干细胞向成骨分化的作用[12]。本研究以前期的实验结果作为基础,将复合材料植入家兔体内,对植入后不同时点的成骨效果进行研究。
1 材料与方法
1.1 材料
1.1.1主要仪器和试剂 煅烧骨粉(calcined bone,CB)由四川大学口腔疾病研究国家重点实验室生物材料中心提供),Bio-oss骨粉(Geistlich,Switzerland)、羧甲基壳聚糖( carboxymethyl chitosan,CMC)由上海德默医药科技提供,京尼平(之信生物科技),无水乙醇(重庆川东化工),恒温磁力搅拌器(江苏金坛大地自动化仪器厂),实验室超纯水机(四川沃特尔科技),真空干燥机(日本东京理化, PDU-11003060600)显微CT(Micro-CT,μCT 50)由四川大学口腔疾病研究国家重点实验室提供。
1.1.2实验动物 spf级家兔60只,体质量2.0~2.5 kg,月龄2~4月,由贵州医科大学动物实验中心提供。
1.2 方法
1.2.1复合材料的制备 按照羧甲基壳聚糖与骨粉的质量比为1 ∶1的比例,采用溶液共混的方法,以京尼平为交联剂制备CB/CS复合材料及Bio-oss/羧甲基壳聚糖复合材料,真空干燥成型后待用。
1.2.2分组及方法 取健康成年家兔60只,随机分为1个实验组和4个对照组,每组12只。各组家兔均制作骨缺损模型(如图1),无菌条件下选取家兔一侧下颌骨作为术区,暴露下颌骨体部,钻孔制作直径约5 mm、深约2 mm的骨缺损区。实验组下颌骨缺损区植入CB/CS复合材料,4个对照组中取3组分别植入单纯CB、Bio-Oss及Bio-oss/CMC复合材料,植入材料均约为0.1 g,以填满骨缺损区为准,剩余1个组为不植入任何材料的空白组。术后止血分层缝合肌层、皮下组织及皮肤,术后注射青霉素以抗感染,术后1、2 d时行术区换药,观察术区伤口愈合情况。分别于术第后第2、4、8及12周时每组各处死家兔3只,取出术区标本进行检查。

图1 骨缺损区的制备及植入骨移植材料Fig.1 Establishment of bone defects and implantation of bone graft material
1.3 观察指标
1.3.1肉眼观察 观察骨缺损区内骨质生长情况。
1.3.2Micro-CT扫描 将标本置入10%甲醛溶液中,4 ℃冰箱内固定48 h,使用Micro-CT(μCT 50)扫描,扫描电压70 kV,电流200 μA,扫描层厚24 μm。使用SCANCO Evaluation进行分析,取感兴趣区域(region of interest,ROI)骨密度(bone mineral density,BMD)、骨小梁厚度或孔壁厚度(trabecular Thickness,Tb.Th)、骨小梁分离度或孔隙率(trabecular separation/spacing,Tb.Sp)及骨小梁数量(trabecular number,Tb.N)值进行分析。
1.4 统计学分析
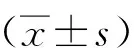
2 结果
2.1 术后大体观察
术后第2周,CB/CMC复合材料组3只家兔的骨缺损区均观察到材料与周围骨质联结紧密,边界尚清,质地较硬,从表面上看材料未见明显吸收;Bio-oss/CMC复合材料组3只家兔的骨缺损区均观察到材料与周围骨质联结紧密、边界尚清、质地较硬,但表面材料有部分吸收,煅烧骨与周围骨质联结紧密、边界尚清、质地偏硬、表面未见骨粉吸收;Bio-oss骨粉组3只家兔的骨缺损区均观察到材料与周围骨质联结紧密,边界清、质地偏硬,表面可见部分骨粉吸收;空白缺损组3只家兔的骨缺损区均未见愈合,大小相较于手术当天略有缩小,缺损区内可探及少量质软的纤维结缔组织(图2)。
术后4周,CB/CMC复合材料组3只家兔的骨缺损区均观察到材料与周围骨质联结紧密、质地较硬,表面可见部分材料吸收并被新生骨质生成替代;Bio-oss/CMC复合材料组3只家兔的骨缺损区均观察到材料与周围骨质联结紧密,质地较硬,表面可见少量新生骨质覆盖;煅烧骨粉组3只家兔的骨缺损区均观察到材料与周围骨质联结紧密、边界尚清、质地硬,边缘可见少量新生骨质生成;Bio-oss骨粉组3只家兔的骨缺损区均观察到材料与周围骨质联结紧密,周围新生骨质量少,骨粉颗粒未见明显吸收;空白组3只家兔的骨缺损区均未愈合,并被大量质地较软的纤维结缔组织占据(图2)。
术后第8周,CB/CMC复合材料组3只家兔的骨缺损区均观察到表面基本吸收,完全被新生骨质所替代,并已形成皮质骨;Bio-oss/CMC复合材料组3只家兔的骨缺损区均观察到表面仍可见植入材料存在,大量新生骨质覆盖,质硬;煅烧骨组3只家兔的骨缺损区均观察到表面骨粉颗粒未完全吸收骨粉吸收,可见有新生骨质生长于其上;Bio-oss骨粉组3只家兔的骨缺损区均观察到表面颗粒未完全吸收,有新生骨质生产与植入材料表面,新生骨质量多于术后4周时;空白组3只家兔的骨缺损区均未愈合,大量纤维结缔组织占据其中(图2)。
术后第12周,CB/CMC复合材料组3只家兔的骨缺损区均观察到表面基本被新生骨质所替代,骨质连续完整;Bio-oss/CMC复合材料组3只家兔均观察到缺损区较术后4周、8周时已明显缩小,中央部仍见材料存留;煅烧骨组3只家兔均观察到缺损区已明显缩小,少量材料未吸收,大部分材料被新生骨质替代;Bio-oss骨粉组3只家兔均观察到缺损明显缩小,中央处仍有骨粉材料未吸收,边缘处骨粉材料已基本被新生骨质替代;空白组3只家兔的骨缺损区均未见愈合,且其内仍可探及纤维结缔组织(图2)。

图2 各组不同时间点骨缺损部位观察Fig.2 Observation of bone defect sites at different time points in each group
2.2 Micro-CT检测
术后第2周,CB/CMC组、Bio-oss/CMC组、煅烧骨组及Bio-oss骨组缺损区内均可见颗粒样组织,缺损区边界清楚。术后第4周,CB/CMC组缺损区边缘部骨粉颗粒与周围骨组织界限模糊,缺损区内颗粒样影尚存;但密度较术后第2周时明显增加,其它对照组与术后第2周时无明显差异。术后第8周,CB/CMC组缺损区范围明显缩小,仅见少量颗粒样影存在,大部分为与周围骨质相同的影响;而对照组缺损区内仍可见大量颗粒样影,但密度较术后第4周时明显增加,缺损区边界也开始模糊。术后12周,CB/CMC组缺损区已基本消失,取而代之的是与周围骨质相同的影响;而Bio-oss/CMC组、煅烧骨组、Bio-oss骨组缺损区较术后第8周时有明显缩小,缺损区内也可见与周围骨质相同的成片状的影响,但仍存在少量的颗粒样影(图3)。

图3 各组不同时间点骨缺损部位Micro-CT扫描图像Fig.3 Micro-CT scanning images of bone defect sites at different time points in each group
2.3 BMD
术后第2、4、8及12周时各组BMD值比较,差异有统计学意义(P<0.05)。CB/CMC组在各时间段BMD值均显著高于煅烧骨组、Bio-oss骨组及空白组,术后第2、4及12周时高于Bio-oss/CMC组。见表1。

表1 各组家兔术后第2、4、8及12周时骨缺损部位的BMD值比较Tab.1 Comparison of BMD values at 2nd, 4th, 8th and 12th weeks after surgery in each group
2.4 Tb.Th
术后2、4、8及12周时,各组间的Tb.Th值比较,差异有统计学意义(P<0.05)。CB/CMC组在各时间点Tb.Th值均显著高于煅烧骨组、Bio-oss骨和空白组(P<0.05);术后第2、8、12周时也显著高于Bio-oss/CMC组(P<0.05);术后第4周CB/CMC组Tb.Th值与Bio-oss/CMC组比较,差异无统计学意义(P>0.05)。见表2。

表2 各组家兔术后第2、4、8及12周时骨缺损部位的Tb.Th值比较Tab.2 Comparison of Tb.Th values at 2nd, 4th, 8th and 12th weeks after surgery in each group
2.5 Tb.Sp
术后第2、4、8及12周时各组Tb.Sp值比较,差异有统计学意义(P<0.05)。术后第2周CB/CMC组Tb.Sp值显著低于空白组,差异有统计学意义(P<0.05),但与Bio-oss/CMC组、煅烧骨组、Bio-oss骨组比较,差异无统计学意义(P>0.05)。术后第4周CB/CMC组Tb.Sp值显著低于其他各组,术后8周及12周CB/CMC组Tb.Sp值显著低于Bio-oss骨组和空白组,与Bio-oss/CMC组及煅烧骨组比较,差异无统计学意义(P>0.05)。见表3。

表3 各组家兔术后2、4、8及12周时骨缺损部位的Tb.Sp值比较Tab.3 The differences of Tb.Sp values at 2nd, 4th, 8th and 12th weeks after surgery in each group
2.6 Tb.N
术后第2、4、8及12周时各组间的Tb.N值比较,差异有统计学意义(P<0.05)。术后第4、8、12周时CB/CMC组Tb.N值显著高于其他各组,术后第2周CB/CMC组Tb.N值显著高于煅烧骨、Bio-oss骨和空白组比较,差异有统计学意义(P<0.05);但与Bio-oss/CMC组比较,差异无统计学意义(P>0.05)。见表4。

表4 各组家兔术后第2、4、8及12周时骨缺损部位的Tb.N值比较Tab.4 Comparison of Tb.N values at 2nd, 4th, 8th and 12th weeks after surgery in each group
3 讨论
测定生物材料的成骨性能,在做动物体内实验时,常选择松质骨作为植入部位,同时要求骨缺损的大于或等于5 mm,以避免骨缺损在不填充骨移植材料的情况下即可自行愈合[13-15]。本实验选择家兔一侧下颌骨体部作为植入区,制造直径约为5 mm的骨缺损区,缺损区位于松质骨内,本实验观察期内空白组未见骨缺损自行愈合,证明缺损区大小合适。从各组取出后的实验标本来看,CB/CMC复合材料相对于对照组在引导成骨方面更具优势,CB/CMC复合材料组在12周时逐渐被新生骨组织所替代,但仍然维持支架结构稳定,未被完全吸收,保证骨组织能在其上顺利生长,相较于其他组材料在引导骨组织生长方面更具优势。组织工程研发出的三维混合支架材料是将一种或者多种骨移植材料与聚合物和/或生长因子复合,从而综合各自材料性能上的优点来补足单一材料上的不足,以达到获得理想的新生骨量与骨质量[16-17]。
Micro-CT相对于临床CT能更快的采集到三维图像,它一般使用锥形X线束(Cone Beam),而临床CT使用的为扇形X线束,采用锥形X线束能得到更高的分辨率,提高射线的利用率[18]。因此在骨组织工程的实验研究中,Micro-CT因能更精确全面的测量骨结构,并且对研究骨组织达到无创效果,是一种近年来被广泛采用的评价骨的质与量以及评测骨组织强度的新技术。Micro-CT革新了以往对于骨形态学的评价标准,通过直接测量骨结构厚度,检测骨小梁变化,描述骨3D分布,得到直观度远高于传统形态的计量学参数[19-21]。张亨国等[22]对植入动物体内种植体的周围骨界面进行Micro-CT扫描,使用软件分析得到一系列相关数据,通过这些分析数据能更为客观的评价种植体与周围骨组织的结合情况。Jae Min Song等[23]运用Micro-CT检测CFB-HAP与Bio-Gide膜对大鼠骨缺损愈合的影响,证实Micro-CT能有效地分析及测量新骨的形成,并能得出量化的结果。在之后的研究中,例如研发制造各类高仿生以及个性化生物材料,或是将已制造出的材料与天然组织进行比较分析时,Micro-CT具有极高的指导性及使用价值,特别是在骨组织工程的研究中,Micro-CT为其研发设计提供了一种新的评价方法[24]。最为重要的是Micro-CT为骨组织工程实验研究提供的一个关键优势在于,骨组织再生实验的结果可被量化[25]。Micro-CT检测数据中Tb.N是指给定长度内骨组织与非骨组织的交点数量,骨质疏松时,Tb.N值减小。Tb.Sp是指骨小梁之间的髓腔平均宽度,Tb.Sp增加,提示骨吸收增加。在多孔材料中,Tb.Sp即可理解为孔隙率。Tb.Th是指骨小梁的平均厚度,骨质疏松时,Tb.Th 值减小。在多孔材料中,Tb.Th 也可理解为孔壁厚度。通过检测分析这些数据以了解骨移植材料在植入动物体内后影响骨质生成的具体情况。
本次实验,将Micro-CT扫描得出的数据进行统计学分析可以看出,各组BMD值均随时间的延长而递增,证明各组缺损区内骨质随时间的增加均有所增长,而植入材料的4组的BMD值在各时期均显著高于空白组,证明在缺损区内植入骨移植材料后的骨愈合程度显著强于自然愈合。CB/CMC复合材料组的BMD值在各时间段均显著高于其它各组(P<0.05),证明CB/CMC复合材料组在单位体积内生成的骨质量显著多于其它各组。各组Tb.N值均随时间延长而递增,植入材料的4组的Tb.N值在各时期均高于空白组,证明各组缺损区内的骨小梁数量均随时间的增加而有所增加,且缺损区在植入骨移植材料后的骨小梁生成量显著多于自然愈合。CB/CMC复合材料组的Tb.N值在各时间段显著高于其它各组(P<0.05),证明CB/CMC复合材料在植入后,在单位长度内生成的骨小梁数量均显著多于其它各组,有比对照组所植入材料更强的骨生成能力。各组Tb.Sp值均随时间延长而递减,植入材料的4组的Tb.Sp值在各时期均低于空白组,术后4、8、12周时,CB/CMC复合材料组的Tb.Sp值显著低于Bio-oss骨组(P<0.05),证明CB/CMC复合材料相较于Bio-oss骨在植入缺损区后,在单位体积内形成的骨小梁密度更高。各组Tb.Th值均随时间延长而递增,植入材料的4组的Tb.N值在各时期均高于空白组,证明各组缺损区内的骨小梁厚度均随时间的增加而有所增加,且缺损区在植入骨移植材料后所生成的骨小梁厚度显著高于自然愈合。CB/CMC复合材料组在各时间段的Tb.Th值均显著高于其他各组(P<0.05),证明缺损区植入CB/CMC复合材料后所生成骨小梁的平均厚度显著高于其它各组。
综上所述,CB/CMC复合材料植入缺损区后,通过其良好的孔隙率及骨引导、骨诱导作用,在相同的时间内能生成多于对照组的骨质,且所生成骨质在骨小梁数目、间隙、厚度方面均优于对照组,能更好地完成其作为骨移植材料的作用,修复骨缺损,完成骨重建,是一种理想的,且具有良好生物相容性、骨引导及骨诱导作用的骨移植材料。

