两种甜叶菊废渣提取物对D-半乳糖致衰老小鼠的抗氧化作用
杨华青 赵 磊* 徐美利 王 鑫 连运河 王成涛
(1 食品营养与人类健康北京高精尖创新中心 北京市食品添加剂工程技术研究中心北京工商大学 北京100048 2 晨光生物科技集团股份有限公司 河北邯郸057250)
甜叶菊(Stevia rebaudiana Bertoni)属多年生菊科草本植物,原产于南美洲和巴西的高山草甸,特别是南美巴拉圭东北部[1]。甜叶菊中富含甜菊糖苷,被广泛用作天然甜味剂。有研究报道[2]从甜菊提取物中鉴定出89 种化合物,并将其分为多酚类化合物、萜类化合物、氨基酸衍生物、脂肪酸及其衍生物类、低聚糖、糖脂类、嘌呤和维甲酸等。这些化合物具有多种生物活性,如抗氧化[3],抑菌[4],抗肿瘤[5]等。甜菊提取物中的多酚和黄酮类化合物具有很强的体外清除自由基的能力[6]。然而,关于甜叶菊提取物体内抗氧化活性的研究鲜有报道。在生产甜菊糖苷的过程中会产生大量的絮凝废渣,其中含有大量的多酚类化合物,而这些副产物尚未得到充分利用。研究甜叶菊废渣提取物的抗氧化、抗衰老作用,对充分开发利用甜叶菊资源具有重要意义。
本研究采用高效液相色谱法(HPLC)对两种甜叶菊废渣提取物中的主要成分进行定量分析,并测定其对D-半乳糖致衰老小鼠血清、肝脏和脑组织中一些重要的抗氧化指标(如超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)和丙二醛(MDA)),以及脑组织中Nrf2 及其靶基因(SOD1,GPx1,HO-1)的mRNA 表达水平的影响等,探讨甜叶菊废渣提取物对D-半乳糖致衰老小鼠的抗氧化作用,为其进一步开发和应用提供理论依据。
1 材料与方法
1.1 试验材料
两种甜叶菊废渣提取物,晨光生物科技集团股份有限公司。
1.2 实验动物
SPF 级昆明种雄性小鼠(33~37 g,SPF 级,8 周龄),军事医学科学院实验动物中心,动物合格证号:SCXK-(军)2012-0004。
1.3 主要试剂
D-半乳糖(分析纯级),国药集团化学试剂有限公司;茶多酚(茶多酚>88%、EGCG>40%、儿茶素=0.76%),成都华高生物制品有限公司;咖啡酸、绿原酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C、槲皮素、槲皮苷(纯度均≧98%),成都瑞芬斯生物科技有限公司;超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶 (GPx)、丙二醛(MDA) 测定试剂盒,南京建成生物工程研究所;BCA 法蛋白定量试剂盒、高纯总RNA 快速提取试剂盒(离心柱型),北京百泰克生物技术有限公司;FastQuant cDNA 第一链合成试剂盒(去基因组),天根生化科技(北京)有限公司;甲醇(色谱级),北京迈瑞达科技有限公司;其它试剂均为国产分析纯级。
1.4 仪器与设备
Agilent 1290 超高效液相色谱,美国安捷伦科技有限公司;DY89Ⅱ匀浆机,宁波新芝生物科技有限公司;SpectraMax13 连续波长多功能酶标仪,美国Molecular Devices 公司;3K15 台式离心机,德国Sigma 公司;S1000PCR 扩增仪、CFX96 荧光定量PCR 仪,美国伯乐公司;NanoDropTM2000 微量紫外-可见光分光光度计,美国赛默飞世尔公司。
1.5 试验方法
1.5.1 两种甜叶菊废渣提取物中主要成分的定量分析 本实验室研究人员前期研究证实,甜叶菊废渣提取物的主要成分为咖啡酸、绿原酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C、槲皮素和槲皮苷[7]。采用HPLC 法对两种甜叶菊废渣提取物中的主要成分进行定量分析。高效液相色谱条件为:Agilent Eclipse Plus C18色谱柱 (50 mm ×2.1 mm,1.8 μm),流动相为0.1%甲酸(A)和甲醇(B),流速0.1 mL/min。洗脱程序:0~10 min,10%~50%(B);10 ~12 min,50%~10%(B);12 ~15 min,10%(B)。检测波长320 nm 和360 nm,柱温30 ℃,进样量1 μL。采用咖啡酸、绿原酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C、槲皮素和槲皮苷为标准品,按上述色谱条件分别测定。以标准品的质量浓度为横坐标,峰面积为纵坐标,绘制HPLC 标准曲线,并测定两种甜叶菊废渣提取物中各主要成分的含量。
1.5.2 甜叶菊废渣提取物对D-半乳糖致衰老小鼠的抗氧化作用
1.5.2.1 小鼠饲养条件 小鼠饲养于北京市食品添加剂工程技术研究中心,室内通风条件良好,正常昼夜变化(9:00-21:00),相对湿度(40 ± 5)%,室温(21±2)℃。
1.5.2.2 实验分组及操作 80 只实验小鼠适应7 d,喂食普通饲料,自由饮水、觅食。适应期后,随机等分为正常组、D-半乳糖组、两种甜叶菊废渣提取物低、中、高剂量组(分别灌胃100,200,500 mg/kg bw 甜叶菊废渣提取物),每组10 只,同时用苦味酸对小鼠进行编号。各组在灌胃的同时,D-半乳糖组和甜叶菊废渣提取物组,颈背部皮下注射5%的D-半乳糖溶液(500 mg/kg bw),正常组注射等体积的生理盐水。每日给药1 次,持续时间为11 周。
1.5.2.3 待测样本制备 实验结束后,小鼠禁食(不禁水)11 h。11 h 后,小鼠摘眼球取血,全血收集于干净的1.5 mL 离心管中,37 ℃水浴15 min,4 000×g 离心15 min 分离血清,-80 ℃保存待测。采血后,将小鼠断颈处死并解剖,取出肝脏和脑组织并将其在预冷的生理盐水中漂洗,去除血液,用滤纸吸干表面水分。将肝脏和脑组织一部分放入小离心管里,立即放入液氮(-196 ℃)中速冻,转入超低温冰箱(-80 ℃)存放,备用。另一部分剪碎,加入9 倍0.9%预冷的生理盐水,置玻璃匀浆器中冰水浴迅速研磨制成组织匀浆,4 ℃,12 000×g 离心15 min,取上清液,-80 ℃保存备用。
1.5.2.4 血清及组织抗氧化指标的测定 测定血清、肝和脑组织匀浆中SOD,GPx 活力及MDA 含量,检测方法具体操作按试剂盒说明进行。
1.5.2.5 荧光定量PCR 检测小鼠脑mRNA 表达水平 采用高纯总RNA 快速提取试剂盒提取各组小鼠脑组织中总RNA,使用NanoDropTM2000微量紫外-可见光分光光度计检测其完整性及其浓度。按逆转录试剂盒操作说明,将提取的RNA逆转录成cDNA 并置于-20 ℃保存。通过SYBR Green 法进行荧光定量,反应体系如下(20 μL):无RNA 酶 水7.4 μL,SuperReal PreMix Plus(SYBR Green)10 μL,上下游引物各0.8 μL,cDNA 模板1 μL。RT-PCR 反应条件:94 ℃预变性3 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,40 个循环。以β-actin 为内参基因进行实时荧光定量PCR 分析。计算方法采用比较CT 值法(2-(ΔΔCt))。涉及的引物序列见表1。

表1 实时定量PCR 引物序列列表Table 1 List of primer sequences used in the quantitative real-time PCR for gene expression analysis
1.5.3 数据统计分析 采用SPSS 20.0 统计软件,试验数据以平均数±标准偏差(Mean±SD)表示,用单因素方差分析(one-way ANOVA)及多重比较(Duncan)进行差异显著性分析,P <0.05 为差异显著。
2 结果与分析
2.1 两种甜叶菊废渣提取物中主要成分的含量
按照1.5.1 节试验方法,通过与标准品出峰时间相比较,从甜叶菊废渣提取物中分离并检测到了6 种酚酸(320 nm)和2 种黄酮(360 nm),如图1所示。采用外标法对上述8 种主要成分含量进行测定,结果见表2。样品1 中总酚酸的含量为(472.01±2.28)mg/g,总黄酮的含量为(75.27±1.37)mg/g,其中含量最高的3 种成分依次为异绿原酸C(158.91±1.00)mg/g、异绿原酸B(116.39±0.57)mg/g 和咖啡酸(105.67±0.37)mg/g。样品2 中总酚酸的含量为(424.41±5.01)mg/g,总黄酮的含量为(46.4±2.36)mg/g,其中含量最高的3 种成分依次为咖啡酸(146.47±1.68)mg/g、异绿原酸C(88.73 ±1.05)mg/g 和异绿原酸B(67.38±0.82)mg/g。从结果中看出,两种甜叶菊废渣提取物都富含酚酸和黄酮类化合物,其中,样品1 中酚酸和黄酮类化合物的总量均大于样品2,且两种样品各组成成分含量之间也存在差异,样品1 绿原酸类化合物含量较多,样品2 咖啡酸含量较多。这些成分具有多种生物活性,如清除自由基,抗氧化,抗炎症,抗衰老等。因此对甜叶菊废渣提取物进行研究,可为其进一步开发应用提供依据。

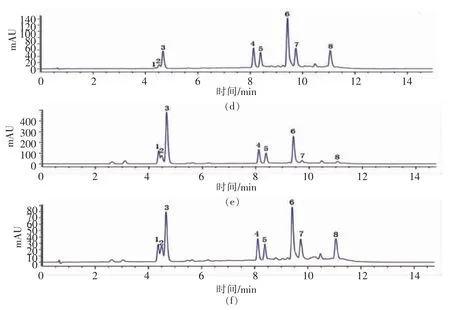
图1 320 nm 和360 nm 波长下混合标准品与甜叶菊废渣提取物的HPLC 图谱Fig.1 HPLC chromatogram of mixed standard sample and stevia residue extracts at wavelengths of 320 nm and 360 nm

表2 8 种标准品的线性方程及甜叶菊废渣提取物中酚酸和黄酮的含量Table 2 Linear equations of eight standards and the contents of phenolic acids and flavonoids in stevia residue extracts
2.2 两种甜叶菊废渣提取物对D-半乳糖致衰老小鼠血清抗氧化指标的影响
由图2可知,D-半乳糖组小鼠的血清SOD 和GPx 活力明显低于正常组(P<0.05),MDA 含量明显高于正常对照组(P<0.05),表明经D-半乳糖诱导,小鼠血清内的抗氧化活性下降,脂质过氧化物明显增多。两种甜叶菊废渣提取物低剂量组小鼠血清SOD 和GPx 活力,MDA 含量与D-半乳糖组相比均无显著性差异(P>0.05);两种甜叶菊废渣提取物的中剂量组小鼠血清GPx 活力较D-半乳糖组分别显著增加了16.39%和11.88%(P<0.05),而小鼠血清SOD 活力和MDA 含量与D-半乳糖组相比均无显著性差异(P>0.05);两种甜叶菊废渣提取物高剂量组能够使D-半乳糖处理的小鼠血清SOD 和GPx 活力升高,MDA 含量降低,其中样品1 高剂量组SOD 和GPx 活力分别显著增加10.32%和21.67%(P<0.05),MDA 含量降低了24.5%(P<0.05),样品2 高剂量组SOD 和GPx 活力分别显著增加11.28%和17.42%,MDA 含量降低了24.8%(P<0.05)。两种甜叶菊废渣提取物之间相比,对D-半乳糖处理小鼠血清抗氧化指标(SOD,GPx 和MDA)的影响无显著性差异(P>0.05)。综合以上结果表明,两种甜叶菊废渣提取物有助于D-半乳糖诱导衰老小鼠清除血清脂质过氧化物,提高血清抗氧化酶活力,增强机体免疫系统的能力。

图2 两种甜叶菊废渣提取物对D-半乳糖致衰老小鼠血清抗氧化指标的影响Fig.2 Effects of two kinds of stevia residue extracts on serum antioxidant indexes in D-galactose induced aging mice
2.3 两种甜叶菊废渣提取物对D-半乳糖致衰老小鼠肝脏组织抗氧化指标的影响
各组小鼠肝脏中抗氧化指标如图3所示。与正常组相比,D-半乳糖组小鼠肝脏组织中SOD 和GPx 活力显著降低(P<0.05),MDA 含量显著升高(P<0.05),表明经D-半乳糖诱导,小鼠肝脏组织中抗氧化活性显著下降,脂质过氧化物显著增多。与D-半乳糖组相比,样品1 的低、中、高剂量组小鼠肝脏组织中SOD 和GPx 活力均显著增加,MDA含量显著下降,其中高剂量组SOD 和GPx 活力分别增加了96.51%和122.52%(P<0.05),MDA 含量降低38.2%(P<0.05);样品2 的低、中、高剂量组小鼠肝脏组织中SOD 和GPx 活力较D-半乳糖组均显著增加,其中高剂量组SOD 和GPx 活力分别增加了192.06%和189.83%(P<0.05),样品2 的低、中剂量组小鼠肝脏内MDA 与D-半乳糖组之间无显著性差异,而高剂量组MDA 含量较D-半乳糖组显著降低了34.1%(P<0.05)。两种甜叶菊废渣提取物之间相比,对D-半乳糖处理小鼠肝脏抗氧化指标(SOD,GPx 和MDA)的影响无显著性差异(P>0.05)。综合以上结果表明,两种甜叶菊废渣提取物均具有提高D-半乳糖诱导衰老小鼠肝脏中抗氧酶活力和清除肝脏中自由基和脂质过氧化物的能力,具有缓解肝脏氧化应激损伤的效果。
2.4 两种甜叶菊废渣提取物对D-半乳糖致衰老小鼠脑组织抗氧化指标的影响
甜叶菊废渣提取物对小鼠脑组织中SOD,GPx 和MDA 的影响结果见图4。与正常组相比,D-半乳糖组小鼠脑组织内SOD 和GPx 活力显著降低(P<0.05),MDA 含量显著增加(P<0.05),表明经D-半乳糖诱导,小鼠脑组织内抗氧化酶活性显著下降,脂质过氧化物显著增多,模型构建成功。两种甜叶菊废渣提取物低剂量组小鼠脑组织内SOD 和GPx 活力,MDA 含量与D-半乳糖组相比均无显著性差异(P>0.05);两种甜叶菊废渣提取物中剂量组小鼠脑组织内SOD 活力较D-半乳糖组分别显著增加了66.87%和62.16%(P<0.05),GPx 活力无显著性差异(P>0.05),样品1 中剂量组小鼠脑组织内MDA 含量较D-半乳糖组显著下降了39.10%(P<0.05),而样品2 中剂量组小鼠脑组织内MDA 含量与D-半乳糖组之间无显著性差异(P>0.05);与D-半乳糖组相比,样品1 高剂量组小鼠脑组织内SOD 和GPx 活力分别显著增加了73.85%和19.56%(P<0.05),MDA 含量与D-半乳糖组之间无显著性差异(P>0.05),样品2 高剂量组小鼠脑组织内SOD 和GPx 活力较D-半乳糖组分别显著增加了73.48%和24.71%(P<0.05),MDA 含量显著下降了38.46%(P<0.05)。两种甜叶菊废渣提取物之间相比,对D-半乳糖处理小鼠脑组织抗氧化指标(SOD,GPx 和MDA)的影响无显著性差异(P>0.05)。综合以上结果表明,两种甜叶菊废渣提取物均具有提高D-半乳糖诱导衰老小鼠脑组织中抗氧酶活力和清除脑组织中自由基和脂质过氧化物的能力,有效防止或缓解脑组织中自由基导致的氧化应激损伤,从而起到抗氧化的作用。
2.5 两种甜叶菊废渣提取物对小鼠脑组织GPx1,SOD1,HO-1 和Nrf-2 的mRNA 表 达 水平的影响
综合以上结果可知,两种甜叶菊废渣提取物高剂量组对D-半乳糖诱导的小鼠体内氧化应激损伤抑制作用效果优于低剂量和中剂量组,因此选择高剂量组研究甜叶菊废渣提取物对D-半乳糖处理小鼠脑组织中抗氧化酶相关基因的表达水平。如图5所示,与正常组相比,D-半乳糖处理可显著降低小鼠肝脏组织中GPx1,SOD1,HO-1 和Nrf-2 基因相对表达水平(P<0.05)。与D-半乳糖组相比,样品1 高剂量组GPx1,SOD1,HO-1 和Nrf-2 基因相对表达水平分别显著提高了37.55%,68.95%,94.53%和58.74%(P<0.05);样品2 高剂量组GPx1,SOD1,HO-1 和Nrf-2 基因相对 表达水平分别显著提高了39.79%,60.21%,98.16%和58.01%(P<0.05)。两种甜叶菊废渣提取物之间相比,对D-半乳糖处理小鼠脑组织抗氧化基因的相对表达(GPx1,SOD1,HO-1 和Nrf-2)水平无显著性差异(P>0.05)。综合以上结果表明,两种甜叶菊废渣提取物高剂量组均能激活D-半乳糖处理小鼠体脑组织内抗氧化基因的表达,增强其体内抗氧化活性。
3 讨论
Barroso 等[8]通过HPLC-DAD-ESI/MS 对两种贮存条件下的甜叶菊提取物成分进行鉴定,发现其含有18 种酚酸和黄酮类化合物,其中含量最高的为绿原酸和异绿原酸A。本研究鉴定的两种甜叶菊废渣提取物中的主要成分为咖啡酸、绿原酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C、槲皮素和槲皮苷,均包含在Barroso 等[8]报道的18种酚酸和黄酮化合物之中,其中含量最高的为咖啡酸、异绿原酸C 和异绿原酸B,Barroso 等[8]研究的甜叶菊提取物是从甜叶菊叶片中提取得到,而本研究使用的甜叶菊废渣提取物是从甜菊糖苷生产过程中产生的絮凝废渣中提取得到,因此两者主要成分之间存在差异。Shukla 等[9]和Tadhani等[10]研究表明甜叶菊提取物具有较强的体外抗氧化活性,能抑制一系列自由基,如DPPH、羟自由基、一氧化氮等。另外,有研究显示槲皮素具有较强的抗氧化作用,其体外抗氧化作用与维生素C和维生素E 作用相当,同时槲皮素还可以提高二甲基亚砜诱导小鼠体内总抗氧化能力[11],绿原酸和咖啡酸可以增强脑缺血再灌注损伤模型大鼠体内的抗氧化能力[12]。本研究鉴定的两种甜叶菊废渣提取物均含有这些已报道的具有抗氧化作用的成分,因此甜叶菊废渣提取物具有提高机体抗氧酶活力,清除自由基和脂质过氧化物的能力,可有效防止或缓解自由基导致的氧化应激损伤。
D-半乳糖诱导衰老模型最早在1985年,由徐敝本[13]在使用啮齿动物衰老模型进行延缓衰老药物的研究中提出。D-半乳糖的作用机制与氧化应激损伤,钙稳态失调,线粒体老化,非酶糖基化反应,端粒短缩及端粒酶的活性下降,以及免疫功能减退有关[14]。D-半乳糖诱导衰老模型与其它衰老模型相比,与自然衰老最为相近,成模简易,结果稳定,因此得到较广泛推广应用[15]。本试验中,小鼠经颈部皮下注射D-半乳糖11 周之后,肝脏、脑和血清中SOD 和GPx 活性均显著降低,MDA含量显著升高,抗氧化酶基因表达量显著下降,这与高璐等[16]和Lei 等[17]的结论一致,表明衰老模型构建成功。
酶促反应系统被认为是体内抗氧化系统的第一道防线,具有清除自由基,催化细胞内过氧化物分解等作用,防止氧化应激对机体造成的伤害,对细胞具有保护作用,主要由一些酶组成,如SOD,GPx 等[18],非酶促反应体系主要为维生素、氨基酸和金属蛋白质[19]。本研究结果显示,与D-半乳糖组小鼠相比,两种甜叶菊废渣提取物高剂量组小鼠体内SOD,GPx 活性显著增加,MDA 含量显著降低,抗氧化酶基因的相对表达量相对增加,这与符莎露等[20]报道植物多酚对衰老小鼠抗氧化作用研究结果一致,表明甜叶菊废渣提取物具有良好的抗氧化、防衰老作用。Nrf-2 在抗氧化酶基因的转录中起着重要作用,是细胞氧化应激反应中的关键因子,与抗氧化反应元件结合,启动下游靶基因如HO-1,SOD 和GPx 等基因的表达,从而提高抗氧化酶的活性[21-22]。文献报道一些天然化合物,如槲皮素[23]、绿原酸[24]等,可通过激活Nrf-2,增加HO-1 等抗氧活性酶的mRNA 表达,本试验中的甜叶菊废渣提取物高剂量组富含多酚黄酮类化合物,能提高抗氧化基因GPx1,SOD1,HO-1 和Nrf-2 的表达,研究结果与文献报道一致。Jeong 等[25]研究表明,植物多酚类可以通过激活D-半乳糖模型小鼠体内PI3K/Akt/Nrf2 信号通路,缓解体内氧化应激损伤,因此甜叶菊废渣提取物对D-半乳糖致衰老小鼠的抗氧化机制可能与激活小鼠体内PI3K/Akt/Nrf2 信号通路,提高小鼠体内抗氧化酶活性和抑制脂质过氧化物质的生成有关,对其抗氧化作用机制进行进一步研究具有重要意义。
4 结论
两种甜叶菊废渣提取物富含酚酸和黄酮类化合物,能提高衰老模型小鼠血清、肝脏、脑组织SOD 和GPx 活力,降低MDA 含量,增强抗氧化酶基因的相对表达,说明两种甜叶菊废渣提取物均能有效缓解D-半乳糖对小鼠造成的氧化应激损伤。因此,甜叶菊废渣提取物具有良好的体内抗氧化作用,为今后甜叶菊废渣提取物相关产品的开发利用提供了一定的科学依据。

