多指标综合评分法优化陕产花椒提取工艺研究
程应锋,杜远东,赵重博*,王 晶,曹林旭,刘 钉
(1 陕西中医药大学,陕西 咸阳,712046;2陕西省中药饮片工程技术研究中心,陕西 咸阳 712046;3汉中市食品药品检验检测中心,陕西 汉中 723000)
花椒为芸香科植物花椒ZanthoxylumbungeanumMaxim.和青椒ZanthoxylumschinifoliumSieb.et Zucc.的干燥成熟果皮,有很好的止痛作用[1],在我国有广泛的栽植。长期的人工培育产生了一些列花椒优势品种,尤其以甘肃、陕西、山东等省最为出名,如陕西韩城的大红袍等品种[2]。花椒有特殊的麻味和香味,也是日常生活中必不可少的调味品,与桂皮、丁香、八角等被称一起被称为“八大味”[3]。花椒目前主要是作为农副产品,经济价值不高,深加工不够。近几年对花椒的麻味研究较多,花椒所含异丁基酰胺类化合物,尤其是羟基-α-山椒素作为麻味的主要物质,被报道具有一定的神经保护和增强记忆的作用[4~5]。
花椒酰胺在国内外已有较多报道,但多针对其麻味刺激和药理作用,提取方面报道不多,多以机溶剂或超临界萃取[6~8],存在工艺复杂、设备昂贵等制约因素,不利于工业化推广;且研究指标单一,多采用紫外检测麻味物质。PB-CCD法是针对实验结果影响因素较多时常用的一种优化方法,在天然产物提取工艺条件的优化上,该方法以各因素的极端水平为试验所允许的极值,仅通过一次设计和计算即可得到显著影响提取效率的因素,是筛选试验因素的较好设计方法[9]。因此本次实验选用更为简单的浸提工艺,在单因素实验基础上,以陕产花椒为研究对象,以花椒提取物得率、总酰胺的提取率和羟基-α-山椒素的含量为指标优化提取工艺,以期为陕产花椒的精深加工和综合开发提供借鉴。
1 材料与仪器
花椒购自陕西省韩城市芝阳花椒市场,为芸香科植物花椒ZanthoxylumbungeanumMaxim.的干燥成熟果皮。羟基-α-山椒素(HPLC≥98.0%, 批号M26M10D84025)购自上海源叶生物科技有限公司。实验中所用甲醇、中性氧化铝及其它试剂均为分析纯;色谱甲醇为色谱纯,实验用水为纯化水。
YBS-1000密封粉碎机(上海绿翊机械制造有限公司),524G 恒温加热磁力搅拌器(上海梅颖浦仪器仪表制造有限公司),XM-80超声波清洗器(小美超声仪器有限公司),RE-201D型旋转蒸发仪(上海岐耀仪器设备有限公司),TDL-5A低速离心机(金城海澜仪器制造厂),BT 25S型1/10万分析天平(赛多利斯上海贸易有限公司),UV1901双光束紫外-可见分光光度计(上海之信仪器有限公司),沃特斯2695高效液相色谱仪,配2996DAD检测器,Empower工作站(美国Waters公司)。
2 方法与结果
2.1 实验流程
花椒→粉碎→过筛→浸提→纯化→干燥→提取物。
2.2 花椒总酰胺含量测定
2.2.1 对照品溶液的制备 精密称取羟基-α-山椒素对照品10 mg,转移至100 mL棕色容量瓶中,加少量甲醇超声待充分溶解后,再加甲醇补足至刻度线,即得浓度为0.1 mg·mL-1的对照品溶液母液,用锡箔纸包裹严密,置于冰箱中,避光保存备用。
2.2.2 供试品溶液的制备 花椒提取物制备:参考文献[10]的方法制备花椒酰胺提取物,称取花椒粉末100 g(过三号筛),加10倍量甲醇,以60 rpm的转速在50℃浸提4 h,过滤。将滤液减压浓缩至一定体积,过碱性氧化铝层析柱,收集流出液混合至一处,4 000转离心10 min,取上清液回收甲醇,低温干燥即得花椒提取物13.3675 g,室温条件下保存于干燥器内。
供试品制备:精密称取花椒提取物10 mg置于棕色三角瓶中,加100 mL甲醇,称定重量,超声30 min,室温放凉,加甲醇补足重量,过滤即得供试品溶液,用锡箔纸包裹严密,置于冰箱中,避光保存。
2.2.3 最大吸收波长扫描 吸取羟基-α-山椒素对照品溶液置于石英皿中,以甲醇的石英皿为空白对照,通过紫外-可见分光光度计在200~400 nm波长范围内扫描,结果在270 nm处波有最大吸收值,故选用270 nm作为总酰胺含量测定的检测波长。
2.2.4 线性关系考察 将羟基-α-山椒素对照品溶液依次稀释为浓度为20 μg·mL-1、16 μg·mL-1、12μg·mL-1、10μg·mL-1、8μg·mL-1的对照品储备液,在270 nm波长处测定各个溶液的吸光度值。以紫外吸光度为Y值,以不同羟基-α-山椒素浓度为X值,采用最小二乘法拟合标准曲线,方程为Y = 43.164X-0.1084,r=0.9995, 表明羟基-α-山椒素浓度在8~20 μg·mL-1范围内与吸光度呈现良好的线性关系。
2.2.5 精密度试验 将同一浓度羟基-α-山椒素对照品溶液,在270 nm处重复测定吸光度6次,计算RSD值为0.25%,表明仪器的精密度良好。
2.2.6 重复性试验 精密称取6份花椒提取物,每份10 mg,按“2.2.2”项下“置于棕色三角瓶中”开始制备供试品溶液,分别在270 nm处测定吸光度,计算RSD值为1.64%,表明所建立的花椒总酰胺定量检测方法的重复性良好。
2.2.7 稳定性试验 将一份标记好的花椒提取物供试品溶液,用锡箔纸包裹严密,置于冰箱中,避光保存,分别在0 h、1 h、2 h、4 h、6 h、8 h、12 h、24 h的时候取出放至室温,在270 nm处测定吸光度,计算RSD值为1.36%,表明所建立的花椒总酰胺定量检测方法的稳定性良好。
2.2.8 加样回收试验 精密称取9份花椒酰胺提取物,每份5 mg,分为三组。每组分别精密加相当于花椒酰胺提取物中羟基-α-山椒素成分量的80%、100%、120%,按“2.2.2”项下“称定重量”开始制备供试品溶液,分别在270 nm处测定吸光度,计算平均回收率为100.25%,RSD值为2.16%,表明所建立的花椒总酰胺定量检测方法的准确度良好。
2.2.9 花椒总酰胺提取率计算
2.3 花椒酰胺提取物中羟基-α-山椒素含量测定
2.3.1 色谱条件与系统适用性[11~12]采用Thermo C18柱(250 mm×4.6 mm,5 μm)色谱柱,流动相甲醇∶水(0.1%磷酸)=70∶30,检测波长270 nm,流速1.0 mL·min-1,柱温30℃,进样量:10μL。
2.3.2 对照品溶液的制备 同“2.2.1”对照品溶液的制备。
2.3.3 供试品溶液的制备 同“2.2.2”供试品溶液的制备。
2.3.4 线性关系考察 取“2.2.4”项下的对照品储备液。采用高效液相色谱仪自动进样,测定峰面积,以羟基-α-山椒素峰面积为Y值,以不同羟基-α-山椒素浓度为X值,采用最小二乘法拟合标准曲线,方程为Y = 420 319X - 752.81(r = 0. 9992),表明羟基-α-山椒素浓度在8~20 μg·mL-1范围内与峰面积呈良好的线性关系。
2.3.5 精密度考察 将同一羟基-α-山椒素对照品溶液,重复进样6次,测定峰面积,计算RSD值0.72%,表明仪器的精密度良好。
2.3.6 重复性考察 取“2.2.6”项下的6份重复性样品进样,测定峰面积,计算RSD值1.35%,表明所建立的花椒羟基-α-山椒素定量检测方法的重复性良好。
2.3.7 稳定性考察 将同一供试品,分别在0 h、1 h、2 h、4 h、6 h、8 h、12 h、24 h时间点进样,测定羟基-α-山椒素峰面积,计算RSD值1.57%,表明所建立的花椒羟基-α-山椒素定量检测方法的稳定性良好。
2.3.8 加样回收率实验 取“2.2.8”项下的9份加样回收率样品液进样,测定峰面积,计算平均回收率为103.71%,RSD值为2.42%,表明所建立的花椒羟基-α-山椒素定量检测方法的准确度良好。
2.3.9 花椒羟基-α-山椒素提取率计算
2.4 单因素试验考察
花椒提取过程的影响因素包括粉碎粒径,提取溶剂浓度和用量,浸提温度和时间以及搅拌速度6个因素,每个因素取常用5个参数进行单因素实验。因单因素试验次数较多,且总酰胺是重要的评价指标,故单因素以花椒总酰胺含量为指标进行考察。
2.4.1 粉碎粒径考察 根据药典筛得到花椒粉碎粒度分别为24目、50目、65目、80目和100目,每种粒径花椒粉末称取10g,置棕色具塞锥形瓶中,加10倍量100%甲醇,以60 rpm的转速在50℃浸提4 h,按“2.2.2”项下“过滤”开始制备供试品溶液,计算花椒总酰胺提取率。结果见图4-A,用二号筛(24目)过筛时花椒粉和内部果壳纤维不能有效分离,花椒过筛的目数越大(粉碎粒径越小),总酰胺含量越高。但是粒径太小时,因为花椒富含油脂易粘连导致过筛较困难,当粒度为65 目时,提取率最大。当粒度超过80 目,提取率出现下降,可能因为粉末太细,煎煮过程中凝结成团,不利于团块内部的酰胺溶出,故选择65目粉碎粒径继续进行单因素实验,选择50~80目作为后续实验粉碎粒径范围。
2.4.2 提取溶剂考察 精密称取10g花椒粉末(65目)5份,分别置棕色具塞锥形瓶中,加10倍量100%甲醇、80%甲醇、60%甲醇、40%甲醇、20%甲醇,以60 rpm的转速在50℃浸提4 h,按“2.2.2”项下“过滤”开始制备供试品溶液,计算花椒总酰胺提取率。结果见图4-B,80%甲醇的提取率最高,故选80%甲醇作为最佳浓度进行单因素试验,选择60%~100%浓度甲醇作为后续实验提取溶剂浓度范围。
2.4.3 溶剂量考察 精密称取10 g花椒粉末(65目)5份,分别置棕色具塞锥形瓶中,分别加5倍、10倍、15倍、20倍和25倍80%甲醇,以60 rpm的转速在50℃浸提4h,按“2.2.2”项下“过滤”开始制备供试品溶液,计算花椒总酰胺提取率。结果见图4-C,料液比1∶15即达到提取饱和,随着溶剂用量增多,提取率增加不明显反而有一定的减少,有可能是过多的溶剂回收会造成酰胺更多的损失,从节约能源和减少后期回收溶剂等方面考虑,故选15作为最佳倍量继续进行单因素试验,选择10~20倍作为后续实验料液比范围。
2.4.4 浸泡温度 精密称取10g花椒粉末(65目)5份,分别置棕色具塞锥形瓶中,分别加15倍80%甲醇,分别在30℃、40℃、50℃、60℃、70℃,以60 rpm的转速浸提4h,按“2.2.2”项下“过滤”开始制备供试品溶液,计算花椒总酰胺提取率。结果见图4-D,浸提温度在40℃达到最大值,随着温度升高,提取率增加不明显反而有一定的减少,有可能是高温加剧酰胺的氧化损失,故选40℃作为最佳浸泡温度继续进行单因素试验,选择30~50℃作为后续实验浸泡温度范围。
2.4.5 浸泡时间 精密称取10 g花椒粉末(65目)5份,分别置棕色具塞锥形瓶中加15倍80%甲醇,在40℃以60 rpm的转速浸提2 h、3 h、4 h、5 h、6 h,按“2.2.2”项下“过滤”开始制备供试品溶液,计算花椒总酰胺提取率。结果见图4-E,浸泡时间越长提取率越高,4 h后基本饱和,故选4 h作为最佳浸泡时间继续进行单因素试验,选择3~5 h作为后续实验浸泡时间范围。
2.4.6 搅拌速度 精密称取10 g花椒粉末(65目)5份,分别置棕色具塞锥形瓶中加15倍80%甲醇,浸提温度40℃,分别以20 rpm、30 rpm、40 rpm、50 rpm、60 rpm、的转速浸提4 h,按“2.2.2”项下“过滤”开始制备供试品溶液,计算花椒总酰胺提取率。结果见图4-F,浸提转速越高提取率越高,50 rpm达到最大提取率后趋于平和。所以选择50 rpm作为浸提转速继续进行单因素试验,选择40~60 rpm作为后续实验浸提转速范围。
2.5 Plackett-Burman 设计
在单因素试验基础上运用Design-Expert软件的Plackett-Burman模块,对每个因素选取2 个水平(-1、1),考察各因素水平对花椒提取物得率、总酰胺提取率和羟基-α-山椒素提取率的影响。采用总评归一值法[overall desirabilityvalue,OD 值,利用Hassan 法对各效应值进行归一化,本次实验的指标值高越好,因此,归一值di=(yi-ymin)/(ymax-ymin),再对归一值求几何平均值,OD=(d1,d2,…,dn)1/n]的影响[13]。实验因素水平表见表1,结果见表2。
利用Design-Expert软件对实验因素和结果进行方差分析,对模型采用F检验进行方差分析及模型系数显著性检查,结果见表3。

表1 PB实验因素水平
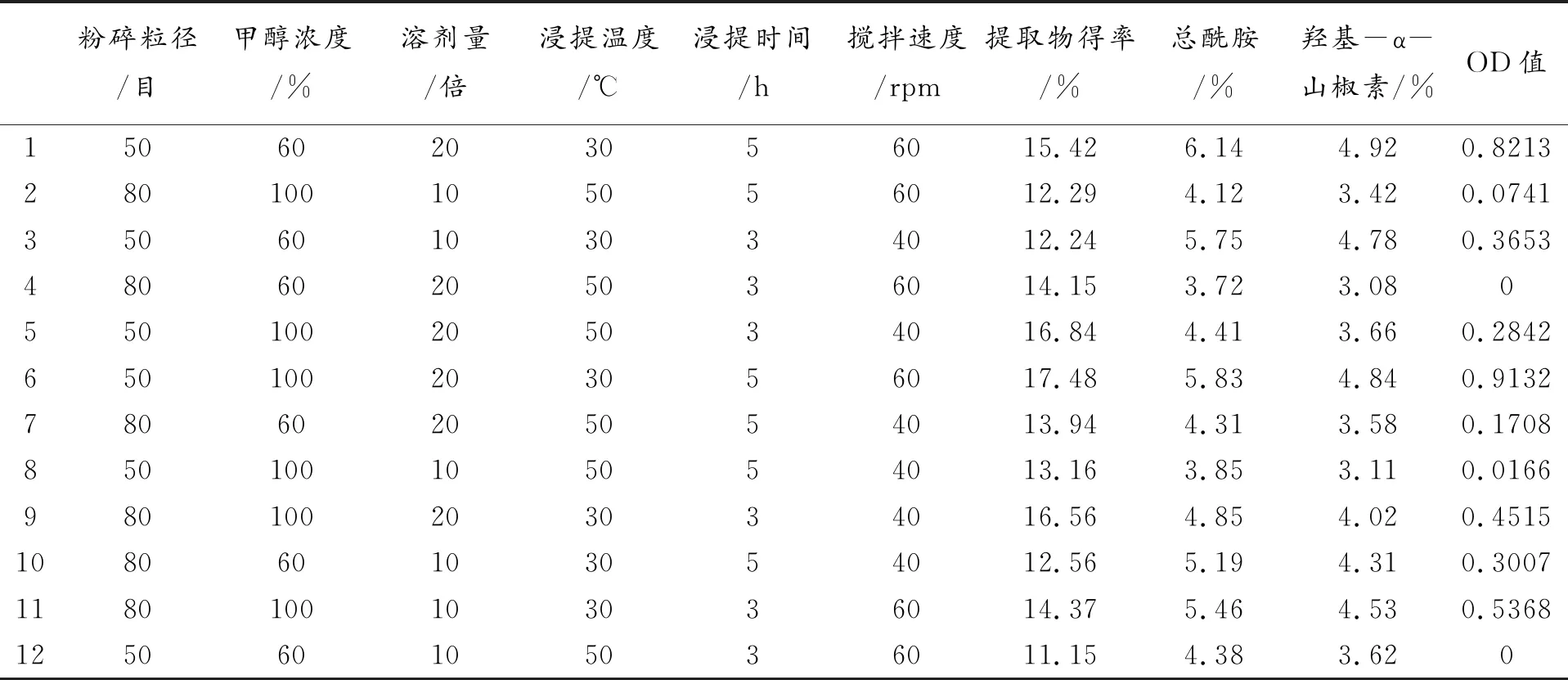
表2 PB实验设计及结果
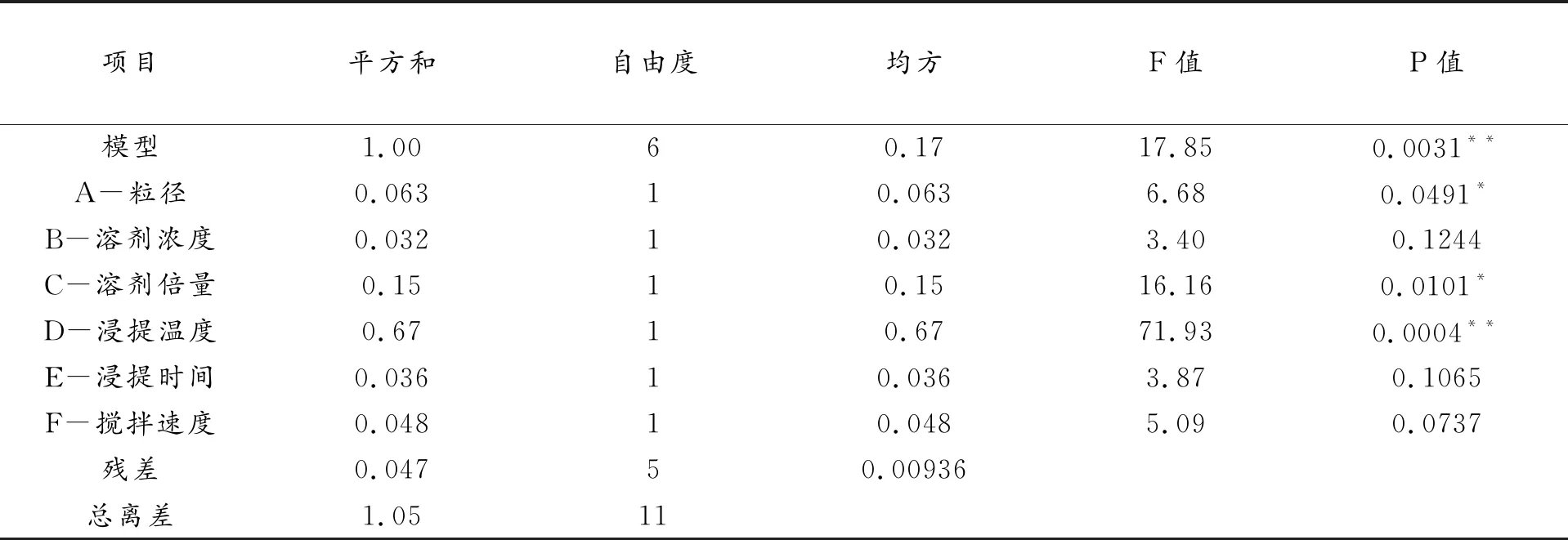
表3 PB实验方差分析结果
由表3 可以看出,所建立的模型具有显著性(P<0. 01),表明该模型可用于花椒酰胺提取因素的显著性分析。其中花椒粉碎粒径(P<0.05)、浸提时间(P<0.01)和溶剂用量(P<0.05)三个因素具有显著性,但是粉碎粒径由过筛目数决定,是一个非连续变量,故将此浸提时间和溶剂用量2个因素作为下一步响应面法优化的因素。甲醇浓度、浸提温度和搅拌速度对实验结果影响不大,因此结合单因素实验结果固定花椒粉碎粒径65目(四号筛),80%甲醇浸提4 h,搅拌速度50 rpm四个因素进行实验。
2.6 Central-Composite Design效应面法优选
在单因素试验和PB实验的基础上,固定花椒粉碎粒径65目(四号筛),甲醇浓度80%,浸提时间4h,搅拌速度50rpm,以溶剂倍量和浸提温度为因变量,以OD值为自变量,根据Design Expert软件的Central-Composite Design中心组合试验模块进行实验设计,因素水平表见表4,实验结果见表5。
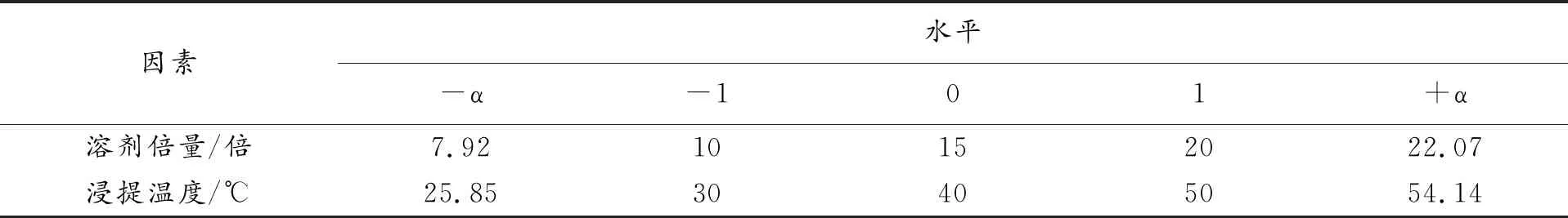
表4 因素水平
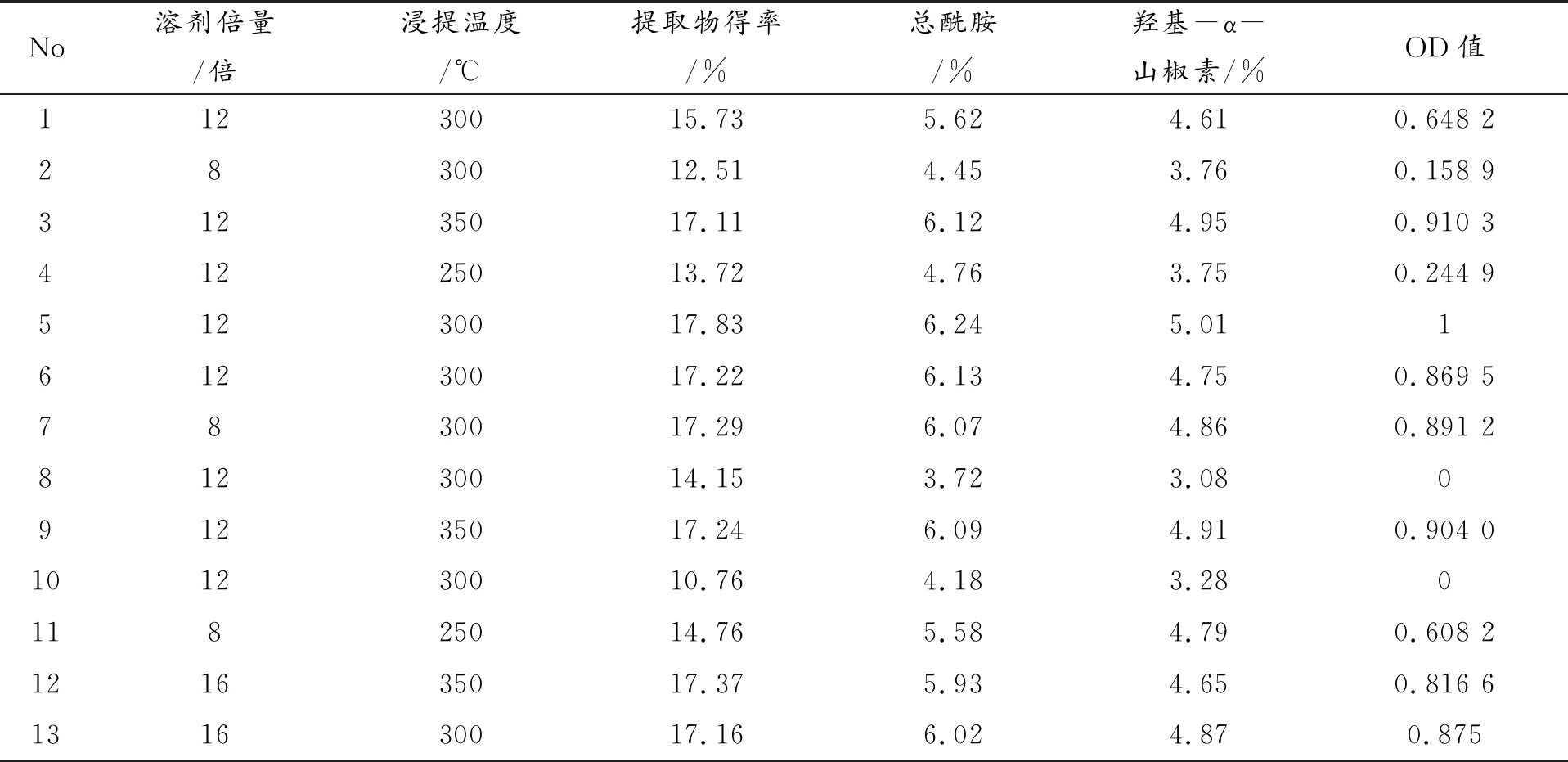
表5 Central-Composite Design实验设计表与效应值
运用Design-Expert软件进行响应面分析,以花椒提取总评值OD值为响应值,对溶剂用量、浸提温度进行多元线性回归二项式方程拟合,拟合的方程模型为OD=0.88+0.19A-0.24B-0.11AB-0.2A2-0.23B2(R2=0.8217;RAdj2=0.6943),对模型采用F检验进行方差分析及模型系数显著性检查,结果见表6。二项式模型P<0.05,说明该方程与实际情况拟合良好。以OD值最大值为目标,根据“Design Expert”软件预算得最佳花椒提取工艺参数为:溶剂倍量19倍,浸提温度32℃,此情况下OD值预测最大值1.0089。OD值提取率与溶剂倍量和浸提温度的三维效应面曲线见图5。
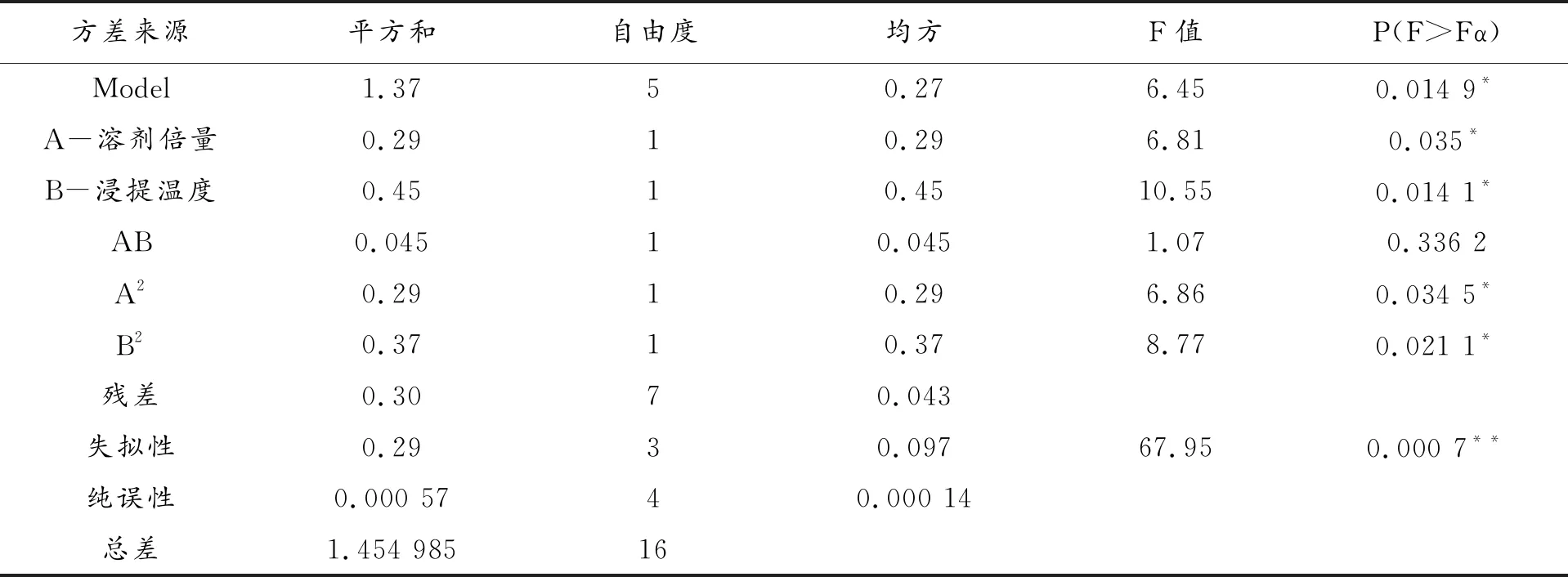
表6 Central-Composite Design实验方差分析结果
2.7 提取工艺参数验证
根据实际条件的可操作性,将工艺条件优化为:花椒粉碎粒径65目(四号筛),甲醇浓度80%,溶剂倍量19倍,浸提温度32℃,搅拌速度50rpm,浸提时间4h,结果见表7。
花椒提取物得率为17.91%,总酰胺提取率为6.32%,羟基-α-山椒素提取率为4.99%,平均OD值为1.0161>1.0089。由结果可知,通过PB-CCD实验优化所得花椒提取工艺模型预测值与实际提取值结果接近,表明建立的花椒提取工艺模型预测性良好。
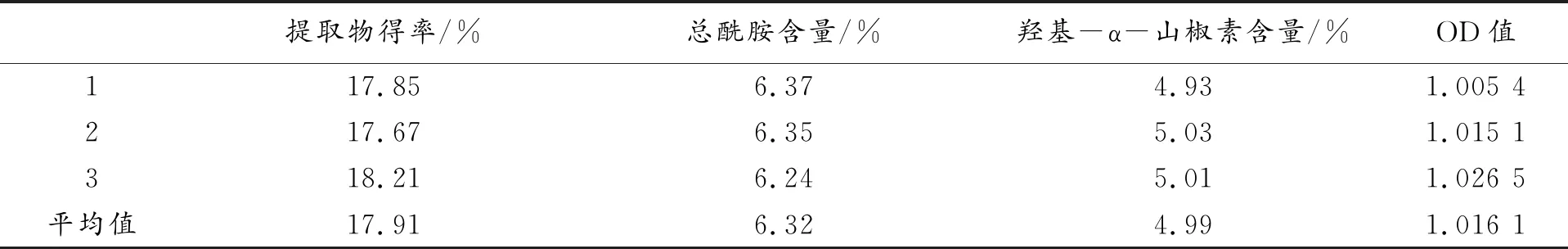
表7 验证试验结果
3 讨论
花椒作为典型的药食同源物质,作为食物是因为其特有的麻味风味,作为中药温里药是因为其性辛温,都与其所含酰胺类成分有关。日本学者以人体的刺麻感受作为指标的研究结果表明花椒中以羟基-α-山椒素为主的酰胺类成分是其产生麻感的主要成分[14~15]。但是由于花椒酰胺化学结构中含有大量的共轭三烯键,在室温的条件下就极易被氧化,其氧化物的麻度降低[16]。本项目制备的花椒总酰胺提取物其稳定性要高于高纯度的花椒酰胺,且提取方式都有利于工业化生产。研究结果为花椒的进一步开发利用提供了一定的借鉴,也为花椒产业深加工所面临的问题进行了一定的探索。

