MRI动态增强TIC类型及ADC值在乳腺癌诊断中的价值
方 亮 金 晶 何玉圣
乳腺癌(breast cancer)是女性常见的恶性肿瘤,目前发病率已高居女性恶性肿瘤的首位, 全球范围内统计每年新增120万女性乳腺癌患者,约有50万人死于乳腺癌[1],乳腺癌的早期发现可以改善患者的预后,而这主要依赖于影像学检查。近年来,随着磁共振成像(MRI)扫描技术的飞速发展,其在乳腺疾病中的应用越来越广泛,在对于乳腺癌的检出、诊断和分级方面有明显的优越性,尤其在早期乳腺癌的诊断中有很重要的应用价值[2-3]。本文回顾性分析70例临床诊断为乳腺肿块的患者乳腺MRI图像,以手术病理为金标准,分析乳腺癌组及良性对照组的动态增强时间-信号曲线(TIC)类型以及表观扩散系数(ADC)的差异性,探讨MRI在乳腺癌中的诊断价值。
1 资料与方法
1.1 一般资料 收集2015年1月-2019年6月经我院诊治的女性乳腺肿块患者70例。入组标准为:①所有患者于术前进行乳腺核磁共振检查,并且在检查前未进行任何穿刺活检或放、化疗等治疗手段。②所有患者为非哺乳期,乳腺病灶均为肿块型。以手术病理结果为金标准,分为乳腺癌组及良性病灶对照组。乳腺癌组患者年龄29~74岁,平均年龄(50.39±11.19)岁。良性病灶对照组患者年龄26~65岁,平均年龄(40.28±10.69)岁。
1.2 检查方法 MRI检查设备为西门子Verio Dot 3.0T超导扫描仪,采用四通道乳腺相控阵表面线圈。患者俯卧位,让双乳自然悬垂于乳腺专用线圈内。扫描序列和参数如下:常规行3D FLASH T1WI及TSE T2WI脂肪抑制序列;扩散加权成像(DWI)采用平面回波(EPI),TR/TE=4400 ms/56 ms,扩散敏感度b值分别为50和800,FOV为400 mm,层厚为4.0 mm。在DWI成像后进行动态增强扫描,采用3D快速小角度激发序列(3D FLASH),TR/TE=4.32 ms/1.56 ms,翻转角度为10°,FOV为360 mm,层厚为1 mm,激励次数1次。动态增强扫描为6组序列,间隔2 min连续扫描。第2个序列开始时从肘静脉注入Gd-DTPA,用量0.2 mmol/kg,动态增强扫描结束后,加扫T1WI 3D FLASH冠状位,评估双侧腋下淋巴结情况,总采集时间约20 min。
1.3 图像分析 分别由两位三年以上主治医师进行回顾性阅片,将动态增强图像信息传输至SyngoMMWP后处理工作站(version VE40B),测量并记录病灶的TIC强化类型及ADC值,当有意见分歧时由第三位高年资医师再对图像进行分析,由三人协商达成一致。测量时选择病灶强化较为明显的区域,避开坏死、囊变区以及正常乳腺腺体组织。根据TIC曲线的形态特征,可将其分成三种类型:①Ⅰ型(流入型):动态增强扫描时病灶信号强度持续增加,后期信号增加在10%以上。②Ⅱ型(平台型):动态增强扫描早期时病灶信号强度增加,至动态增强中后期时,信号强度升高或者下降均<10%。③Ⅲ型(流出型):动态增强扫描早期病灶信号强度增加,至中后期降低且幅度在10%以上。ADC值的测量时参考T1WI增强轴位图像,在病灶实性成分范围多大的层面,选取三个以上兴趣区,兴趣区面积均不小于3 mm2,取三次测量ADC值的平均值。
1.4 统计学方法 使用SPSS 25.0统计软件分析数据,采用χ2检验分析良性组及乳腺癌两组间TIC类型是否有差异性,以及两组间不同TIC类型的两两比较也采用χ2检验;采用t检验评估ADC值是否有差异,P<0.05表示差异有统计学意义。
2 结 果
2.1 手术及病理结果 本组70例患者均行乳腺肿块手术并获得病灶70枚,经组织病理学检查为良性病灶32例(其中纤维腺瘤20例、导管内乳头状瘤5例、腺病4例、良性叶状肿瘤2例、慢性炎症1例),恶性病灶38例(其中浸润性导管癌31例、浸润性小叶癌4例、导管原位癌2例、髓样癌1例)。
2.2 MRI影像分析结果 乳腺良性病灶组中I型曲线21例(21/32,65.6%),Ⅱ型曲线11例(11/32,34.4%),良性组中无Ⅲ型曲线。乳腺癌组中I型曲线1例(1/38,2.6%),Ⅱ型曲线10例(10/38,26.3%),Ⅲ型曲线27例(27/38,71.1%)。TIC类型在乳腺癌组及良性病灶中有统计学意义(见表1)。采用χ2检验比较不同TIC类型在良性组及乳腺癌组之间的差异性,统计结果表明在良性病灶组中以Ⅰ型曲线多见(图1),乳腺癌组中以Ⅲ型曲线多见(图2),两类曲线对于良恶性乳腺病变的鉴别差异有统计学意义(P<0.01)。而Ⅱ型曲线在良恶性组中有较多重叠,对于良恶性鉴别差异无统计学意义(P>0.05),见表2。ADC值采用独立样本t检验,统计发现良性病变组患者ADC值明显大于乳腺癌组,差异具有统计学意义(P<0.01)。

表1 乳腺癌组与乳腺良性病变组TIC类型及ADC值的差异性 例(%)

图1 右乳纤维腺瘤MRI影像

表2 乳腺癌组与乳腺良性病变组不同TIC类型的两两比较
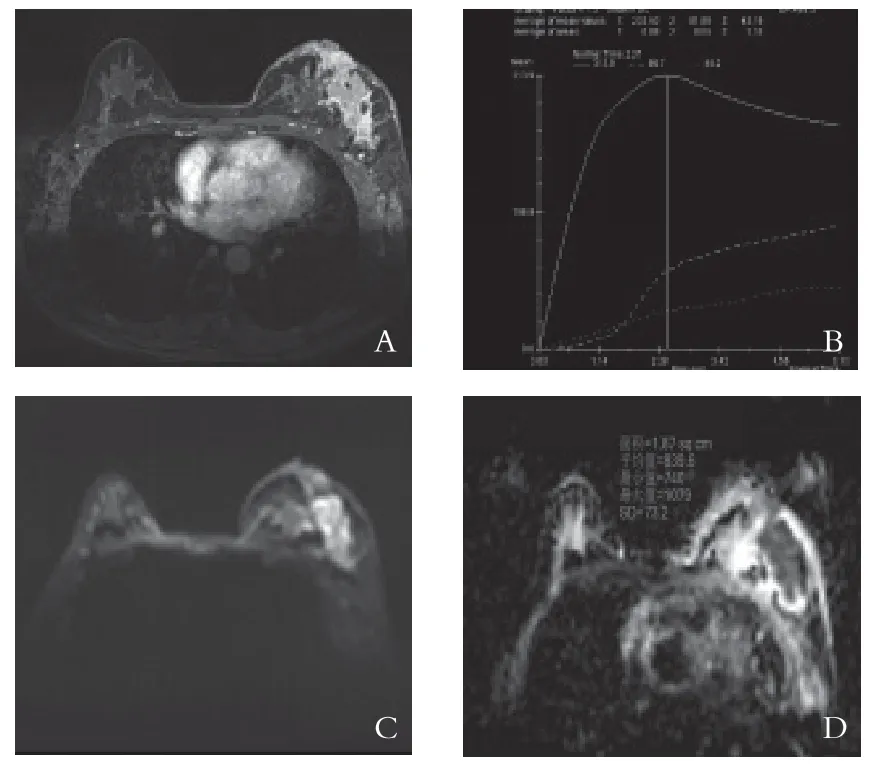
图2 左乳浸润癌MRI影像
3 讨 论
乳腺癌是血管依赖性肿瘤,所以一般血供较为丰富,肿瘤内的微血管是关系到病灶生长的重要因素。基于乳腺对比剂动态增强扫描(DCEMRI)根据不同时间节点病灶内对比剂浓度情况进行评估,获取的病灶时间-信号强度(TIC)曲线类型可以较为直观的反映出肿瘤内微血管生长及间质成分的信息。增强扫描组织信号强度变化主要与对比剂在血管的分布有关[4],增强扫描早期的强化程度与病灶的血管丰富程度和血液灌注情况密切相关,影像其强化程度的因素包括微血管密度、管径、管壁渗透性以及肿瘤组织的细胞外间隙宽度等。根据这个原理,大部分类型的乳腺癌因为微血管丰富,早期即出现明显强化但同时其内还有较多异常的动-静脉吻合支,导致对比剂快速流出,形成了流出型的Ⅲ型曲线。而乳腺大部分良性病变内的微血管数量和密度以及毛细血管通透性等均不如乳腺癌,所以对比剂流出缓慢呈Ⅲ型流出型曲线。但在Ⅱ型曲线中,乳腺良恶性病灶表现有较多的重叠,在本组病例中两组间差异无统计学意义,需要结合其他序列综合判断。本组病例分别以Ⅰ型、Ⅲ型曲线作为对良恶性乳腺肿瘤的判断差异具有明显统计学意义,与既往文献报道相符[5]。在乳腺癌组中有1例表现为I型曲线,推测可能与肿瘤内的纤维成分和黏液成分相关,因本组病例样本不足,未能对不同病理类型的乳腺癌与TIC曲线的关系进行进一步分析。所以在诊断中,如果有病灶的TIC曲线表现为I型曲线,但其形态学特征具有恶性征象时,仍要考虑乳腺癌可能。而血流灌注表现为恶性时不能完全除外恶性,应建议活检检查。两者结合可提高乳腺癌的诊断准确性[6]。
弥散加权成像(DWI)是在体观察水分子微观扩散运动的功能成像,是目前唯一可以观察活体水分子扩散运动的检查。在多b值DWI扫描的基础上测量表观弥散系数(ADC值)对病灶内水分子弥散受限程度进行量化分析,从而对病变良恶性进行推测。一般恶性肿瘤生长迅速,细胞繁殖较快,细胞密度较高,细胞外间隙小,因此恶性肿瘤内水分子运动受限,扩散受限,ADC值越小。良性病变细胞密集程度低,因此水分子弥散活动相对较强,ADC值越大。因此选择正确的b值是获得较高对比度的图像从而测量得到相对精确的ADC值是诊断的关键[7]。b值取50~1000 s/mm2都是可取的。本组病例的b值选取为50 s/mm2、800 s/mm2;王开香等[8]研究认为选取ADC值的阈值为1.25× 10-3mm2/s时,低于此值,表明扩散受限明显,诊断为恶性,以此为标准诊断乳腺癌的敏感性为88.2%,特异性为86.7%。乳腺病变的ADC值与病变内细胞密度具有较好的相关性。经本组病例统计良性组ADC值为(1.49±0.15)×10-3mm2/s,乳腺癌组ADC值为(0.84±0.14)×10-3mm2/s,两者之间的差异具有统计学意义(χ2=18.751,P= 0.000)。当然,单凭ADC值是不能给予全面的诊断信息,因为ADC图像空间分辨率差,对于病变的形态、边缘及与周围结构关系等评价较差、测量误差等因素,所以一般不作为独立的乳腺癌诊断依据,但可在平扫及DCE-MRI基础上作为有效的补充检查方法。
总之,MRI作为一种多方位、多序列的多模态检查方法,在常规序列的基础上,结合MRI动态增强时间-信号曲线类型及MRI表观扩散系数,可以提高乳腺恶性肿瘤的检出率,在乳腺良恶性病变的鉴别诊断中发挥较大的作用。

