LED蓝光对受旱脱毒马铃薯植株生长的影响
雒佳铭,张宇阳,邱 明,徐志刚
(1.南京农业大学农学院,江苏 南京 210095:2.苏州纽克斯电源技术股份有限公司,江苏 苏州 215143)
引言
光是影响植物生长发育的重要环境因子[1],植物工厂主要利用人工光源对植物进行合理补光。相较于传统光源, LED具有光效高、发热低、体积小、寿命长等特点[2],已经逐渐成为植物工厂主流光源设备。马铃薯是世界第四重要的粮食作物,在保障粮食生产与安全有着重要的作用,但马铃薯脱毒原原种的产能和供应不足是制约我国马铃薯产业发展的瓶颈。利用植物工厂培育马铃薯脱毒原原种是解决这一问题的可选途径之一,并采用LED光源为脱毒马铃薯植株生长提供光照。在植物工厂里培育马铃薯原原种,其水分管理非常重要,理想的条件是让马铃薯植株在水分供应偏紧的条件中生长,这是因为在水分供应充足的条件下,马铃薯植株容易感病、发病,如早疫病、晚疫病、枯萎病等。但是如果偏紧的水分供应控制不当,又会引起植株不可逆损伤,导致生长发育受阻、原原种薯产量降低。我们在前期试验中发现,蓝光处理的马铃薯植株所需灌溉量较少,并且长势良好。为探究蓝光对植株受旱性能的影响,我们以脱毒马铃薯植株作为供试材料,从马铃薯的形态,光合作用和逆境生理三方面探究LED蓝光对受旱脱毒马铃薯植株生长的影响,以期为脱毒马铃薯原原种植物工厂生产的光谱与水分调控提供借鉴。
1 材料与方法
1.1 试验材料及处理
1.1.1 试验材料的制备
马铃薯(SolanumtuberosumL.)品种为“Favorita”,脱毒植株取自南京农业大学农学院植物光生物学课题组的植物组培室。马铃薯脱毒外植体在装有30 g L-1蔗糖和6.5 g L-1琼脂MS培养基的组培瓶中生长。在对装有培养基的组培瓶实施高压灭菌前的15分钟,将培养基的pH调节至5.8。将植有脱毒马铃薯外植体的组培瓶置于培养室中培养21天后得到脱毒苗,将组培瓶移出组培室,置于光强为300 μmol m-2s-1白光LED下驯化1 d,于次日上午选取长势相同的脱毒苗从培养瓶中取出,并将根部洗净,用生根液浸泡30 min,移栽至质量相同的培养袋中培养,以蛭石为培养基质,在300 μmol m-2s-1白光LED下预培养3周,构建健壮植株群体。
1.1.2 试验处理
选取长势一致的马铃薯植株,随机分成两组,分别置于光强为300 μmol m-2s-1的白光(W)与蓝光(B)LED灯下。试验期间的环境温度控制在白天21 ℃,夜晚16 ℃,空气湿度75%±5%,二氧化碳浓度400 ppm。生长一周后,浇水至饱和,用称重法保证各处理起始水分含量一致,再从两组处理中选取长势相同的植株,再分成两组,其中一组处理每隔两天浇一次水,使植株保持良好持水量(WW和WB)。另一组持续一周不浇水(DW和DB),其余生长条件不变。每各处理组30株,共3次重复试验。观察记录四组处理的生长指标及各项生理指标。
1.2 测量指标与方法
1.2.1 失水率的测定
将马铃薯浇水至饱和,称量每个处理组初始马铃薯的栽培袋的初始质量为m0。每隔2天称量栽培袋的质量为每隔两天称量马铃薯栽培袋的质量分别为m0、m1、m3、m5、m7、m9,其与m0差值即为失水量,失水量与m0的比值即为失水率(每次测量后将待测马铃薯挖出进行称重,与初始马铃薯质量的差值作为差异系数,对马铃薯因生长所造成的失水率的偏差进行调整)。
1.2.2 形态及生物量的测定
各处理随机选取3 株,用游标卡尺测量马铃薯植株的根长,茎长、茎粗,并统计马铃薯的分枝数。利用叶面积计测量马铃薯植株的叶面积。使用天平分别称量茎、叶根和薯的鲜重(FM),然后将茎、叶、根和薯分别置于烘箱内于105 ℃杀青0.5 h,之后于80 ℃烘干至恒重取出测定各个部位的干重(DM)。
1.2.3 光合参数的测定
在9:00—11:00随机选取各处理三株长势平均的植株,利用光合仪LI—6400测量各处理下倒3片功能叶顶生叶片的光合参数,光合仪初始条件设置如下:光密度为300 μmol m-2s-1,CO2浓度为390±5 ppm。待仪器数据稳定后读取仪器上净光合速率(Pn)、气孔导度(Cond)、胞间二氧化碳浓度(Ci)、蒸腾速率(Tr)等参数。
1.2.4 逆境生理指标的测定
逆境指标参照李合生[3]的方法测定,其中脯氨酸浓度采用磺基水杨酸法测定,丙二醛含量采用硫代巴比妥酸法测定,POD酶活性采用愈创木酚法测定,SOD酶活性采用氯化硝基四氮唑蓝法测定,CAT酶活性采用紫外分光光度计测量。
1.3 数据统计与分析
利用Microsoft Excel 2013软件处理原始数据。采用Microsoft Excel 2013图表作图,借助SPSS软件利用单因素方差分析(ANOVA)和Duncan检验对不同处理进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 LED蓝光对脱毒马铃薯植株失水率的影响
图1是水分限制下白光和蓝光马铃薯失水率的变化,可以看出,在限水3 d后蓝光的失水率低于白光。
2.2 LED蓝光对受旱脱毒马铃薯植株形态及生物量的影响
由表1可知,DB大于DW,茎长茎粗叶面积DB小于DW,茎长茎粗差异不显著,叶面积差异显著。对照组呈现了相同的趋势,可以看出蓝光促进了地下部的根长,但抑制了地上部的茎长、茎粗以及叶面积。
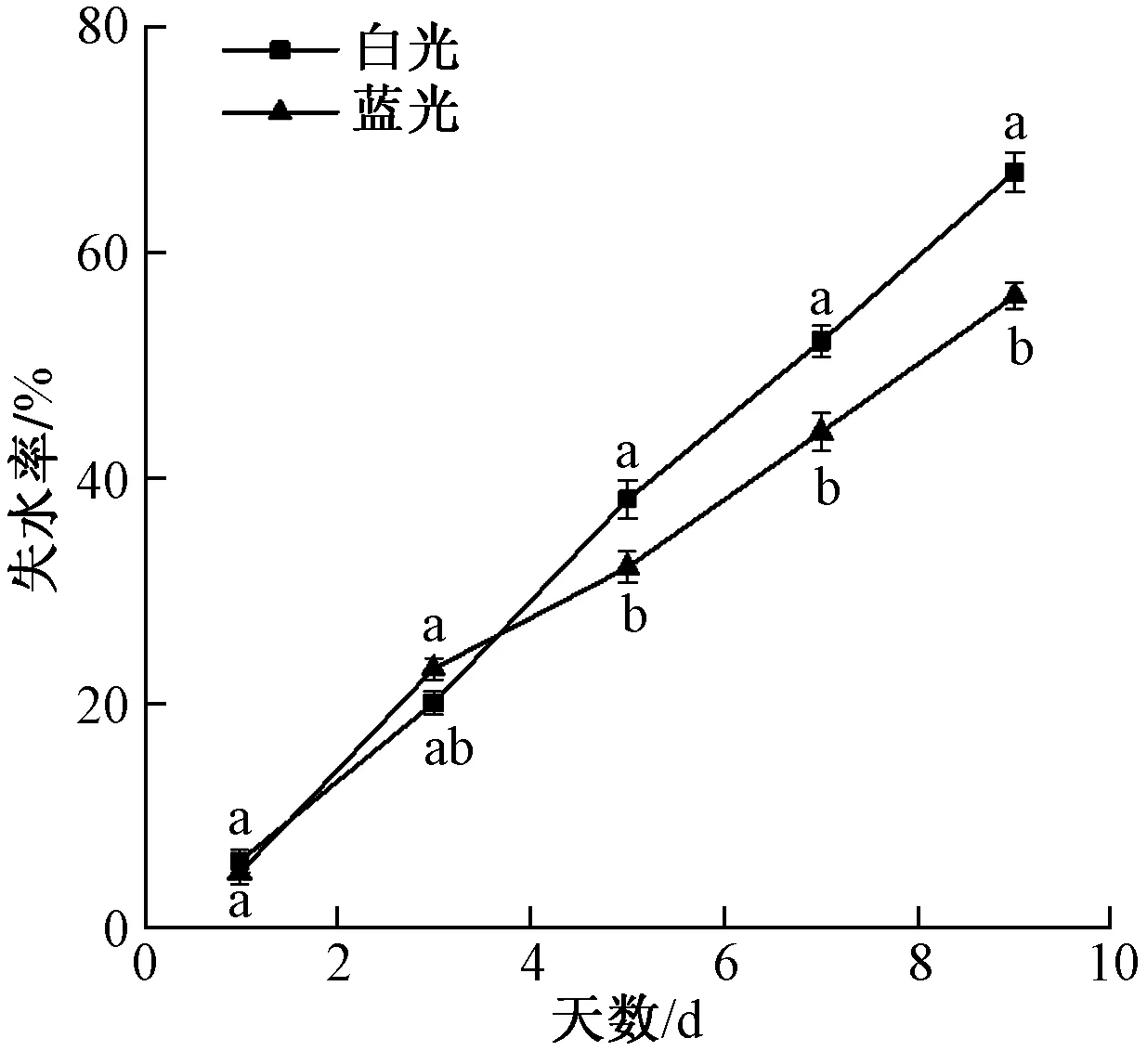
图1 水分限制下蓝光及白光马铃薯植株失水率的变化Fig.1 Changes of bluelight and white light on potato water loss rate under water restriction

表1 不同水分处理下蓝光和白光对马铃薯形态的影响
由表2可以看出,蓝光光对马铃薯的根和叶的鲜重影响不大,但是对叶的鲜重有着一定的影响。其中WB低于WW。在薯的生物量上,WB薯鲜重高于WW,但差异不显著。蓝光对受旱马铃薯薯的鲜重没有引起明显差异。

表2 不同水分处理下蓝光和白光对马铃薯各个部位鲜重的影响
2.3 LED蓝光对受旱脱毒马铃薯植株光合的影响
由表3可以看出,蓝光对马铃薯的各项光合指标均有一定的影响,其中,蓝光显著增加了马铃薯的气孔导度和蒸腾速率。但由于蓝光会降低马铃薯的叶面积(表1),因此,尽管蓝光引起了气孔导度和蒸腾速率的提升,但由于蓝光导致叶面积减少,因而使马铃薯植株产生较低的失水率。在净光合速率上,DB处理显著高于DW。由此可见,蓝光诱导植株产生适应于受旱的形态变化,这种形态变化主要体现在缩小叶面积、提高气孔导度,以此来减少水分散失并维持叶片的光合速率,缓解因干旱造成的植株叶片光合作用降低。

表3 不同处理下蓝光和白光对马铃薯叶片光合参数的影响
2.4 LED蓝光对受旱脱毒马铃薯植株逆境生理的影响
图2中,DB处理脯氨酸浓度低于DW,WB处理脯氨酸浓度低于WW。说明生长在蓝光下的马铃薯植株脯氨酸的积累低于白光。
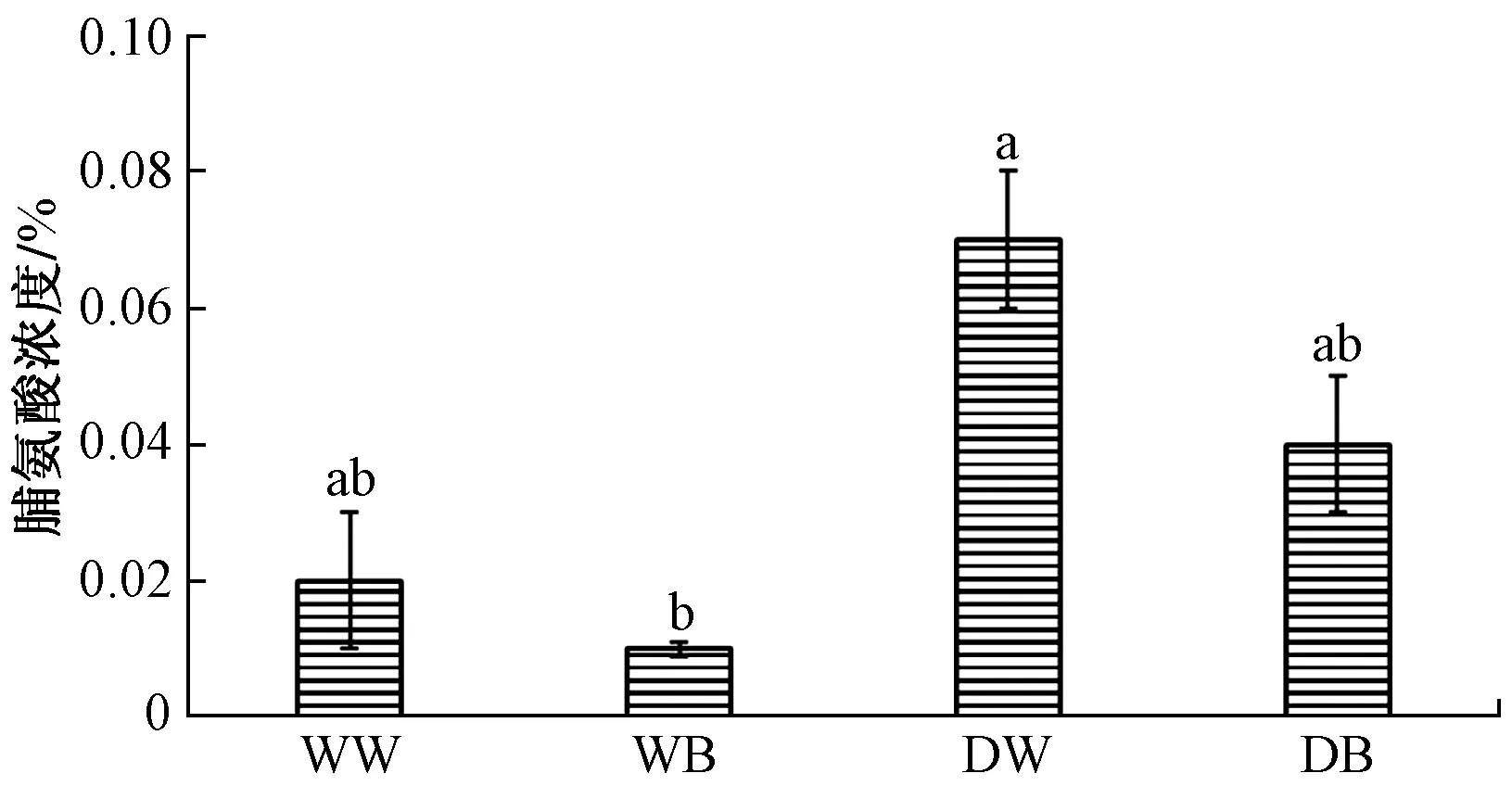
图2 蓝光和白光对马铃薯叶片脯氨酸含量的影响Fig.2 Effects of blue light and white light on proline content of potato leaves under different water treatments
图3中,DW处理丙二醛含量最高,为12.43 μmol g-1FW,WB处理丙二醛含量最低,为3.23 μmol g-1FW。并且DB处理低于DW,WB处理低于WW,蓝光显著降低了马铃薯体内丙二醛的含量。
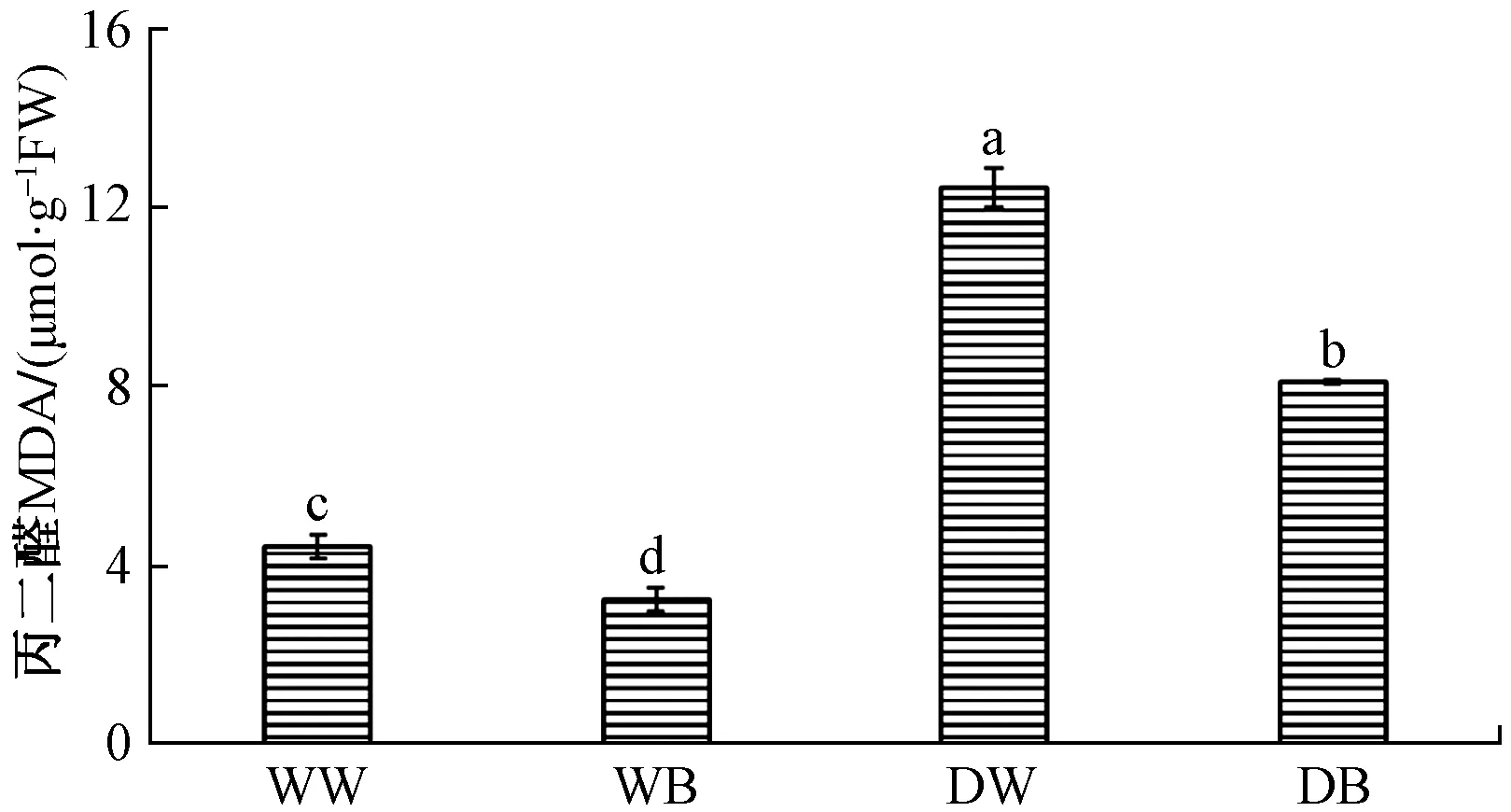
图3 不同水分处理下蓝光和白光对马铃薯叶片丙二醛含量的影响Fig.3 Effects of blue light and white light on MDA content of potato leaves under different water treatments
表4中,POD酶活性DB显著高于DW,CAT酶活性与之趋势相同。SOD酶活性无明显差异。表明蓝光显著提高了受旱马铃薯POD和CAT酶活性,但是对SOD酶活性无明显影响。
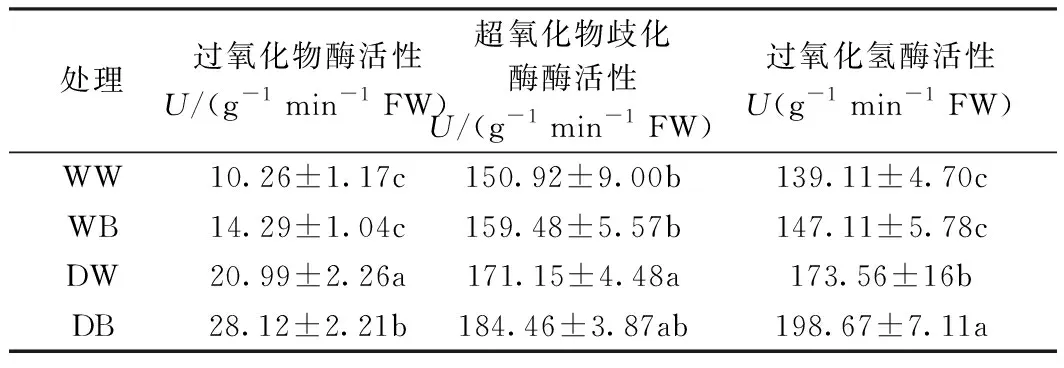
表4 不同水分处理下蓝光和白光对马铃薯叶片抗氧化酶活性的影响
3 讨论
本研究中,在持续不浇水的一段时间内,蓝光下的马铃薯植株相较于白光在3 d后失水率显著降低。蓝光处理下,马铃薯植株的茎长,茎粗和叶面积有着明显降低的现象。这是由于光诱导而产生的形态适应性。这与张玉斌[4]在光质与西洋参的关系中结果相同。在许多植物物种中,水分损失较多与具有较大蒸发表面和水分含量高的器官密切相关。自然环境中,植物通常通过矮化植株并且缩小叶面积从而能够减少蒸腾作用并提高抗旱性[5]。
正常浇水与干旱处理下蓝光都会增加马铃薯植株的气孔导度和蒸腾速率。这与李雯琳[6]等用莴苣叶片的研究相一致。蓝光增加了马铃薯叶片的气孔导度和蒸腾速率上升,但是表现出了耐旱性状,虽然蒸腾速率的增加以及气孔导度的提高使得马铃薯叶片蒸腾作用增加,但由于蓝光可以降低马铃薯的叶面积,结合两种指标,马铃薯会表现出抗旱性状。同时,干旱会降低植物的光合电子传递效率以及光合磷酸化活力,影响碳同化,从而降低植物的光合作用。受胁迫时,净光合速率和气孔导度下降,而细胞间CO2浓度(Ci)的变化却是不同的[7]。蓝光显著促进了马铃薯叶片的光合作用,对干旱下叶片光合能力的下降有缓解作用。用蓝光比例高的处理照射黄瓜叶片也能提高其光合速率[8]。
蓝光明显降低了脯氨酸含量。说明蓝光下马铃薯具有更好的生理状况。细胞膜是细胞物质交换的主要场所,细胞膜的完整及其稳定性是维持细胞正常新陈代谢的基础。MDA 是膜质过氧化的产物,正常条件下含量很低,但干旱会使 MDA 含量增加[9],在本试验中蓝光处理丙二醛含量较低。处于逆境下的植物自身常形成一些防御机制, 如活性氧的酶促清除系统,能有效清除体内多余的活性氧。抗氧化酶防御系统的超氧化物歧化酶(SOD),过氧化物酶(POD)和过氧化氢酶(CAT)活性上升是植物对耐旱性的适应性反应[10]。本研究SOD酶变化较不明显,这与高兴国等[11]的试验相吻合,而 POD 活性和CAT活性均变化明显,二者协同作用,在不同程度的胁迫下分别起到清除自由基的作用,以降低自由基对植株造成伤害。
综上,在干旱处理下,蓝光可以通过调节马铃薯植株的形态,提高马铃薯的光合作用,减少丙二醛、脯氨酸等物质的积累,同时提高马铃薯的抗氧化酶活性,使得蓝光刺激对马铃薯植株的抵御干旱有积极影响。

