无核葡萄离体胚珠发育影响因子及其生理变化
李桂荣,全冉,程珊珊,侯小进,樊秀彩,扈惠灵
(1河南科技学院园艺园林学院,河南新乡 453003;2河南省园艺植物资源利用与种质创新工程研究中心,河南新乡 453003;3中国农业科学院郑州果树研究所,郑州 450009)
0 引言
【研究意义】种子败育型无核葡萄获得种胚后代的最有效方式是采用离体胚挽救技术[1]。无核葡萄胚挽救技术包括胚珠离体培养、胚萌发和成苗3个阶段[2-8],其中在第一个阶段获得大量的发育胚珠是基础,但前期的研究实践发现胚珠离体培养阶段的发育率低,一般都低于30%[9-15],这是目前无核葡萄胚挽救育种过程中的一个瓶颈问题。因此,摸索无核葡萄离体胚珠发育的最佳培养条件,探究培养条件与离体胚珠发育生理变化的关系,减少胚败育,有助于提高胚珠发育率,对于今后无核葡萄胚挽救育种效率的提高至关重要。【前人研究进展】1982年,RAMMING等[9]首次报道利用改良的 White培养基培养无核葡萄胚珠,获得两株实生苗。此后,很多研究者继续深入研究亲本基因型、取样时期、培养基及其相互作用等对无核葡萄胚挽救育种的影响[16-21]。亲本基因型的筛选与胚挽救技术是提高育种效率的重要因素[1]。‘红宝石’无核葡萄(Ruby seedless grape)属无核晚熟红色葡萄品种。选用‘红宝石’无核葡萄作为无核葡萄胚挽救杂交亲本易获得杂交后代[22-24],目前以‘红宝石’无核葡萄为亲本,通过胚挽救技术已获得了‘紫丰’[25]和‘秦红1号’[26]无核葡萄新品种。因此,‘红宝石’无核葡萄是适宜开展无核葡萄胚挽救育种的主
要品种之一。而以‘红宝石’无核葡萄作母本进行胚珠离体培养时,胚珠发育率也很低,仅为 2%—28.3%[4,15,18,21,27-29]。前人在无核葡萄胚珠离体培养阶段,多数是从抑制幼胚早期萌发、防止幼胚夭亡或者畸形胚萌发的角度出发,采用各种培养方式抑制离体胚珠内胚的早期萌发,如采用低温处理胚珠、培养基附加 60 g·L-1蔗糖等手段离体培养胚珠,而且培养时间较长,最少8周,有的甚至达到9—10周[16-21]。这个培养方式已经采用了很多年,但这是否为无核葡萄胚挽救育种过程中胚珠发育率低的限制因素,目前尚未进行深入研究。【本研究切入点】无核葡萄早期胚珠离体培养的研究报道中优选或采用的基本培养基有多种类型,其中MM3、改良MM3以及固液双层培养基(改良MM3固体培养基+少量ER液体培养基)都表现出较好的使用效果[4,12,18],附加60 g·L-1的蔗糖含量最为常见,没有更多的比较研究[1],而这个阶段离体培养时间最少都是 8周,胚珠发育率一直都低于30%[9-15]。据此,本研究以无核葡萄胚挽救育种中常用母本品种‘红宝石’无核为试材,比较研究基本培养基、蔗糖浓度、培养时间等关键因子在不同处理组合下对早期离体培养胚珠发育的影响,并探究培养条件与胚珠发育生理状态间的关系。【拟解决的关键问题】确定提高胚珠发育率的离体培养条件;明确不同培养条件与离体胚珠生理活性间的相关程度,为进一步优化培养条件,减少葡萄胚败育发生奠定基础。
1 材料与方法
试验于 2018—2019年在河南科技学院和中国农业科学院郑州果树研究所进行。
1.1 试验材料
选择种子败育型、品质优良的欧亚种(VitisViniferaL.)无核葡萄品种‘红宝石’无核(Ruby seedless grape)为试验材料,于自然授粉65 d后摘取葡萄幼果(图1-A),4℃冷藏备用。
1.2 试验方法
1.2.1 胚珠离体培养 在超净工作台上,将消过毒的无菌幼果粒剖开,选取大小一致的胚珠(图 1-B)接种在附加不同蔗糖含量的不同培养基上培养,固体培养基添加7.0 g·L-1琼脂和1.5 g·L-1活性炭,pH为6.0(表1)。每个培养基处理接种30瓶,每瓶10个胚珠。培养的环境条件为:温度(25±2)℃,相对湿度50%—60%,暗培养。

表1 不同培养基处理Table 1 Different medium treatments
1.2.2 不同离体培养时间处理 不同培养基处理下接种胚珠后,分别培养42、49、56和63 d,研究不同离体培养时间对胚珠发育的影响。
1.2.3 胚珠发育率统计 统计不同处理下的发育胚珠数,胚珠里没有胚视为未发育胚珠,含有1个胚视为发育胚珠(图1-C)。每3瓶共计30个离体胚珠算1次重复,共3次重复。胚珠发育率(%)=发育胚珠个数/接种胚珠总数×100。
1.2.4 生理指标测定 淀粉含量、可溶性蛋白含量、总酚含量、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性和多酚氧化酶(PPO)活性的测定均采用北京索莱宝公司试剂盒进行测定,型号分别为BC0700、PR1400、BC1340、BC0170、BC0090、BC0195。每个指标类型重复测定3次。
1.2.5 胚萌发率统计 胚珠离体培养42、49、56和63 d后,分别将发育胚珠内的胚(分别标记为E1、E2、E3和 E4)剥出,统计总胚数,接种到胚萌发培养基上,离体培养30 d后,统计胚萌发总数(胚的子叶、胚根有伸长的视为萌发胚)。胚萌发率(%)=萌发胚个数/接种胚总数×100。胚萌发培养基为 WPM+IAA 1.0 mg·L-1+6-BA 0.5 mg·L-1+GA32.0 mg·L-1+琼脂 7.0 g·L-1+蔗糖 20 g·L-1+活性炭 1.5 g·L-1,添加 Put 2 mmol·L-1+ Spm 2 mmol·L-1+ Spd 2 mmol·L-1,pH 为 6.0。培养环境条件:温度(25±2)℃,相对湿度50%—60%,光照强度 40 μmol·m-2·s-1,光周期为 16 h/8 h[18]。
1.2.6 成苗及驯化移栽 待胚萌发长成正常完整苗(苗高6—8 cm,6—8片真叶)时,剪成带一个芽的茎段接种到培养基上继代生根成苗,培养基为:1/2 MS+IBA 0.1 mg·L-1+琼脂 7.0 g·L-1+蔗糖 20 g·L-1+活性炭 1.5 g·L-1,pH 6.0。培养室条件:温度(25±2)℃,相对湿度 50%—60%,光照强度 40 μmol·m-2·s-1,光周期为16 h/8 h。成苗后的试管苗在炼苗室炼苗7 d后,移栽到营养钵中,继续培养30 d;然后将营养钵转移到温室内驯化30 d,移植至大棚圃地,按照田间管理的程序管理。翌年3月定植到大田[18]。
1.2.7 数据分析 采用SPSS 22.0软件进行方差分析及相关分析,相关系数为简单相关系数。
2 结果
2.1 对离体培养胚珠发育率的影响
由表2可以看出,当M8培养基处理(基本培养基是固液双层培养基、附加 45 g·L-1的蔗糖)、培养时间为49 d时,胚珠发育率最高,达到(42.23±6.93)%;其次是M12培养基处理(基本培养基是固液双层培养基、附加60 g·L-1的蔗糖)、培养时间为49 d时,胚珠发育率较高,达到(40.00±3.30)%,发育胚珠即为离体胚珠培养后获得至少1个活性胚的胚珠,见图1-B—D。
2.2 对离体培养胚珠生理指标的影响
2.2.1 对胚珠淀粉含量的影响 由表3可以看出,当培养时间相同、培养基不同时,胚珠淀粉含量变化差异不显著(P>0.05)。当培养基处理相同时,随着离体培养时间的延长,胚珠淀粉含量出现逐渐下降的趋势,其中,离体胚珠在处理M12上培养42 d时,淀粉含量最高,达到(10.21±0.02)%;而当培养时间为63 d时,胚珠淀粉含量仅为(5.11±0.02)%。其他培养基处理变化趋势与M12处理一致,均为逐渐下降趋势。
2.2.2 对可溶性蛋白含量的影响 由表4可以看出,当培养时间相同、基本培养基为固液双层培养基时,可溶性蛋白含量均增加,与其他基本培养基相比,可溶性蛋白含量差异显著(P<0.05),其中M8培养效果最好,可溶性蛋白含量最高,达到(0.49±0.03)mg·g-1。随着附加蔗糖含量的增加,可溶性蛋白含量出现先增加后下降的趋势,如当基本培养基为固液双层培养基,培养42 d时,附加蔗糖含量为30 g·L-1,可溶性蛋白含量为(0.36±0.01)mg·g-1;附加蔗糖含量为 45 g·L-1时,可溶性蛋白含量增加,达到(0.46±0.03)mg·g-1;而当附加蔗糖含量为 75 g·L-1时,可溶性蛋白含量降低,仅为(0.16±0.03)mg·g-1。当培养基处理相同时,随着离体培养时间的延长,可溶性蛋白含量出现先增加后下降的趋势。说明胚珠离体培养阶段,附加蔗糖含量不宜过高,培养时间也不宜过长,以防止可溶性蛋白含量的降低。

表3 不同培养基和不同离体培养时间对离体培养胚珠淀粉含量的影响Table 3 Effects of different medium and culture time on starch content of ovule in vitro (%)
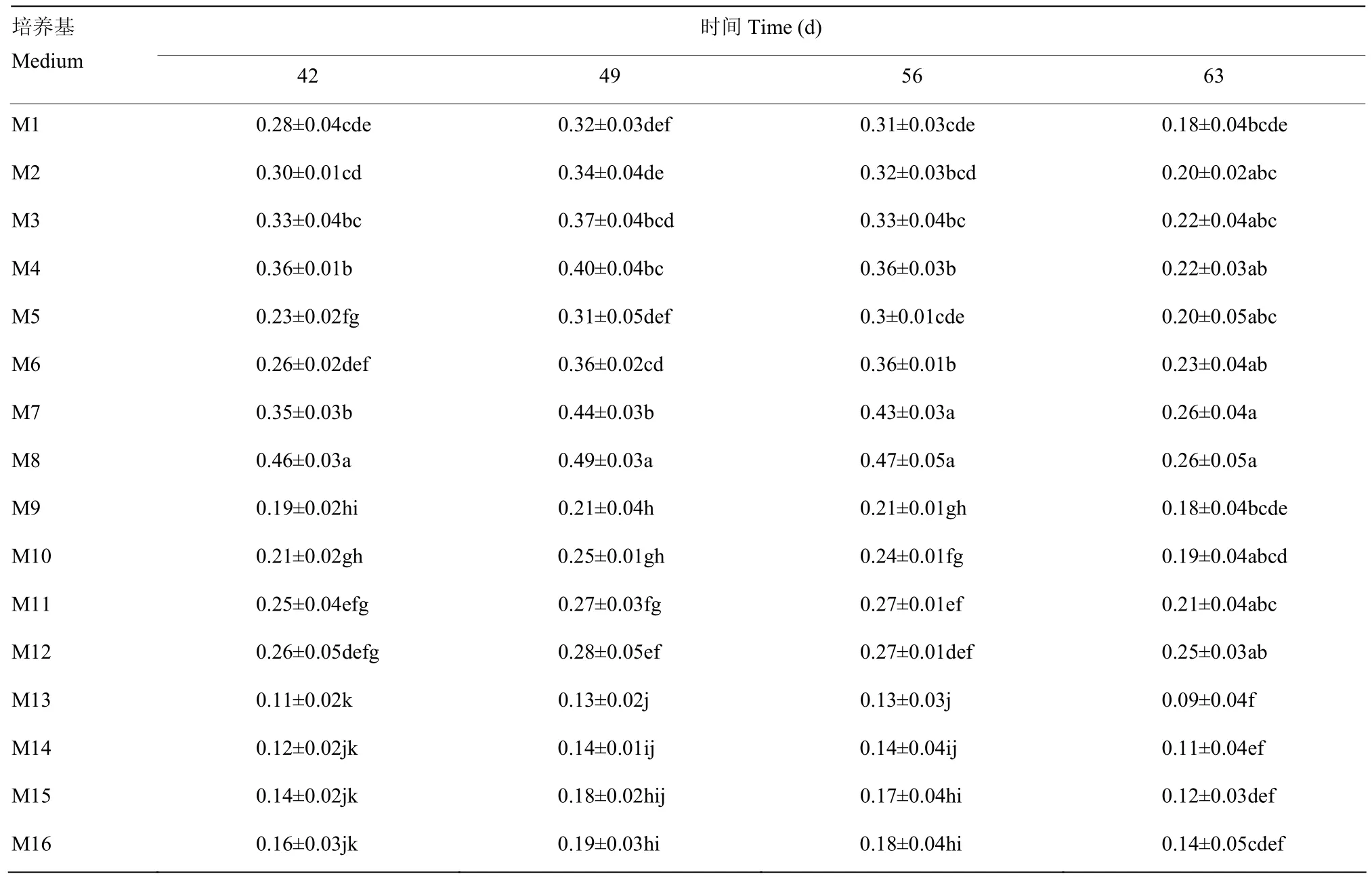
表4 不同培养基和离体培养时间对离体培养胚珠可溶性蛋白含量的影响Table 4 Effects of different medium and culture time on soluble protein content of ovule in vitro (mg·g-1)
2.2.3 对总酚含量的影响 由表5可以看出,当培养时间相同、基本培养基为固液双层培养基时,总酚含量均增加,与其他基本培养基相比,总酚含量差异显著(P<0.05),其中 M12培养效果较好,总酚含量最高,达到(3.37±0.04)mg·g-1;随着附加蔗糖含量的增加,总酚含量出现先增加后下降的趋势,如当基本培养基为固液双层培养基,培养42 d时,附加蔗糖质量为 30 g·L-1,总酚含量为(1.36±0.03)mg·g-1,附加蔗糖含量为 60 g·L-1时,总酚含量升高,达到(3.37±0.04) mg·g-1,而当附加蔗糖含量为 75 g·L-1时,总酚含量降低,为(2.19±0.03)mg·g-1。当培养基处理相同时,随着离体培养时间的延长,总酚含量出现先增加后下降的趋势。
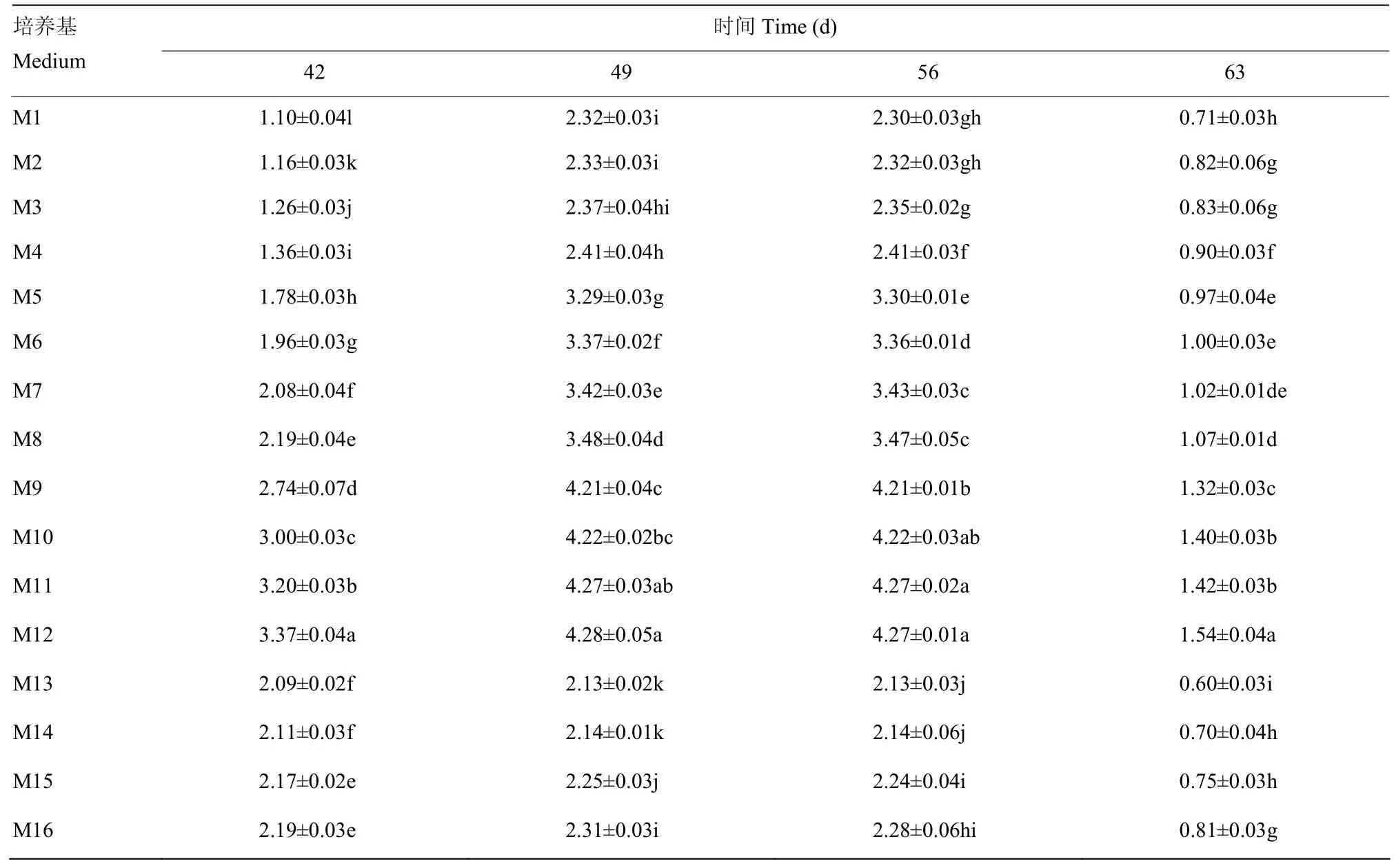
表5 不同培养基和不同离体培养时间对离体培养胚珠总酚含量的影响Table 5 Effects of different medium and culture time on phenolics content of ovule in vitro (mg·g-1)
2.2.4 对离体培养胚珠 SOD酶活性的影响 由表 6可以看出,当培养时间相同、基本培养基为固液双层培养基时,SOD酶活性均增加,与其他基本培养基相比,SOD酶活性差异显著(P<0.05),其中M12培养效果较好,SOD酶活性最高,达到(32.4±0.35)U·g-1FW;随着附加蔗糖含量的增加,SOD酶活性出现先升高后下降的趋势,如当基本培养基为固液双层培养基,培养42 d时,附加蔗糖含量为30 g·L-1,SOD酶活性为(21.27±0.32)U·g-1FW,附加蔗糖含量为 60 g·L-1时,SOD 酶活性升高,达到(32.4±0.35)U·g-1FW,而当附加蔗糖含量为75 g·L-1时,SOD酶活性降低,为(22.9 ± 0.3)U·g-1FW。当培养基处理相同时,随着离体培养时间的延长,SOD酶活性出现先升高后下降的趋势,说明胚珠离体培养阶段,附加蔗糖含量不宜过高,培养时间也不宜过长,有利于SOD酶清除活性氧,防止胚败育。
2.2.5 对POD酶活性的影响 由表7可以看出,当培养时间相同、基本培养基为固液双层培养基时,POD酶活性均较低;随着附加蔗糖含量的增加,POD酶活性出现逐渐升高的趋势,当附加蔗糖含量为 75 g·L-1时,POD酶活性均升高,其中M13处理下,POD酶活性最高,达到(22.17±10.00)U·g-1FW。当培养基处理相同时,随着离体培养时间的延长,POD酶活性出现逐渐升高的趋势,说明胚珠离体培养阶段,适宜的蔗糖含量和培养时间控制POD酶活性的升高,有助于防止离体培养胚珠的老化。
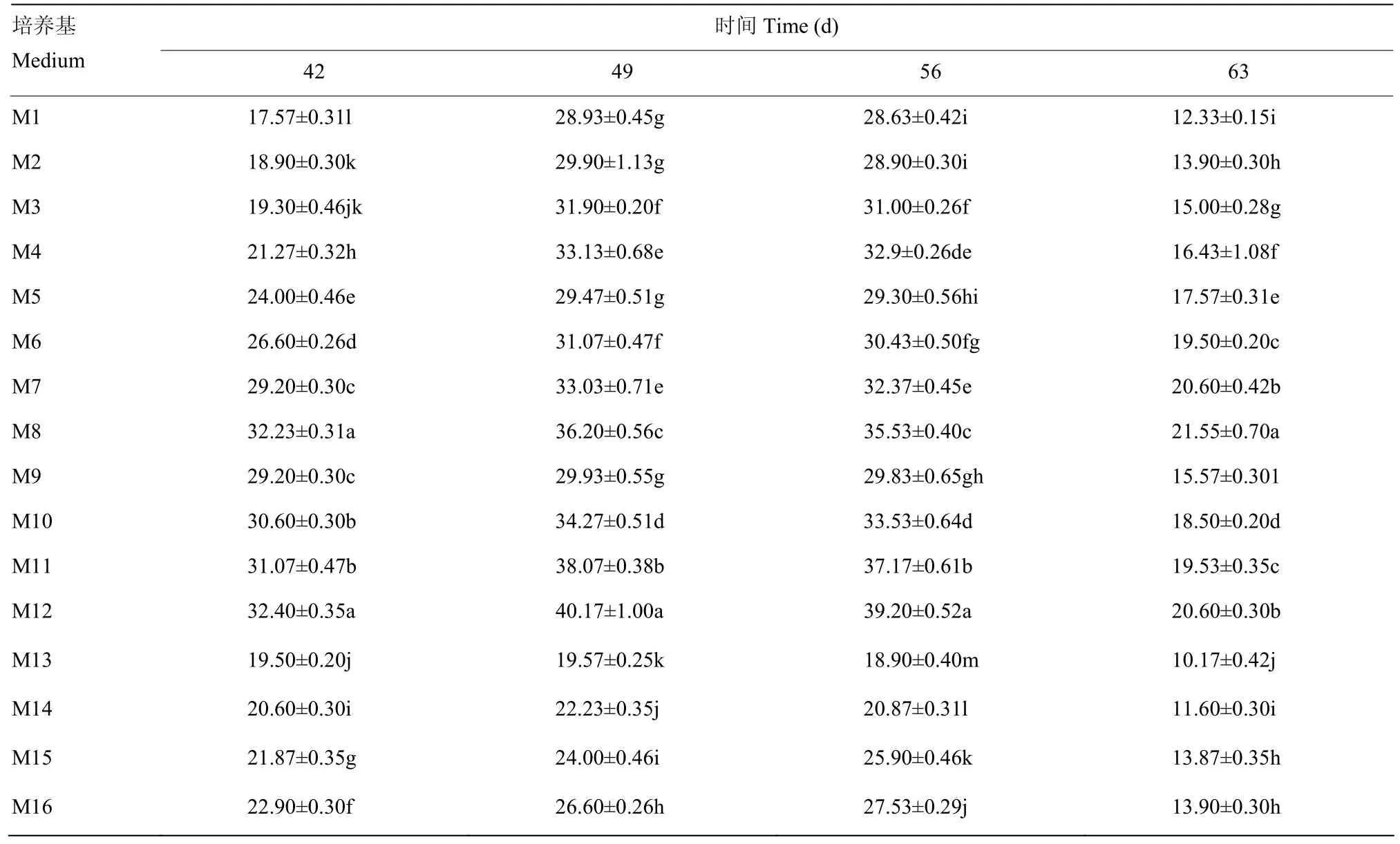
表6 不同培养基和不同离体培养时间对离体培养胚珠SOD酶活性的影响Table 6 The effect of different medium and culture time on SOD activity (U·g-1 FW) of ovule in vitro
2.2.6 对离体培养胚珠PPO酶活性的影响 由表8可以看出,当培养时间相同、基本培养基为固液双层培养基时,PPO酶活性均较低;随着附加蔗糖含量的增加,PPO酶活性出现逐渐升高的趋势,当附加蔗糖质量为75 g·L-1时,PPO酶活性均升高,其中M13处理下,PPO酶活性最高,达到(8.67±0.25)U·g-1FW。结合2.2.3,当蔗糖含量为75 g·L-1时,总酚含量较低,可能是由于此时离体胚珠内PPO酶活性偏高,造成离体培养胚珠总酚物质的减少,醌类化合物质的积累,胚珠组织出现褐变,造成离体胚珠褐化,加剧了离体胚珠内胚的败育,从而影响了离体胚珠的发育率。当培养基处理相同时,随着离体培养时间的延长,PPO酶活性出现逐渐升高的趋势,说明胚珠离体培养阶段控制PPO酶活性的升高,有助于防止离体培养胚珠的褐化。

表8 不同培养基和不同离体培养时间对离体培养胚珠PPO酶活性的影响Table 8 Effect of different medium and culture time on PPO activity of ovule in vitro (U·g-1 FW)
2.3 不同生理指标与胚珠发育率的相关性
从各个生理指标与胚珠发育率的相关性分析可以看出,胚珠发育率与离体培养胚珠的可溶性蛋白含量、总酚含量和SOD酶活性呈极显著正相关,与POD酶活性和PPO酶活性呈极显著负相关,与淀粉含量相关性不显著(表9)。

表9 不同生理指标与胚珠发育率的相关系数Table 9 Correlation coefficient of different physiological indexes and ovule development rate
2.4 胚萌发成苗及移栽驯化
由表10可以看出,E2胚萌发率最高,达到88.2%,即在胚珠离体培养49 d时,总胚数、萌发胚总数、胚萌发率均达到最高;而胚珠离体培养63 d,总胚数、萌发胚总数、胚萌发率均为最低。成苗移栽驯化后获得一批胚挽救苗(图1-E—H)。

图1 自然授粉的‘红宝石’无核葡萄胚挽救过程中离体胚珠发育及胚萌发成苗Fig. 1 In vitro ovule development and embryo germination during embryo rescue of selfing ‘Ruby seedless’ grape
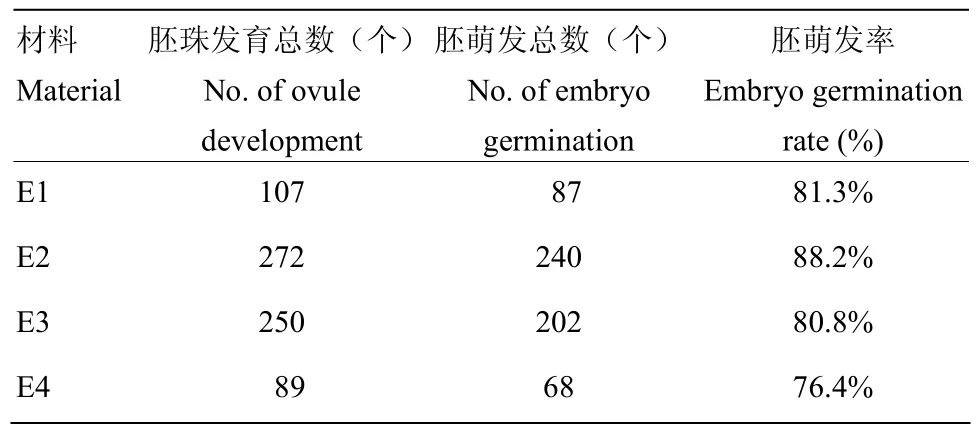
表10 胚萌发率Table 10 Embryo germination rate
3 讨论
影响无核葡萄离体胚珠发育的主要因素包括亲本基因型、基本培养基、附加成分、培养时期等[1]。在胚珠离体培养阶段,为胚珠发育提供营养物质最主要的成分是培养基。本试验选择基本培养基为固液双层基本培养基时,胚珠发育率最高,说明在胚珠离体培养阶段,固液双层基本培养基有利于胚珠发育率的提高,且胚珠发育率均高于前人研究结果,唐冬梅等[28]采用MM3基本培养基时,‘红宝石’无核葡萄×新郁杂交胚珠发育率为 28.3%;LI等[7]采用改良 MM3基本培养基时,‘红宝石’无核葡萄×北醇杂交胚珠发育率为28.3%。在基本培养基中添加一定量的蔗糖,既为胚珠发育提供了能源,也起到调节培养基渗透压的作用。本试验发现在基本培养基中添加不同含量的蔗糖时,随着蔗糖含量的升高,胚珠发育率出现先升高后下降的趋势。与前人[7,22,28,30]研究结果相比,减少基本培养基中的蔗糖含量,有助于胚珠发育率的提高,因此胚珠离体培养阶段,蔗糖含量不能过高,建议在前人一直沿用的60 g·L-1蔗糖的基础上,进行下调。
胚珠离体培养时间的长短也会影响胚珠发育率。本试验发现随着离体培养时间的延长,胚珠发育率呈先增高后下降的趋势,离体培养49 d(7周)胚珠发育率较高,最高达到(42.23 ± 6.93)%,离体培养63 d(9周)胚珠发育率均降低。前人以‘红宝石’无核葡萄作母本,获得杂种胚珠进行离体培养时,离体培养胚珠时间不同,胚珠发育率不同,王飞等[31]离体培养杂种胚珠40 d时,胚珠发育率为56.5%;LI等[7]离体培养杂种胚珠56 d时,胚珠发育率为28.3%;唐冬梅等[28]离体培养杂种胚珠 60 d时,胚珠发育率为27.8%;罗尧幸[29]离体培养杂种胚珠9周,即63 d时,胚珠发育率分别为 13.7%和 13.8%;李志瑛等[15]离体培养杂种胚珠10周,即70 d时,胚珠发育率为13.81%,前人研究结果均表明随着离体培养时间的延长,从40 d至70 d,胚珠发育率越来越低,和本研究结果一致。因此胚珠离体培养阶段,缩短培养时间,有利于胚珠的发育;及时取出幼胚,进行第二阶段胚萌发的培养,有助于提高无核葡萄育种效率。
无核葡萄胚败育是一种细胞程序性死亡现象,种子败育型无核葡萄胚珠可能由于胚乳提前降解,导致胚营养缺乏而败育。在胚胎发育过程中,可溶性糖、可溶性蛋白、淀粉、多酚物质、酶活性及内源激素等的变化与细胞的生物功能和生理活动密切相关[32-35]。本研究关于无核葡萄胚挽救过程中胚珠离体培养阶段,发育胚珠生理代谢物质的变化目前尚未有人开展研究。前人[36-41]对相关生理指标测定研究主要是从不同品种、幼果不同取材时期等方面开展,本研究结果是对前人研究的一个补充。研究离体胚珠内生理指标的变化在一定程度上可以反映幼胚败育进程,说明在胚珠离体培养阶段,当胚珠生理活性较高时,应该及时取出幼胚,可以防止胚败育,提高胚珠发育率,进而提高胚萌发率和成苗率。如何进一步提高该阶段发育胚珠的生理活性,需要不断改良胚珠离体培养方法;提高胚珠发育率,是今后开展无核葡萄胚挽救育种工作需要考虑的一个重要研究内容。
4 结论
本研究在胚珠离体培养阶段,培养自然授粉65 d的‘红宝石’无核葡萄胚珠,采用固液双层基本培养基(改良MM3固体培养基+8 mg·L-1ER液体培养基),附加45 g·L-1蔗糖,培养时间49 d时,胚珠发育率最高,达到(42.23±6.93)%,胚珠生理活性也较强。通过相关性分析发现,胚珠发育率与离体培养胚珠的可溶性蛋白含量、总酚含量和SOD酶活性呈极显著正相关,与POD酶活性和PPO酶活性呈极显著负相关,与淀粉含量相关性不显著。胚珠发育率的提高是无核葡萄胚挽救育种效率提高的前提。

