云南省绿春县胡椒病害及丛枝菌根真菌的调查
尼玛此姆,韩雨庭,唐婕,黄若霞 ,马焕成,伍建榕,
1.云南省高校森林灾害预警控制重点实验室/西南林业大学生物多样性保护学院,昆明 650224;2.西南地区生物多样性保育国家林业和草原局重点实验室/西南林业大学林学院,昆明 650224
丛枝菌根(arbuscular mycorrhiza,AM) 是球菌门真菌侵染植物营养根系形成的一种互惠共生现象,对修复污染生境、保持生态系统稳定与可持续生产力的作用显著。同时对植物的营养代谢、水分代谢、抗病性、抗逆性和生长发育等都具有一定的影响[1]。AM的存在可以使植株的根系生长发达或增加根系与土壤的接触面积继而使植物能更好地获取营养物质或微量矿质元素[2],还可以通过改变土壤的理化性质或改变植株根系等来提高植物生物量、促进生长从而减轻植物病害的发生[1,3]。有研究表明,丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)对由镰刀菌造成的黄瓜枯萎病具有一定的抑制作用,在温室农业生态系统中表现出一定的生物防治效果[4]。
胡椒(PipernigrumL.)是胡椒科(Piperaceae)胡椒属(Piper)的多年生常绿藤本香辛植物,作为一个重要的经济产业,被称为是云南省绿春县骑马坝的“绿色黄金”。2013年以来,胡椒瘟病在骑马坝乡的各个村落不断暴发,椒农损失惨重,成为影响当地社会稳定的重要因素之一。因而,加强对胡椒病害的研究,找到发病原因、有效的治疗方法及预防措施等显得格外重要。笔者调查绿春县胡椒根际土壤中丛枝菌根真菌孢子的密度、丰富度、多样性指数及根系侵染率与胡椒病害发病率及发病程度的关系,旨在为开展胡椒病虫害的生物防治提供理论依据。
1 材料与方法
1.1 样地概况
骑马坝乡位于云南省红河州绿春县,海拔高度500~2 500 m左右,年平均气温20 ℃,年均降雨量2 800 mm,干湿季分明,属于典型亚热带山地季风气候,素有“天然温室”之称,是我国少有的适宜胡椒生长的种植区。此次采集地海拔900~1 000 m,栽培的胡椒品种主要是大叶种,样地大部分为沙质地段,少部分土质微黏。
1.2 发病率及病情指数调查
选择发病程度不同的4块样地,每块样地选取50株10年生进入丰产期的成年胡椒植株。按照病害5级分级标准,对胡椒瘟病进行调查,并计算发病率和病情指数:
病害分级标准共分为5个等级:0级,无病(代表值1);Ⅰ级,感病部位占植株的1%~25%(代表值2);Ⅱ级,感病部位占植株的26%~50%(代表值3);Ⅲ级,感病部位占植株的51%~75%(代表值4);Ⅳ级,感病部位占植株的76%~100%(代表值5)。
发病率=发病株数/调查总株数×100%
病情指数=100×∑(各级胡椒病株数×该级代表值)/
(调查总株数×最高级代表值)
1.3 菌根侵染率检测
1)土样及根样的采集。在进行调查的4个样地中,分别采集不同发病程度胡椒的根际土样和根样,土样采取根际5~30 cm土层的土壤1 kg左右装入自封袋中(各土样均为东西南北方向各取一部分,混匀),同时采集该土样对应胡椒的根系,选取典型有用的标本,尽量采取带根尖的根段及须根,剪成小段装入离心管中,加入FAA固定液,贴好标签并带回实验室4 ℃保存[5]。
2)根系的染色镜检。取出离心管中的根段,自来水清洗3~5次去除表面固定液,用苯胺蓝染色法对根系进行水浴解离、酸化、染色、脱色[1,5]。将脱色后的根段剪成1 cm左右放在载玻片上,盖上盖玻片并在光学显微镜下镜检,观察AMF的侵染情况,拍照记录并计算侵染率。
菌根真菌侵染率=∑(0×根段数+10%×
根段数+20%×根段数+……+100%×
根段数)/观察总根段数
1.4 AMF孢子密度测定
从自然风干的土样中称取20 g(除去一些大杂质)置于组培瓶中,加水浸泡10~15 h或过夜使土壤松散。利用湿筛沉淀法将筛面的孢子收集于滤纸上,在体视镜或解剖镜下计数孢子数,并换算成每个土样及每个样地的孢子密度[5-6]。
1.5 孢子鉴定
1)形态学鉴定。将体视镜下完成计数的孢子,用解剖针或比较细的挑针挑取到滴有蒸馏水的载玻片上,在显微镜下观察孢子的颜色、形状并记录大小;将孢子轻轻压破,观察孢壁的颜色、层数、厚度等特征,拍照记录,参照INVAM(http://fungi.invam.wvu.edu/)提供的图谱并参阅近几年发表的新种的描述等,对筛选出来的孢子进行形态学鉴定[5-6]。
2)分子鉴定。用细挑针在体视镜下挑取单个饱满的AM真菌孢子,记录其形态特征,放入装有灭菌ddH2O的1.5 mL灭菌离心管中,并做好标记。用超声波清洗2~3次,中间要换到新的装有灭菌ddH2O的离心管中,清洗结束后采用OMEGA公司的MicroElute Genomic DNA Kit(50)试剂盒提取DNA、再参考龙良鲲等[7]、刘润进等[1]的方法进行PCR扩增(巢氏PCR)、电泳,最后送擎科生物科技有限公司测序。测序结果通过MAARJAM的Blast检索系统进行序列同源性比对。
1.6 丰富度及多样性指数的计算
通过计算AMF孢子的多样性指数[H’=-∑PilnPi(Pi=Ni/N)][1]和Margalef丰富度指数[D=(S-1)/lnN][6]来描述AMF的物种多样性。其中:Pi为某采样点种i的孢子数与该样点孢子总数之比;N为孢子的种群数量;Ni为种i的个体数;S为孢子的种类数。多样性指数一般是基于物种的数量反映群落种类多样性,群落的复杂程度随着生物种类增多而变高,即H’值越大,群落越稳定。
2 结果与分析
2.1 胡椒瘟病的发病率、病情指数及AMF侵染率、孢子密度
对各个样地进行AMF的侵染率、孢子密度、发病率及病情指数的调查,结果见表1。4个样地的胡椒分别形成了不同程度的菌根共生体,孢子密度也有一定的差异,其中样地1的菌根侵染率和孢子密度最高,分别为62.5%和11.72个/g;样地4的最低,分别为11%和2.475个/g。菌根侵染率高的样地孢子密度也较大。菌根侵染率和孢子密度最高的样地,发病率和病情指数最低,分别为20%和9;侵染率低的样地,发病率和病情指数最高,分别为80%和53.5。
2.2 AMF种类及鉴定
对分离出的孢子先进行形态鉴定,将其大致归类,再通过分子鉴定进行匹配,形态与分子鉴定结果一致鉴定为同一个种,结果如下:
在样地1的各土样中,一共分离出5属8种的AMF的孢子,分别为无梗囊霉属(Acaulospora) 的3个种:A.lacunosa(图1A )、A.rehmii(图1B )、A.koskei(图1C);齿盾囊霉属(Dentiscutata)的2个种:D.erythropa(图1 D)、D.rubra(图1E );球囊霉属(Glomus)的G.ambisporum(图1 F);隔球囊霉属(Septoglomus)的S.constrictum(图1G )、多孢囊霉属(Diversispora)的D.epigaea(图1H)。样地2的土样中共分离出5属8种AMF孢子,孢子种类与样地1 相同。样地3共分离出4属4种,分别为A.lacunosa、A.rehmii、D.rubra和D.epigaea。样地4共分离出4属5种,分别为D.erythropa、D.rubra、A.rehmii、G.ambisporum、D.epigaea。

表1 胡椒瘟病病害及根际AMF调查结果 Table 1 Investigation results of pepper phytophthora root rot disease and rhizosphere AMF

图1 胡椒根际AM真菌孢子形态
2.3 多样性指数和丰富度与胡椒瘟病的发病率及病情指数的关系
经分析,样地1的丰富度和多样性指数最高(表2)。而样地4的2个指标最低;样地1 AMF种的丰富度是样地4的4.87倍,多样性指数是样地4的2.43倍,样地1较样地4发病率降低了60%,病情指数少了44.5。从表2中也可以发现孢子丰富度越高,多样性指数也越大;反之则越小。
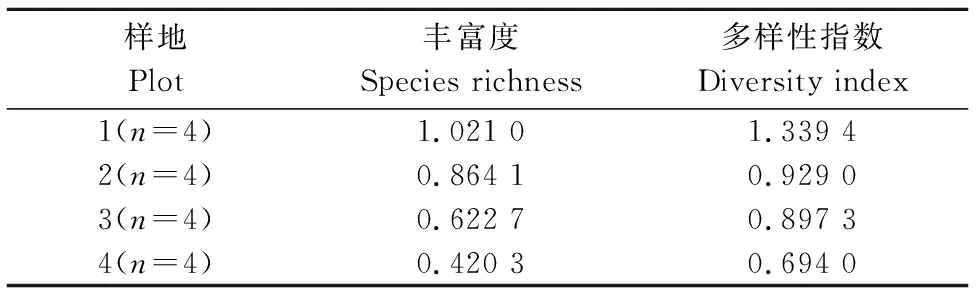
表2 胡椒根部丛枝菌根真菌种的丰富度及多样性指数 Table 2 The AMF species richness and diversity index in the root of pepper
2.4 相关性分析结果
由表3可见,AM菌根侵染率、孢子密度、物种的丰富度与胡椒瘟病的发病率和病情指数呈现显著的负相关关系(P值均小于0.05)。即AMF侵染率、孢子密度、丰富度越高,病情指数越小,发病率越低。其中多样性指数X与发病率的线性回归方程为:Y=-0.943X+1.425;多样性指数X与病情指数的线性回归方程为:Y=-0.908X+1.008。
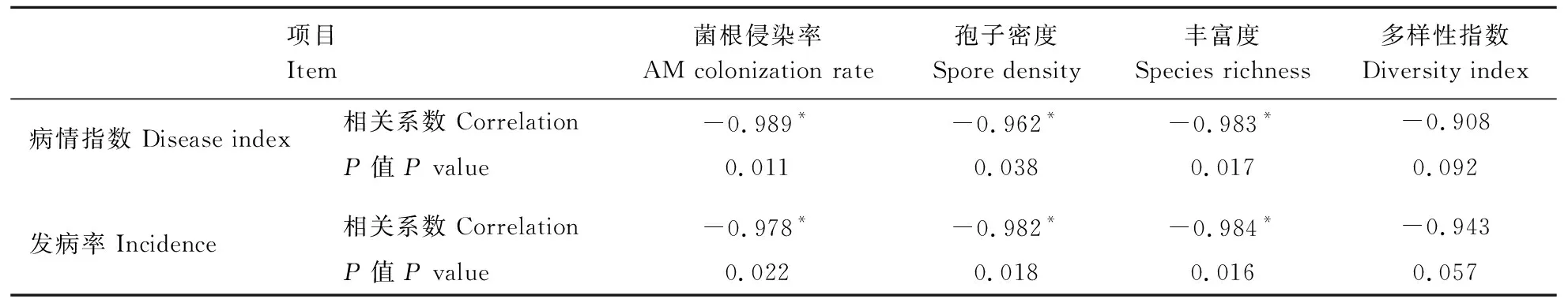
表3 发病率、病情指数与AMF各指标之间的相关性 Table 3 The correlation between indicators of AMF and incidence,disease index
注Note: *:P<0.05.
3 讨 论
3.1 AMF孢子密度、丰富度、侵染率与胡椒瘟病的关系
本研究结果显示,植物根系土壤中AMF的存在能在一定程度上减少植物病害的发生,提高抗病性。这与李丽等[6]、补娟等[8]的结果一致,病原菌和AMF之间存在此消彼长,AM能减少病原菌的侵染,防控植物真菌病害。接种AMF之所以能减轻病害的发生可能是由于AMF与植物共生促进了土壤中磷素以及其他矿质元素活化,从而促进植物生长[9];也可能是AMF的存在参与了一些抗菌物质的合成,如木质素、一些酚类物质等或与病原物竞争生态位和构建机械防御屏障,同时AMF还可能刺激病程相关蛋白以及作为一种生物诱导因子诱导植物对病害产生抗性[10-11]。
3.2 AMF侵染率与孢子密度的关系
本研究结果表明,AMF侵染率和孢子密度均与胡椒瘟病发病率和病情指数呈显著负相关,这与李丽等[6]、方燕等[12]的研究结果相同;而盖华[13]研究表明,在基质灭菌条件下,接种AMF能增加基质中的孢子密度以及提高草莓的菌根真菌侵染率,而且两者之间呈极显著正相关。也有人通过研究证明了灌木植物根系土壤中的孢子密度与AMF侵染率呈正相关性[14]。但也有研究表明植物根际土壤AMF孢子密度和根系侵染率之间无相关性[15]。这些结果差异可能与不同采样点的土壤理化性质、树龄及AMF的发育阶段等有关,土壤中的部分孢子可能已经失去活力或是处于休眠状态,以至于不能侵染植株根系。
3.3 AMF多样性指数与胡椒瘟病的关系
AMF多样性指数随着胡椒瘟病病情指数和发病率的降低而增长。有研究表明,AMF多样性与宿主病害发病率、病情指数呈负相关性[6]。相关性的大小与AMF种类、土壤类型和宿主植物的交互作用等相关[16-17]。胡椒根系土壤中AMF的孢子密度、丰富度及对根系的侵染都与胡椒瘟病发病率和病情指数具有一定的关系,丛枝菌根真菌的存在能对胡椒瘟病的发生起到一定的抑制作用。
本研究发现丛枝菌根真菌的侵染与植物病害的发病率和病情指数呈显著的负相关关系,在一定程度上能提高植物的抗病性,这与Thygesen等[18]的研究结果一致。菌根真菌提高植物抗病性是一个复杂的作用过程,可从侵染位点和营养能源两个方面与病原菌竞争生态位,通过抑制病原菌繁殖达到防控土传病害的目的[19]。从侵染位点来看,AMF侵染宿主根系形成菌根后,其菌丝会迅速占据相应的生态位点,从而减少病原菌的侵染位点并降低其数量。例如,在沉香根际接种聚生球囊霉(Glomusfasciculatum),根系侵染位点被AMF占据,可减轻瓜果腐霉菌(Pythiumaphanidermatum)的侵染,降低植株病情指数[20];从营养能源来看,AMF和病原物的生长都依赖宿主植物提供能量和营养,故存在直接竞争关系[21]。本试验只是从其中一个方面进行的解释,对于菌根真菌提高植物抗病性的作用机制还有待于进一步深入研究。

