黄颡鱼朗格汉斯细胞的鉴定及其功能基因的表达分析
王辉 ,李思思,吴志新,3,许荔立,田丁,陈孝煊,3
1.华中农业大学水产学院,武汉 430070; 2.湖北省水生动物病害防控工程技术研究中心,武汉 430070;3.水产养殖国家级实验教学示范中心(华中农业大学),武汉 430070
朗格汉斯细胞(Langerhans cells,LCs)是存在于哺乳动物表皮复层鳞状上皮细胞之间唯一的抗原呈递细胞(antigen-presenting cell,APC),能够有效捕获抗原并将其传递给T淋巴细胞,诱导相应的免疫反应,在特异性免疫反应的发生以及免疫耐受的维持方面发挥重要作用[1-2]。
LCs生物学功能的发挥是由众多基因共同调控的。研究表明,LCs能够表达CD207、CD1a、Toll-样受体(TLRs)、主要组织相容性复合体Ⅱ类分子(MHC-Ⅱ)以及共刺激分子CD80和CD86等抗原呈递相关基因[3-4]。局部高表达的IL-1β能够将LCs招募到炎症发生的位置,吞噬侵入的病原菌[5]。CD207和CD1a不仅被认为是LCs相对特异性的分子标记,更是呈递非多肽抗原的关键分子[6-7]。此外,LCs表面的TLRs能够识别不同类型的抗原,抗原经过加工、处理后与细胞表面的MHC-II分子结合形成MHC-II-抗原肽复合物,并在趋化因子及其受体的共同作用下迁移到淋巴器官;之后,与高表达的共刺激分子CD80和CD86共同作用,活化幼稚T淋巴细胞[8]。
迄今为止,免疫组化和透射电镜技术是研究硬骨鱼类朗格汉斯细胞的主要方法[9-10]。Langerin/CD207主要表达于朗格汉斯细胞表面,是其生长和发育过程中不可或缺的重要分子[11]。因此,常以CD207抗体用于朗格汉斯细胞的鉴定。但至今还未在硬骨鱼类中找到哺乳动物CD207分子同系物。因此,一直以人CD207多克隆抗体用于硬骨鱼类朗格汉斯细胞的鉴定。目前,已经通过人CD207多克隆抗体在虹鳟(Oncorhynchusmykiss)、大西洋鲑(Atlanticsalmon)和斑点叉尾鮰(Ictaluruspunctatus)等多种硬骨鱼类的免疫器官中发现朗格汉斯细胞的存在[12-13]。此外,伯贝克颗粒(Birbeck granule)是朗格汉斯细胞特异性的形态学标记,其通常呈网球拍状或者杆状并围绕中心粒呈放射状排列[11]。有研究者通过这一形态特征在大鳞大麻哈鱼(Oncorhynchustshawytscha)、虹鳟(Oncorhynchusmykiss)、大西洋鲑(Atlanticsalmon)和斑点叉尾鮰(Ictaluruspunctatus)等多种硬骨鱼类的免疫器官中发现朗格汉斯细胞的存在[10,12-15]。但关于黄颡鱼朗格汉斯细胞的研究尚未见报道。本研究中,我们通过免疫组化和透射电镜技术观察到黄颡鱼朗格汉斯细胞的形态特点、HE染色分析鲶爱德华氏菌对黄颡鱼鳃和肠道的病理损伤,并采用荧光定量PCR分析了鲶爱德华氏菌感染后黄颡鱼免疫相关组织内朗格汉斯细胞功能相关基因的表达情况,以期为黄颡鱼细胞免疫及抗菌感染机制的研究提供一定的基础。
1 材料与方法
1.1 试验鱼、菌株与样品采集
本试验中所用黄颡鱼购自湖北省武汉市黄优源渔业发展有限公司,养殖在华中农业大学水产养殖基地循环水系统中,规格为体长(15±3) cm、体质量(40±5) g。试验开始前,暂养2周以适应实验室环境:水温23~25 ℃,溶解氧5~7 mg/L,光周期为光照∶黑暗=12 h∶12 h。分别于每天09:00和16:00投喂商业饲料,投喂量约为黄颡鱼总体质量的2%~3%。
鲶爱德华氏菌(Edwardsiellaictaluri)由中国科学院水生生物研究所李爱华先生馈赠。菌种经划线活化后,挑选单菌落接种到液体BHI培养基(Hopebio,青岛)中,于28 ℃摇床中培养17 h。通过离心收集所有细菌,并用灭菌的PBS冲洗2次以去除多余的培养基。获得的细菌经过梯度稀释调整其浓度为1.0×106CFU/mL,备用。
暂养结束后,选择100尾健康黄颡鱼,分为感染组和对照组(每组50尾),分别腹腔注射0.1 mL(1.0×106CFU/mL)的鲶爱德华氏菌菌液和灭菌PBS。分别在感染后3 h、6 h、12 h、1 d、2 d、3 d、5 d和7 d时,从每组中随机取6尾黄颡鱼,经MS-222麻醉后,取头肾、脾脏、鳃和肠道组织迅速放入Trizol(TaKaRa,大连)中,-20 ℃保存,用于荧光定量PCR。此外,为了更加直观地研究鲶爱德华氏菌对黄颡鱼的鳃和肠道组织的损伤,分别在感染后第1、4和第7 天时,从感染组中随机选3尾黄颡鱼,经过MS-222麻醉后,取鳃和肠道固定于4%的多聚甲醛中,用于HE染色。
1.2 免疫组织化学染色
取健康黄颡鱼头肾、脾脏、皮肤、鳃和肠道组织迅速转移到4% 多聚甲醛中固定24 h。固定后的组织依次通过60%、75%、85%、90%、95%乙醇及无水乙醇溶液进行脱水。之后,将脱水后的组织浸入二甲苯中使其达到透明状态,并经过浸蜡和包埋等步骤将组织完全地包埋在石蜡中。用切片机将包埋好的组织切成5 μm的切片。
切片依次经过二甲苯Ⅰ、二甲苯Ⅱ、无水乙醇Ⅰ、无水乙醇Ⅱ、95%乙醇、85%乙醇和自来水漂洗后脱去石蜡并使切片水化。将切片依次经过抗原修复(0.01 mol/L柠檬酸盐缓冲液(Servicebio,武汉))、血清封闭(10%的BSA封闭液(Servicebio,武汉))、人CD207多克隆抗体(Bioss,北京)孵育、HRP标记的山羊抗兔鼠通用二抗(Protein Tech,美国)孵育以及DAB显色液(Sangon Biotech,上海)显色等步骤。对照组中以同浓度的兔源IgG多克隆抗体(Servicebio,武汉)代替人CD207多克隆抗体。最后,经过苏木素溶液复染以及一系列浓度的无水乙醇脱水后以中性树胶封片。显微镜观察并采集图像。
1.3 透射电镜观察
取新鲜的黄颡鱼头肾和脾脏组织,迅速投入2.5%的戊二醛溶液(Servicebio,武汉)中4 ℃固定4 h。固定后的样品放于1%四氧化锇-0.1 mol/L磷酸缓冲液(pH值7.4)中浸泡固定2 h后,依次经过50%、70%、80%、90%、95%、100%的乙醇溶液、100%丙酮Ⅰ、100%丙酮Ⅱ脱水,每次15 min。脱水后的组织经过渗透、Epon812树脂包埋、切片、铀铅双染色(2%醋酸铀饱和乙醇溶液和枸橼酸铅溶液各染色15 min)。切片在室温环境下过夜干燥,通过透射电子显微镜(HT7700)观察结果,并采集图像。
1.4 苏木精-伊红染色
将黄颡鱼鳃和肠道组织的石蜡切片经过脱蜡水化后,分别用苏木精染料和伊红染料对细胞核和细胞质染色。最后以中性树胶封片,显微镜下观察。
1.5 荧光定量PCR
采用Trizol法提取组织中总RNA,通过微量分光光度计和1%的琼脂糖凝胶电泳确定总RNA的质量和完整性。将完整的样品调整质量浓度为300 ng/μL,按照诺唯赞反转录试剂盒(Vazyme,南京)操作指南去除残留基因组污染,在Random primers/Oligo (dT)23VN 混合引物 和HiScript II 反转录酶的作用下将总RNA反转录成cDNA,保存于-20 ℃。
根据NCBI中公布的黄颡鱼IL-1β、TNF-α、IL-10、TLR-4和β-actin基因的编码区设计荧光定量PCR特异性引物,并由武汉擎科生物技术有限公司合成(表1)。PCR体系包括:10 μL 的2×SYBR qPCR Mix(Aidlab,北京),2 μL的模板cDNA,7 μL的ddH2O,上下游引物各0.5 μL。PCR反应程序为:94 ℃,2 min;(94 ℃,10 s;56 ℃,15 s;72 ℃,20 s)×40。每个样品重复3次。以β-actin基因作为内参基因。反应结束后,通过熔解曲线和测序分析确定反应体系中无非特异性扩增。采用2-ΔΔCt法计算各目的基因的表达水平。

表1 荧光定量PCR所使用的引物序列 Table 1 Primer sequences for qRT-PCR
所有试验数据均以平均值±标准误(Mean±SE)的形式表示,并通过SPSS 21.0对其进行统计分析,采用独立样本t检验分析试验组和对照组中目的基因表达差异的显著性。P<0.05,被认为在统计学上存在显著性差异,以*表示;P<0.01,被认为统计学上存在极显著差异,以**表示。
2 结果与分析
2.1 黄颡鱼头肾和脾脏中CD207阳性细胞的鉴定
通过免疫组化技术,在黄颡鱼头肾和脾脏中均发现CD207阳性细胞的存在(图 1),但是鳃、皮肤和肠道中并未发现CD207阳性细胞。此外,细胞膜上CD207蛋白的表达量高于细胞质中。
2.2 黄颡鱼朗格汉斯细胞的超微结构
在透射电镜下,黄颡鱼头肾和脾脏中均发现朗格汉斯细胞。黄颡鱼朗格汉斯细胞与其他脊椎动物朗格汉斯细胞类似,细胞质中的伯贝克颗粒围绕着中心粒呈放射状排列,并且这些颗粒的形态多呈现为圆形(图2A,B)。

图中箭头所示为CD207阳性细胞。The CD207 positive cells are showed with arrows.
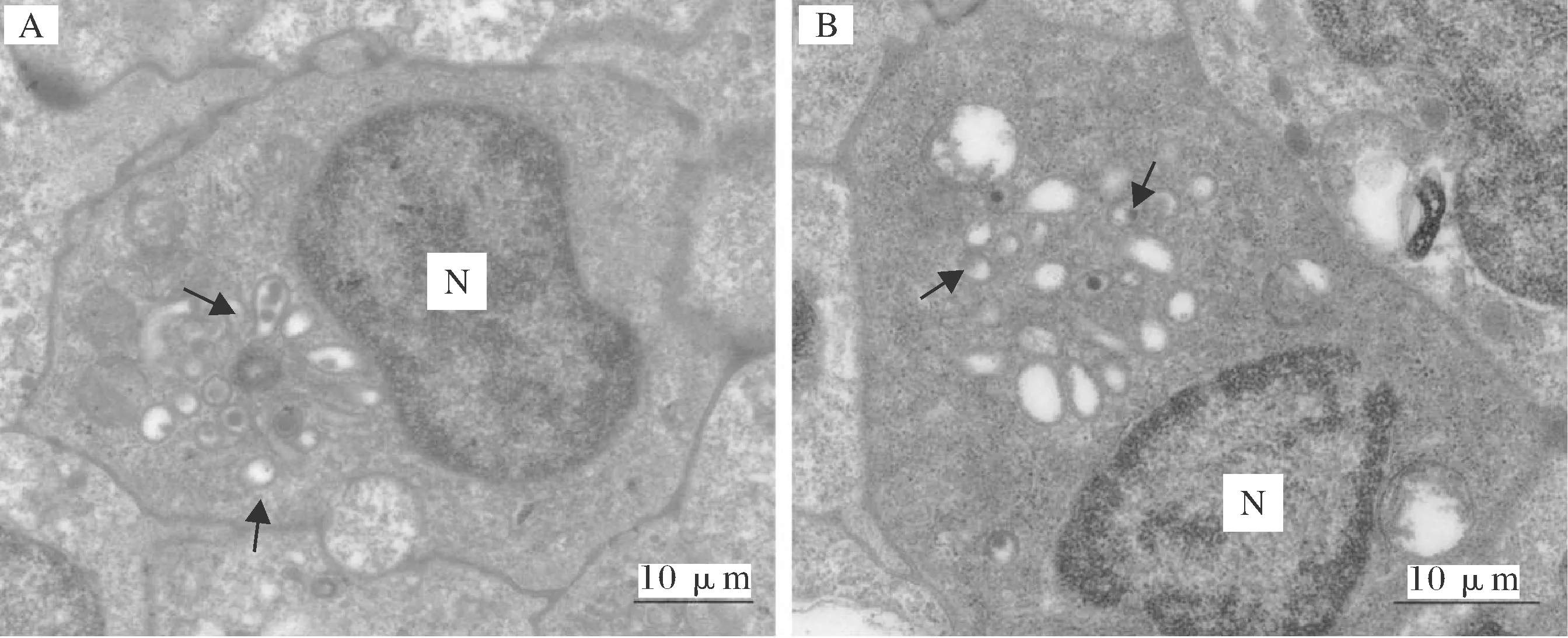
N代表细胞核,箭头所示为伯贝克颗粒。The nucleus and the Birbeck granule are denoted with “N” and arrows,respectively.
圆形的伯贝克颗粒内存在由高密度物质组成的圆形致密颗粒,而有的伯贝克颗粒内没有致密颗粒(图 3A);有的伯贝克颗粒内仅有一个致密颗粒,分布于中心或偏向一侧(图 3B、C),此外,还有的伯贝克颗粒内含有2个致密颗粒,均分布于中心或各居一侧(图 3D、E)。而且,这些致密颗粒在不规则的杆状伯贝克颗粒中的数量较多,高达5个(图 3J)。除此之外,在圆形的伯贝克颗粒内还观察到有管状结构(图 3F、G)。同时,多泡小体类似的结构也存在于黄颡鱼朗格汉斯细胞的细胞质中(图 3H、I)。
2.3 鲶爱德华氏菌感染对黄颡鱼鳃和肠道的病理损伤
根据HE染色结果,鲶爱德华氏菌感染后,黄颡鱼鳃和肠道出现不同程度的病理损伤,并且随着感染时间的增加,损伤程度不断加剧(图 4)。例如,鳃丝上皮细胞坏死、脱落、鳃丝变短等;肠道中,肠上皮细胞之间的杯状细胞数量增多。
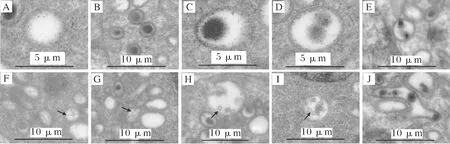
图3 黄颡鱼伯贝克颗粒的结构特点
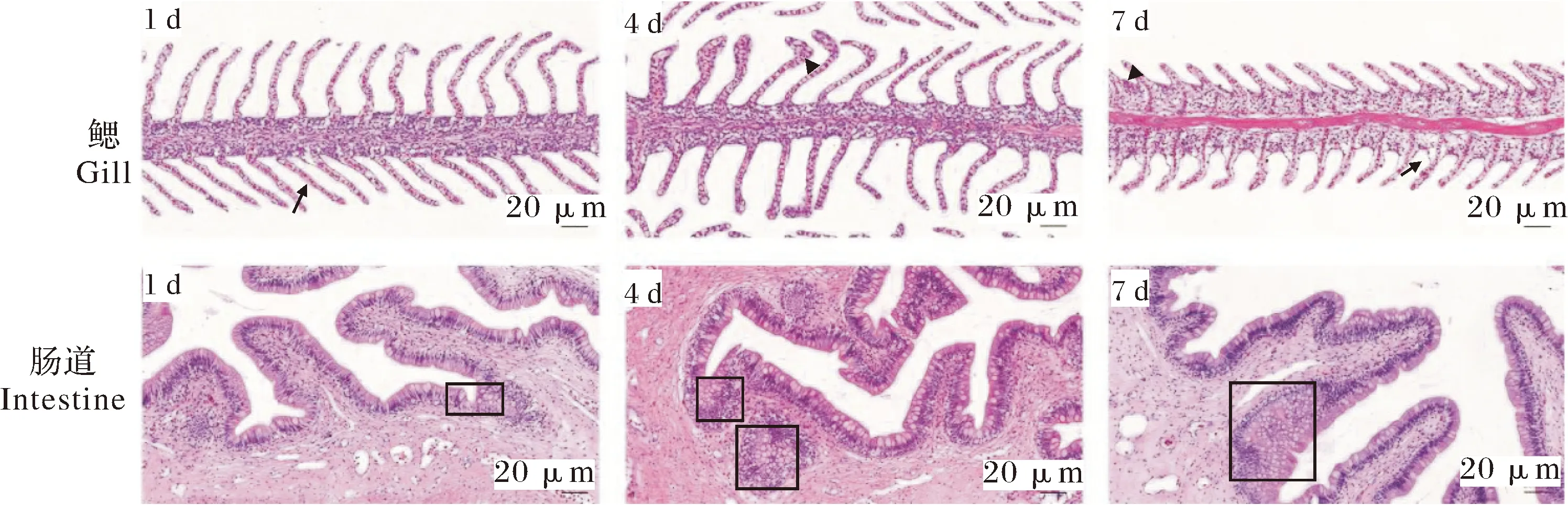
箭头所示为鳃上皮细胞坏死、脱落,三角所示为鳃丝组织增生;框内的部分表示为肠道中的杯状细胞。 The necrosis and exfoliation of epithelial cells are denoted with arrows,and the hyperplasia of gill filament is showed by triangle. The goblet cells in the intestine is represented by box.
2.4 鲶爱德华氏菌感染对朗格汉斯细胞功能相关基因表达的影响
q-PCR的结果显示,鲶爱德华氏菌能够诱导黄颡鱼免疫器官中朗格汉斯细胞功能相关基因发生不同程度的表达上调(图 5)。在头肾、鳃和肠道中,IL-1β在感染后3 h时表达量最高,之后下降,在12 h至7 d内表达量上调的变化不明显;而在脾脏中,感染后6 h时的表达量最高,12 h时迅速下调并显著低于对照组,在1~7 d内缓慢上调。TLR-4在头肾、脾脏、鳃和肠道中均显著上调,并且在2 d时表达量最高。头肾和脾脏中,IL-10仅在感染后3 h时的表达量显著高于对照组,鳃中大部分时间点的表达量显著低于对照组,肠道中的表达量变化不明显。TNF-α基因在头肾中的表达量在3 h到3 d内逐渐上调并且第3 天时达到峰值,在肠道中的表达量从3 h到5 d内逐渐上调,并且在第5天时达到最大值。在鳃中,TNF-α基因仅在3 h和2 d时的表达量显著高于对照组,而脾脏中TNF-α基因在1 d、3 d、5 d时的表达量显著低于对照组,其他时间点与对照组没有显著性差异。
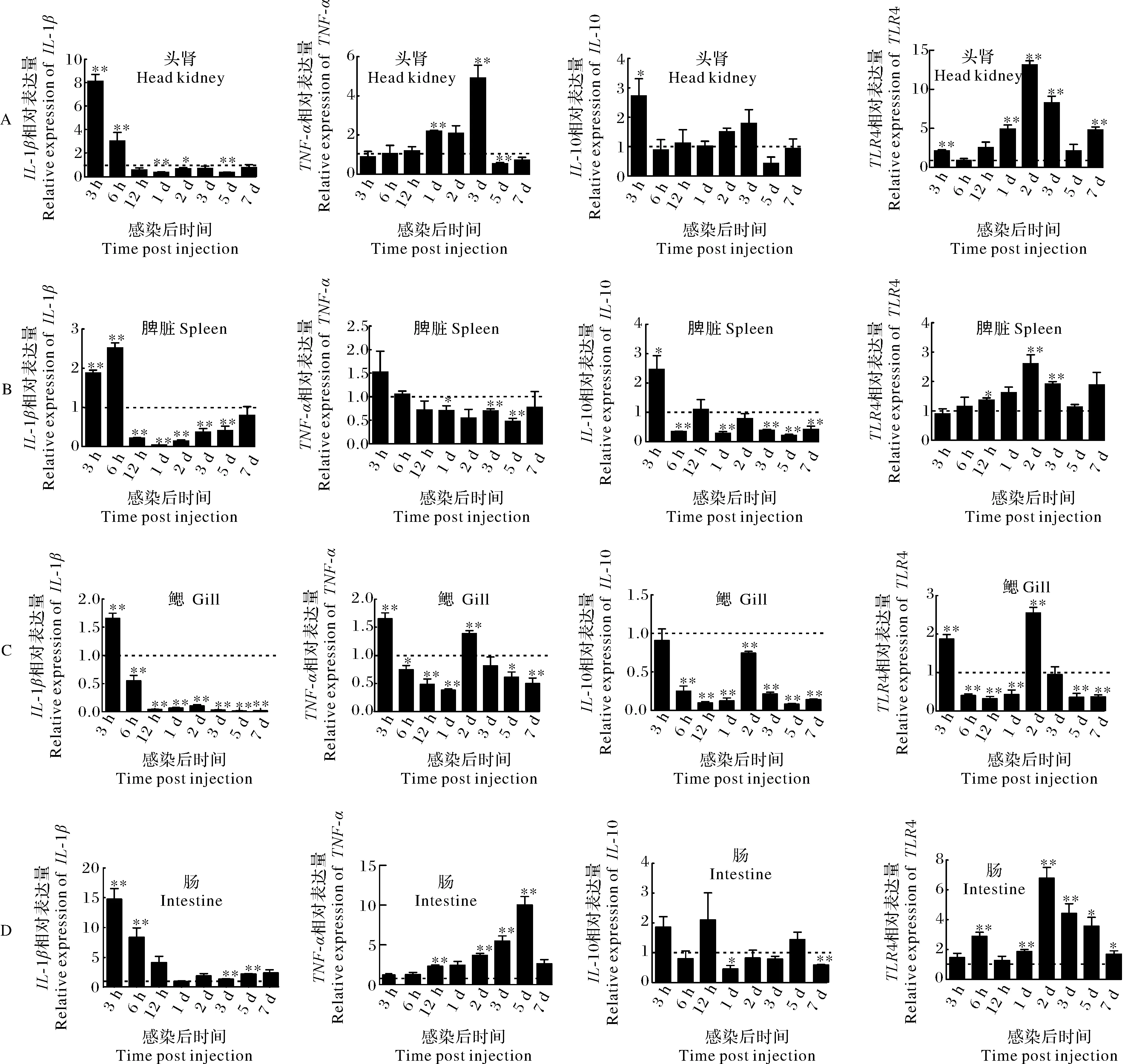
差异显著(P<0.05)以 “*”表示,差异极显著(P<0.01)以“**”表示。图中虚线代表对照组。The statistically significant difference and extremely significant difference are denoted with “*” and “**” , respectivelly. The dotted line in these figures represennts the control group.”
3 讨 论
树突状细胞作为连接固有免疫系统和适应性免疫系统的桥梁,在免疫反应的发生以及维持免疫耐受过程中发挥重要作用。目前已经在虹鳟[16]、斑马鱼[17]和草鱼[18]等众多硬骨鱼类中分离出树突状细胞,并且发现硬骨鱼类树突状细胞与哺乳动物类似,都具有吞噬、运动以及刺激幼稚T淋巴细胞增殖的能力。作为树突状细胞亚型之一,朗格汉斯细胞在免疫反应过程中同样发挥重要作用。本研究采用免疫组化和透射电镜技术,首次从形态学上证实黄颡鱼朗格汉斯细胞的存在,并采用荧光定量PCR,从mRNA水平上分析了鲶爱德华氏菌感染后,IL-1β、TNF-α、IL-10和TLR-4等朗格汉斯细胞功能相关基因在黄颡鱼免疫相关组织中的表达情况。
免疫组化显示,与其他硬骨鱼类类似,人CD207多克隆抗体能够识别黄颡鱼头肾和脾脏中表达的CD207蛋白,并且脾脏中CD207阳性细胞的数量高于头肾,与斑点叉尾鮰中的结果相反[13]。此结果可能是因为人CD207分子与黄颡鱼CD207分子核酸序列的保守度不高,人CD207多克隆抗体不能完全特异性结合黄颡鱼CD207蛋白[19]。由于缺乏可用的黄颡鱼CD207序列信息以及相应抗体,具体原因有待于进一步研究。除此之外,在这些阳性细胞中,黄颡鱼CD207蛋白在细胞膜上的表达水平高于细胞质中的表达水平。此结果符合CD207蛋白的特性并且与斑点叉尾鮰中观察到的结果类似[9,13]。透射电镜可直观地观察到黄颡鱼朗格汉斯细胞的形态结构,黄颡鱼朗格汉斯细胞与哺乳动物或者其他硬骨鱼类朗格汉斯细胞相似,也是多个伯贝克颗粒围绕着中心粒呈放射状排列[20]。此外,相比于鲑科鱼类等其他脊椎动物,黄颡鱼伯贝克颗粒的形态与斑点叉尾鮰伯贝克颗粒的形态更为接近,而与其他脊椎动物却有明显差异,这可能与黄颡鱼和斑点叉尾鮰同属于鲶形目有关。
鲶爱德华氏菌是一种胞内寄生菌,主要感染黄颡鱼等鲶形目鱼类。鲶爱德华氏菌感染后,黄颡鱼的鳃和肠道均发生不同程度的病理损伤。为了更详细了解朗格汉斯细胞在细菌感染过程中的调控机制,通过荧光定量PCR检测了细菌感染后黄颡鱼免疫器官内朗格汉斯细胞功能相关基因的表达。结果显示,鲶爱德华氏菌感染后,黄颡鱼头肾、脾脏、鳃和肠道中IL-1β基因的表达量在感染前期显著上调,此结果说明大量的朗格汉斯细胞可能通过高表达的IL-1β被招募到病原菌的入侵位点,吞噬侵入的病原菌[5]。TNF-α基因仅在头肾、鳃和肠道中显著上调,并且与IL-1β基因的表达模式不同,表明这2个基因可能是通过不同的信号通路招募朗格汉斯细胞迁移的[4]。与此不同,IL-10作为一种抑炎因子,其表达量仅在脾脏和头肾中显著上调,说明IL-10主要是由头肾和脾脏中的免疫细胞合成并释放出来,调控机体免疫反应[21]。Toll样受体作为模式识别受体的一种,主要识别革兰氏阴性菌细胞壁中的脂多糖[22]。我们发现,鲶爱德华氏菌感染后,TLR-4基因在黄颡鱼头肾、脾脏、鳃和肠道中均显著上调,说明鲶爱德华氏菌感染鱼体之后,可能通过合成脂多糖引起机体炎症[23]。上述结果表明,朗格汉斯细胞可能参与了鱼体抗鲶爱德华氏菌感染的免疫反应。
本试验通过免疫组化技术证实了黄颡鱼头肾、脾脏等免疫器官中具有能与人CD207多克隆抗体结合的朗格汉斯细胞分子标记CD207蛋白,用透射电镜观察了黄颡鱼朗格汉斯细胞的形态结构。通过荧光定量PCR,从mRNA水平上研究了细菌感染后黄颡鱼免疫器官内朗格汉斯细胞功能相关基因的表达。对黄颡鱼朗格汉斯细胞的研究,将有助于我们更好地了解朗格汉斯细胞在免疫系统中的作用,可为细菌性疾病的防控提供理论基础。

