微氧EGSBBR产甲烷系统快速启动与微生物群落特性
葛大令,周鑫,RONEL Rudy Koubode,阴泽阳,张伟
(1 太原理工大学环境科学与工程学院,山西晋中030600;2 山西省市政工程研究生教育创新中心,山西晋中030600)
厌氧处理技术是一种经济高效的生物处理方法[1-2],不仅可以将废水中的有机物去除,还能回收生物能源(甲烷)[3-5],被广泛应用于高浓度有机废水处理。然而产甲烷菌属于严格厌氧菌,生长速率缓慢且对进水条件和环境要求苛刻,在产甲烷系统中同时存在着产甲烷菌、水解产酸细菌、产乙酸细菌竞争互营关系,若运行不当将会抑制产甲烷效能,导致产甲烷启动时间延长、甚至失败。近些年,微氧条件强化厌氧消化技术逐渐成为污水处理研究的关注点。在微氧条件下,兼性微生物可以快速将有机物转化为低分子脂肪酸(乙酸)的中间产物,从而为快速甲烷产生创造有利条件[6-8]。Ruan等[9]研究表明微氧曝气能够促进有机物的利用,污泥的甲烷产率提高16.4%,董春娟等[10]和Hussain等[11]研究也证明微氧条件下污泥产甲烷活性要高于严格厌氧环境,而Zitomer 等[12]的研究表明即使是分散状态的悬浮污泥,也能为好氧菌与厌氧菌提供共同生长的环境,且污泥呈现出高的产甲烷活性。低氧条件还具有氧利用率高、曝气能耗小、剩余污泥产量少、有机物去除率高、抗冲击负荷能力强,去除难生物降解物质等优势,微氧生物处理技术在产甲烷快速启动方面具有广阔的应用前景。然而微氧条件容易造成丝状菌大量生长,从而导致污泥膨胀与流失问题,增加生物填料的方式可以有效地避免污泥上浮问题,而且还可以提高反应器微生物总量,并为厌氧甲烷菌提供良好的生存微环境,保证加快反应器产甲烷启动时间。为此,本文在高效厌氧反应器(EGSB)内结合了生物膜反应器的优点,在反应区的顶部布置固定填料床,形成膨胀颗粒污泥床生物膜反应器(expanded granular sludge blanket biofilm reactor,EGSBBR),在微氧条件下通过工艺控制研究产甲烷工艺启动和微生物群落特性,为微氧EGSSBR反应器的设计和启动提供前期基础。
1 材料和方法
1.1 试验装置
EGSBBR 小试装置如图1 所示。反应器由有机玻璃制成,整个系统的有效容积约为16L,由主体反应区(7L,高1.4m,内径8.0cm)和三相分离器(9L,高0.5m,内径19.0cm)组成。反应区包括两部分,即膨胀颗粒污泥床(底部)和填料床(上部),填充了25%(体积分数)的聚氨酯(PU)海绵块(8mm×8mm×8mm)作为载体。分离器位于反应器顶部,以沉淀污泥,分离处理后的废水并收集气体。系统出水从固定在分离器上的堰排出,其中一部分出水通过内循环泵与进水混合重新进入反应器底部。

图1 EGSBBR装置示意图
1.2 接种污泥与试验用水
接种污泥来源为山西省某污水处理厂,用浓缩池污泥(污泥浓度MLSS:15.76g/L) 和曝气池(MLSS:7.47g/L)的体积比为2∶1 的混合物接种反应器,接种体积占反应区的40%。试验用水为模拟有机废水,碳源、氮源、磷源分别由葡萄糖、氯化铵、磷酸二氢钾提供,C∶N∶P质量比为200∶5∶1。进水中还加入1mL 微量元素储备液,其主要成分 如 下,FeCl3·4H2O (2000mg/L)、CoCl2·6H2O(2000mg/L)、MnCl2·4H2O(500mg/L)、CuCl2·2H2O(30mg/L)、ZnCl2(50mg/L)、H3BO3(50mg/L)、(NH4)6Mo7O24·4H2O(90mg/L)、Na2SeO3(100mg/L)、NiCl2·6H2O (50mg/L)、乙二胺四乙酸(EDTA,1000mg/L)。
1.3 反应器运行条件
反应器为连续流进水,投加适量稀盐酸控制进水pH 在7.2 左右,投加碳酸氢钠控制碱度为400~600mg/L(以碳酸钙计),通过预充氧方式控制反应器内溶解氧在0.2~0.3mg/L 之间,为了确保中温条件甲烷生成,整个系统通过温度控制器加热控制水温在(35±1)℃,反应器整体用黑色不透光纸包裹以避光。本文以葡萄糖为唯一碳源,进水化学需氧量(COD)浓度为2000mg/L 不变,通过缩短水力停留时间(HRT)和内回流比以提高进水有机负荷(OLR)以快速完成EGSBBR 反应器产甲烷启动。根据不同反应条件共分为3个运行阶段,总共运行了48天,各个阶段的运行参数如表1所示。
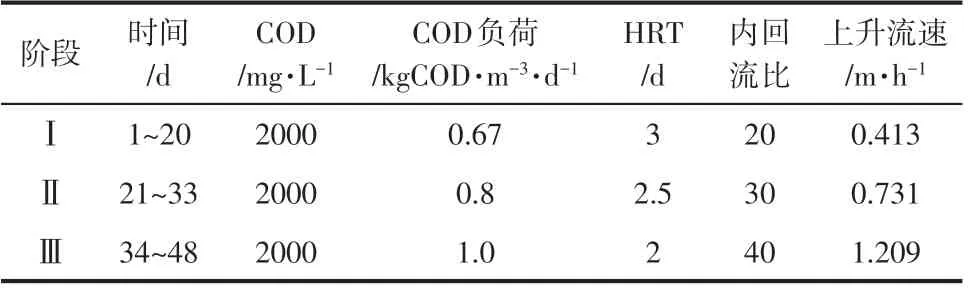
表1 EGSBBR在不同阶段的运行参数
1.4 分析项目和方法
温度,pH 和溶解氧(DO)通过便携式多参数水质分析仪(WTW Multi 3420,德国)监测。每天的出水取样并使用0.45μm 过滤器过滤,然后立即进行分析。COD 采用快速消解和哈希试剂盒进行快速测定。反应器收集到的气体通过湿式气体流量计测量其产气量。气相色谱仪型号为东西分析GC-4000A,其中气体组分测定采用热导检测器(TCD),色谱柱型号为OV-101;采用氮气为载气,载气流量为30mL/min,气化室温度为100℃,检测器温度为100℃,柱箱采用恒温模式,温度为100℃。挥发性脂肪酸(VFA)检测器为氢火焰检测器(FID),色谱柱型号为KB-FFAP,采用氮气为载气,载气流量设为25mL/min,气化室温度为220℃,检测器温度为240℃,柱箱初始温度为140℃。
污泥胞外聚合物(EPS)分析采用三维荧光光谱扫描(3D-EEM)分析,采用日本岛津公司的RF6000 型的荧光分光光度计。实验参数设置为:激发波长(Ex)为200~550nm,步长2nm;发射波长(Em)为200~550nm,步长5nm,扫描速度为12000nm/min,激发光带宽为10nm,发射光带宽为10nm,以去离子水的荧光光谱图为空白样。
为考察反应器系统内部微生物的群落结构,在试验第三阶段(第41d)于反应器污泥区和填料区各取适量污泥和生物膜样品在-20℃的环境中保存待测,实验采用Illumina-MiSeq 高通量测序平台[生工生物工程(上海)股份有限公司]对反应器微生物基因序列进行测序以分析微生物群落结构。
2 结果与讨论
2.1 产甲烷启动性能
图2(a)、图2(b)所示为培养过程中出水COD 浓度、去除率的变化和反应系统产生的主要气体组分及出水pH 的变化情况。在反应器接种后,为使微生物能尽快适应外部环境,尽快完成产甲烷启动,系统采用较长HRT(3天)。第一阶段COD去除率很低67.5%,且气体组分主要是CO2,甲烷的浓度很少。至第一段运行结束,甲烷产气量仅为60mL/d,甲烷转化率仅为4.4%。在第二阶段(21~33 天),气体组分中甲烷单日产气量呈现出十分明显的增加趋势,而CO2的单日产气量则呈逐步下降趋势,这一阶段COD去除率升高到89.7%,这是因为随着甲烷菌的活性和丰度的增长,有机物降解大量被用于合成甲烷,且系统中存在产生的CO2用于合成甲烷(氢营养产甲烷菌)而被消耗。在此阶段,随着系统产甲烷代谢活动的逐步增强;第三阶段COD 去除率进一步提高到94.2%,此时有机负荷达到1.0kgCOD/(m3·d),且产气量较第二阶段有了较大幅度的增长,该阶段甲烷单日产气量逐步趋于稳定并达到峰值,整个运行过程中最大甲烷单日产生量达582mL/d,此时甲烷的体积分数达75.62%,出水pH也从6.4(第12天)持续升高至7.6(第33天),主要是由于产甲烷代谢产生碱度所致(是不是可以认为产甲烷已启动,若是时间是34 天)。图2(c)展示了运行过程中出水VFA浓度和组分的变化情况。前期(1~11 天)出水VFA 浓度增加与出水COD 浓度相反的变化趋势证明了系统水解酸化能力的加强,微生物对系统内环境逐步适应,此时出水pH从6.9逐渐降低至6.3,且由于该阶段产甲烷菌的丰度较低,对VFA 的利用能力有限,系统内VFA 逐渐积累造成一定程度的酸化。第二阶段开始出水中乙酸浓度占VFA 总浓度的比值总体呈上升趋势,这与甲烷单日产气量逐渐增加的趋势相符,表明系统内乙酸浓度的增加有助于该类型甲烷菌的生长。出水VFA 中丙酸浓度占比整体呈降低趋势,这可能是因为产甲烷的迅速增殖消耗大量的乙酸,促使丙酸、丁酸等VFA 向乙酸转化为甲烷菌生长提供能量。出水VFA 浓度与出水COD 浓度的比值总体也呈上升趋势。图2(d)反映的是运行各阶段污泥浓度的变化和污泥活性指标(MLVSS/MLSS)。接种后污泥浓度较之前有所下降,可能因为微生物尚未彻底适应反应器和水质条件。随后开始逐步缩短HRT,并调整回流倍数使反应器内上升流速(仅计算进水流量提供的上升流速)增高,从图2(d)中可以看到第二、第三阶段的MLSS 整体呈上升趋势,且第三阶段的趋势更为明显,从9.3g/L 提高到12.325g/L, 污 泥 容 积 指 数(SVI) 则 下 降 至79.51mL/g,同时污泥在接种后MLSS/MLVSS 从最初的0.561增加到0.644,这表明微氧EGSBBR反应器能够快速发生水解酸化并提供产甲烷底物,同时增加污泥浓度、提高污泥生物活性并改善污泥沉降性。

图2 各阶段反应器处理性能
表2 统计了不同反应器甲烷启动特性相关研究。本文采用EGSBBR反应器在微氧条件下持续运行了48 天,在系统运行至第二阶段结束(第34天),反应器已经具备了较高且稳定的产甲烷效果,此时COD去除率为91.5%,产气中甲烷的体积分数为66.89%,同时反应器出水VFA浓度、pH等参数均趋于稳定,因此可以认为产甲烷快速启动已经实现。通过与其他类型反应器相比,本文的EGSBBR系统在COD去除率、产甲烷效果和启动时间等方面均具有显著优势。
2.2 EPS分析
为研究启动过程中污泥EPS特性变化,取第Ⅰ阶段(第19 天)、第Ⅲ阶段(第41 天)污泥提取EPS,分析组分浓度(表3)并进行三维荧光分析(图3)。图2(d)中可以看出第Ⅲ阶段的污泥浓度较第Ⅰ阶段较有了较大的增长,表3数据也显示出第Ⅲ阶段S-EPS、LB-EPS和TB-EPS的浓度较第Ⅰ阶段到均有一定程度的增长,其中蛋白质的增幅更大,显然EPS浓度的增大有助于污泥聚集,进而促进生物量和污泥浓度的增长,这与Deng 等[18]的研究结果类似。
由图3 可知,第Ⅰ阶段污泥EPS 提取物中只出 现 了 类 蛋 白A 峰(Ex/Em=200~235nm/285~345nm)、B 峰(Ex/Em=270~300nm/300~350nm),样品不同层EPS 提取物的荧光峰位置有不同程度的偏移,说明其化学结构及组成成分存在差异;可以发现第Ⅰ阶段S-EPS、LB-EPS 提取物中A 峰的荧光区域很小,且未扫描出类蛋白B 峰,表明提取物中芳香族、色氨酸等类蛋白物质含量少,这点在表3 中蛋白质浓度上也有体现;培养至第Ⅲ阶段,污泥EPS 提取物中类蛋白峰荧光强度显著增强,还出现了类富里酸D 峰(Ex/Em=250~260nm/415~460nm)、类腐殖酸F 峰(Ex/Em=370~415nm/450~480nm)两种峰,该阶段样品中S-EBS 和LBEPS 峰的位置相对稳定,TB-EPS 峰的位置较前两种EPS 提取物的激发和发射波长均所增大,除此之外S-EPS、LB-EPS 和TB-EPS 的类蛋白类A 峰位置分别由(214nm/285nm)、(218nm/290nm)和(220nm/330nm)移动至224nm/330nm)、(224nm/330nm)和(226nm/345nm),TB-EPS 中B 峰位置由(276nm/345nm)移动至(284nm/350nm),表明两种类蛋白类物质的激发和发射波长均发生了红移,这可能是从第Ⅰ至第Ⅲ阶段EPS 提取物内如羰基、氨基、羟基、羧基等官能团数量增加[19],多糖、蛋白质浓度的显著提高,说明了第Ⅲ阶段污泥更加稳定,代谢方式途径更加丰富,为系统中微生物不同功能菌群之间相互作用提供了良好的环境。
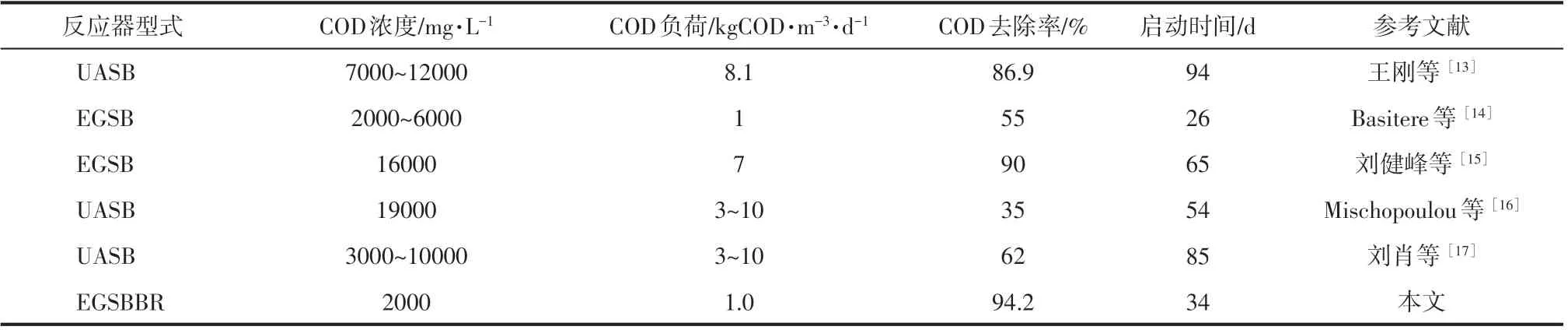
表2 EGSBBR与其他反应器产甲烷启动比较

表3 第Ⅰ、Ⅲ阶段污泥中EPS中多糖、蛋白质浓度

图3 第Ⅰ、Ⅲ阶段三维荧光光谱图(S、L、T分别代表S-EPS、LB-EPS和TB-EPS)
2.3 微生物群落分布
2.3.1 微生物多样性
取接种污泥S0和反应第3个阶段(接种培养第41 天)的填料和污泥S1、S2 进行高通量测序。ACE 是表征微生物菌群相对丰度的指数。S0 的ACE 指 数为299263,远高于S1 (19887) 和S2(17319),说明经过培养系统内菌群的相对丰度较初始接种污泥有所下降,培养环境的改变必然会导致一些不适应的菌群被淘汰,而ACE 指数中S1 较S2 稍大,这说明了生物膜结构较普通形态污泥能为更多种类的微生物提供合适的生长环境,因此生物膜相的群落相对丰度较大。Shannon 是用来表征样品中微生物多样性的指数。Shannon 指数越高,则群落多样性越高,S0的Shannon指数为4.92,最低;第Ⅲ阶段两个样本中S1 的Shannon 指数为5.38,较S2 的5.19 稍高,这是由于S1 样品生物膜的结构相对稳定,能为不同生长范围的微生物提供保护,因此更容易保持较高的生物多样性。该指数越大表明优势菌群生物量占总生物量的比重越小,反之则优势菌群生物量占总生物量比重越大[20]。接种培养前后生物多样性的升高使得系统中微生物群落之间的相互关系逐渐趋于复杂,生物类型更加多样,生物能流途径更加丰富,抗外界环境波动能力增强。
2.3.2 微生物群落构成
图4进一步研究了门、属水平上的微生物种群构成以分析接种前后的群落结构演替特征。由图4(a)可知,微生物主要分布为12个门类(丰度大于1%)。其中变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi) 和 糖 化 细 菌 门(Candidatus Saccharibacteria)为主要的优势菌群;其次是拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)等。这些门类细菌对有机物的降解和厌氧代谢有重要的作用。 通过对3 个样本中广古菌门(Euryarchaeota)丰度的比较发现,接种污泥古菌门极低,占比仅为0.01%,经过3 个阶段培养,污泥相和填料相的古菌门数量大幅提高,分别达到4.52%和1.08%,表明本系统能够快速实现产甲烷菌的优势富集。污泥相中古菌门丰度要高于填料相,其原因是由于有机物首先从EGSBBR反应器底部进入反应区,污泥相率先发生有机物代谢,随水流上升有机基质不断减少,因此污泥相的产甲烷菌数量要远大于填料相。
图4(b)是在接种前后群落总数中占比超过1%以上的细菌菌属,包含18 个菌属。与接种污泥S0相比,培养第3阶段污泥高通量中Saccharibacteria_genera_incertae_sedis、 Longilinea、 Ornatilinea 和Levilinea 菌属在生物群落中的占比明显增大,这与系统表现出越来越强的有机物降解能力分不开联系,此类细菌主要以糖和蛋白质为底物厌氧发酵生长,例如Saccharibacteria_genera_incertae_sedis 能直接将葡萄降解代谢为乙酸等物质,这些微生物代谢的同时也为甲烷菌的生长提供了必要的底物条件;另 外 一 些 Phaeodactylibacter、 Aeromonas、Acinetobacter 等菌属与接种前相比明显减少,这可能是因为底物种类及含量的改变使部分菌种被选择性淘汰。Methanothrix 菌属在生物群落中的占比明显增大,而另外一些诸如Phaeodactylibacter、Alkanindiges、Aeromonas 和Acinetobacter 等菌属与接种前相比明显减少。
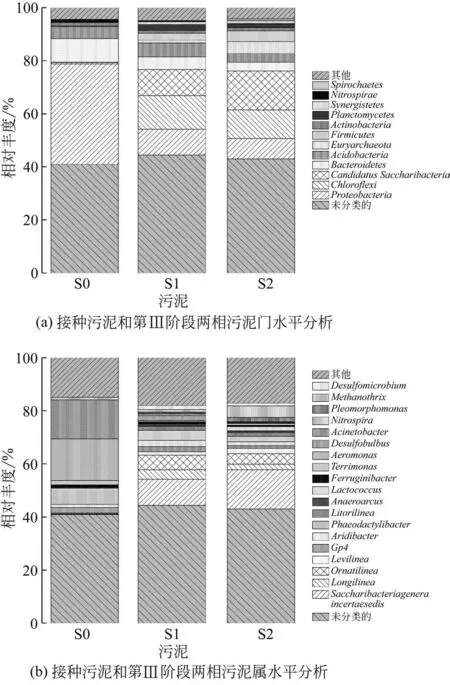
图4 接种污泥和第Ⅲ阶段两相污泥中微生物群落构成
本文中产甲烷菌(MPB)是产甲烷能否成功实现的关键功能菌。MPB 的丰度从接种污泥中的0.01%增长到4.52%(污泥相)和1.08%(填料相),经过3 个阶段的培养有了显著的富集。本系统内占绝对优势的产甲烷菌属为Methanothrix[21],属于甲烷八叠球菌目(Methanosarcinales),主要通过乙酸脱羧途径产生CH4和CO2[22],不能利用其他产甲烷基质H2-CO2、甲酸、甲醇等进行甲烷合成,更适合在乙酸底物较高条件生长,这与图2(c)VFA中乙酸比率升高的结果相吻合。系统内还检测出了少 量 的 其 他 MPB 如 Methanosarcina[23]、Methanospirillum[24]、Methanosphaerula[25],它 们 都 通过H2/CO2途径形成甲烷进行能量代谢。不同产甲烷菌对体系中有害物质或环境因子的适应能力不同,MPB 中Methanosarcina 和Methanothrix 都属于甲烷八 叠 球 菌 目 (Methanosarcinales) , 而Methanospirillum 和Methanosphaerula 属 于 甲 烷 微 菌目(Methanomicrobiales),显然甲烷八叠球菌目更能适应反应器环境。有研究表明[26-27],在具有高沼气产率的反应器内,甲烷八叠球菌目占比通常要高于其他产甲烷菌,这与本文结果相符。生物膜相的产甲烷菌的发现表明EGSBBR中生物载体区有助于产甲烷菌的附着生长,可以进一步提升污泥床甲烷产率。
3 结论
(1)本文采用微氧EGSBBR为反应器,处理高浓度有机废水,COD 2000mg/L,通过逐步缩短HRT 和增大反应区上升流速的方式经过34 天实现了产甲烷菌快速富集。
(2)系统的COD最高去除效率达到94.2%,最大甲烷单日产气量为582mL/d,此时生物气中甲烷的体积分数为75.62%。反应器出水VFA 变化、EPS特征均与甲烷生成量具有直接相关性。
(3)培养后污泥的多样性较接种前有所升高。系统内微生物主要由变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)和糖化细菌门为优势门水平,属水平上,甲烷丝菌属Methanothrix 占据绝对的优势,表明系统产甲烷主要是通过乙酸脱羧方式形成。

