循环微反应系统内间甲基苯甲醚的合成
王德强,王金婷,王凯,骆广生
(1 潍坊科技学院,山东半岛卤水资源高值化绿色化综合利用工程技术研发中心,山东潍坊262700;2 清华大学化工系,化学工程联合国家重点实验室,北京100084)
间甲基苯甲醚属于芳香醚类化合物,主要用于以2-苯氨基-3-甲基-6-二丁氨基荧烷(ODB-2)为代表的荧烷类热敏染料[1]的合成过程。芳香醚可通过经典的氧烷基化(醚化)反应Williamson法制备,即酚类化合物与相应的甲基化试剂在碱的作用下直接反应得到。适用于间甲基苯甲醚合成的甲基化试剂众多,如硫酸二甲酯(DMS)[2-3]、卤代甲烷(包括氯甲烷、溴甲烷、碘甲烷)[4]、碳酸二甲酯(DMC)[5]等。虽然碳酸二甲酯作为环保型甲基化试剂具有良好的发展前景,但由于价格高昂,目前未见大规模工业化报道。硫酸二甲酯和卤代甲烷均具有活性高、反应条件温和的特点,相比来讲卤代甲烷沸点低、挥发性大,不利于工业生产的实施。因此,硫酸二甲酯甲基化法是目前工业上通用的生产方法,具有工艺条件简便,原料价格廉价等优势。
以硫酸二甲酯为甲基化试剂合成间甲基苯甲醚是在碱性物质的作用下间甲酚首先转化为酚离子,然后酚离子与硫酸二甲酯反应生成目标产物的过程。在这一过程中,体系中的硫酸二甲酯也容易与碱发生水解副反应形成甲醇、硫酸单甲酯盐和硫酸盐,因此间甲酚与硫酸二甲酯对碱性物质的竞争最终决定了产物的收率。传统生产经验认为反应温度越高硫酸二甲酯水解越快,高温不利于氧烷基化反应选择性的提高。因此,目前工业上普遍采用0~10℃的低温环境来完成硫酸二甲酯和间甲酚的反应过程。该过程一般通过向硫酸二甲酯和间甲酚的混合溶液中缓慢滴加氢氧化钠水溶液的方式来实现,控制氢氧化钠溶液的滴加速度限制反应热的释放,同时保证体系总体上呈酸性,抑制硫酸二甲酯的水解反应。由于该反应过程为油水两相反应(有机混合物为一相、碱性溶液为另一相),体系中局部的碱含量和温度不易控制,反应收率主要受到氢氧化钠溶液在有机体系中混合效果的影响。实际生产中为了保证混合良好,氢氧化钠水溶液的加料时间一般长达6~8h,生产效率严重低下。
近年来,微反应技术以其在混合、传质、传热方面的突出优势在精细化学品合成领域发展迅速,尤其在液液、气液等多相反应体系中获得广泛应用[6]。研究结果表明:微混合器内体积传质系数是传统搅拌釜或塔式设备的10~100 倍[7-8],基于微分散原理开发出的微筛孔反应器能够有效强化液液两相传质,提高反应效率[9],该技术有望解决间甲基苯甲醚合成过程中反应物的混合问题。为此,本文设计了以微通道混合器作为核心元件的环流微反应系统,尝试使用微反应器实施间甲酚/硫酸二甲酯混合溶液和氢氧化钠溶液间的快速混合,研究反应温度、物料浓度与配比等条件对于间甲基苯甲醚收率的影响规律,与传统的低温工艺对比,验证了微反应技术的先进性。
1 反应原理
间甲酚与硫酸二甲酯的氧烷基化反应需要在碱性物质的辅助下才能快速进行[10-11]。以氢氧化钠为例,反应的基本原理为间甲酚首先与氢氧化钠反应形成间甲酚钠,再与硫酸二甲酯反应生成间甲基苯甲醚,如式(1)和式(2)所示。

副反应为硫酸二甲酯的水解反应,水解产物为硫酸甲酯钠、硫酸钠和甲醇,反应方程式如式(3)和式(4)所示,其中方程式(4)所示的硫酸甲酯钠水解反应一般需要在>100℃的条件下才能彻底完成[12]。

2 实验部分
2.1 微反应装置
实验装置如图1所示,该装置由一个微通道反应器和一个搅拌釜通过循环泵和管线相连。采用的微反应器为自制的微通道反应器,内部T形混合通道的横截面积为0.6mm×1mm。搅拌釜为一个500mL四口夹套玻璃反应釜,循环管线总体积约为15mL。实验前开启反应釜搅拌,将一部分反应物加入反应釜中,该物料作为反应的循环溶液,实验中通过循环泵3(WT-600EL,重庆杰恒蠕动泵有限公司)送入微反应器。另一部分反应物储存在物料储罐中,通过计量泵(2PB-20005,北京星达科技发展有限公司)送入微反应器。该物料在微反应器内通过循环溶液的错流剪切作用形成微小液滴并分散于循环溶液中发生反应,反应釜的搅拌保障了循环溶液中油水两相的均匀接触。微反应器出料经内径4mm、长度400mm 的聚四氟乙烯管道返回反应釜。反应体系的温度通过调节夹套中制冷剂的温度和流量控制,通过温度计读取。

图1 微反应实验装置示意图
2.2 试剂及分析方法
氢氧化钠(分析纯)由山东莱阳经济技术开发区精细化工厂提供,间甲酚(工业品,纯度99%)由德国朗盛化学公司提供,硫酸二甲酯(工业品,纯度98.5%)由山东临沂远博化工有限公司提供。间甲酚及间甲基苯甲醚的浓度采用气相色谱法分析。气相色谱仪为Agilent 7820,色谱柱为HP-5(320μm×0.25μm×30m)。根据色谱分析可获得间甲基苯甲醚与间甲酚的峰面积,进一步通过标准曲线计算出样品中间甲基苯甲醚和间甲酚的含量用于计算反应收率。
3 实验结果与讨论
3.1 间甲酚钠的形成反应
在开展间甲酚与硫酸二甲酯之间的氧烷基化反应前,首先考察了间甲酚与氢氧化钠的反应过程。在反应釜中首先配制了200mL 摩尔分数为10%的间甲酚溶液(以产物间甲基苯甲醚为溶剂),然后利用循环泵控制间甲酚溶液流量至40mL/min,再通过计量泵以5mL/min 的流量将30%(质量分数)氢氧化钠水溶液注入微反应器与循环溶液混合并且发生酸碱中和反应,实验中反应釜温度始终控制在0℃(实验温度偏差±2℃)。在这一过程中间甲酚与氢氧化钠反应生成间甲酚钠并溶解在水相,未参与反应的间甲酚则残留在油相。在氢氧化钠完成加料后,反应釜即停止搅拌,静置5min 后通过气相色谱测定油相间甲酚的含量,结果表明:当等当量氢氧化钠加入反应装置后,油相残余间甲酚含量仅为0.5%,说明99.5%的间甲酚已经转化为间甲酚钠。可见间甲酚与氢氧化钠之间的反应即使在0℃的低温环境中仍然能够在微反应器的帮助下快速完成,这一快速的中和反应保障了氧烷基化反应在消耗氢氧化钠方面的速率优势。
3.2 间甲酚钠与硫酸二甲酯的反应
间甲酚与硫酸二甲酯的氧烷基化反应实质上是间甲酚钠参与的反应过程,为了进一步认识反应的基本规律,设计实验考察间甲酚钠转化率与反应温度之间的关系。考虑到硫酸二甲酯在较高温度下能发生水解反应且其水解产物呈酸性,故在配制间甲酚钠溶液时加入稍过量的氢氧化钠以保证整个反应过程中溶液始终处于碱性(使间甲酚钠浓度不受硫酸二甲酯水解的影响)。实验在反应釜中事先加入52.5mL 间甲酚和30%氢氧化钠溶液52.6mL,控制间甲酚和氢氧化钠的摩尔比为1/1.05。开启循环泵,调节循环流量至40mL/min 并通过计量泵以5mL/min流量将与间甲酚等摩尔当量的硫酸二甲酯加入反应体系。加料结束后停止搅拌,反应产物随即分为油水两相,其中有机相为间甲基苯甲醚,水相为间甲酚钠、硫酸甲酯钠、硫酸钠和甲醇的水溶液。进一步调整该溶液pH至4.0以下,使未反应的间甲酚钠转换为间甲酚并溶解至有机相(通过紫外分光光度法可以验证在酸性条件下间甲酚几乎100%被间甲基苯甲醚萃取),然后根据气相色谱分析结果和两相体积,计算间甲基苯甲醚收率(yPhOMe,%),如式(5)所示。

式中,n0,PhONa为原料间甲酚钠的物质的量,mol;nf,PhOH为反应后残余间甲酚的物质的量,mol。
实验结果如图2所示,可见随着反应温度的升高间甲基苯甲醚的收率显著增大,说明间甲酚钠与硫酸二甲酯适宜在较高温度下进行反应。与传统生产过程不同,本实验始终处于强碱性溶液环境,因此当反应温度<10℃时,硫酸二甲酯的水解依旧较为迅速,甲基苯甲醚的收率仅为77.6%。然而,随着反应温度的升高,氧烷基化反应速率得到提升,产物收率也相应提升。但是当体系温度>80℃时,间甲基苯甲醚收率出现降低,说明此时过高的反应温度才导致硫酸二甲酯的快速水解。因此,间甲酚钠与硫酸二甲酯的最佳反应温度在60~80℃,且间甲基苯甲醚的最高收率已达97%,表明反应过程中硫酸二甲酯水解副反应明显被削弱,产生这一现象的主要原因在于微反应器保证了反应体系良好的混合特性。这一实验也证明了间甲酚钠与硫酸二甲酯的反应和硫酸二甲酯的水解反应均为快反应,适当升高温度更有利于氧烷基化反应速率的提升,从而在动力学竞争中获得选择性优势。传统搅拌反应过程传质速率低,限制了间甲酚在主体相中的传递,因此很可能因局部的氢氧化钠过量造成了温度升高有利于硫酸二甲酯水解的假象。
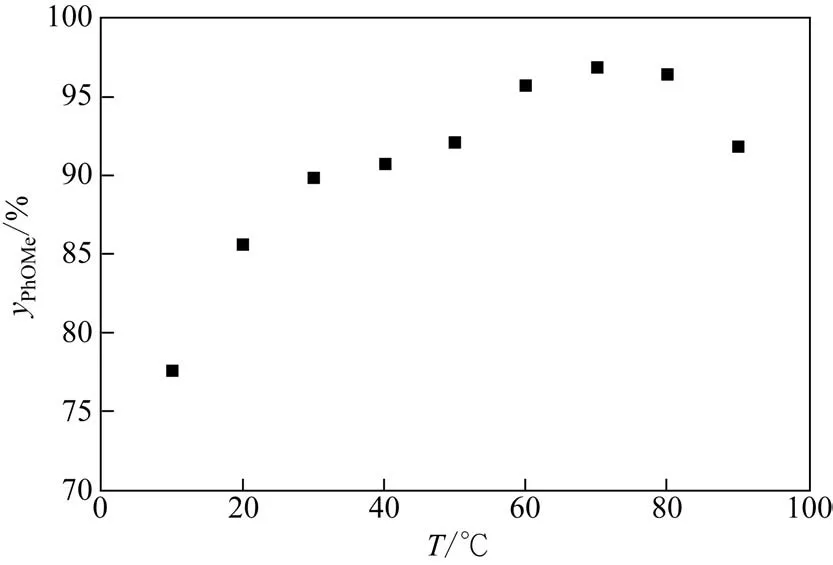
图2 间甲基苯甲醚收率与反应温度T的关系
3.3 间甲酚与硫酸二甲酯的反应
3.3.1 反应温度的影响
间甲酚与硫酸二甲酯的氧烷基化反应需在碱性物质的辅助下才能快速进行,上文验证了间甲酚钠和硫酸二甲酯的直接反应,获得了较好的反应结果,但因为该过程实为大相比油水两相反应,反应末期仍可能受到间甲酚钠浓度的限制。为此尝试改变进料方式,仿照工业生产过程将间甲酚与硫酸二甲酯事先均匀混合形成循环原料液,再将该溶液与氢氧化钠溶液通过微反应器进行反应,原位生成间甲酚钠并转化为间甲基苯甲醚。实验中,首先配制了52.5mL 间甲酚和48.0mL 硫酸二甲酯的混合溶液(等摩尔当量),然后利用循环泵控制混合溶液的循环流量为40mL/min,通过计量泵以5mL/min的流量将质量分数为30%的氢氧化钠溶液注入微反应器与循环溶液反应(氢氧化钠与间甲酚等摩尔量),加料时间总计15min,反应釜温度分别控制在10℃、40℃、80℃,加料结束后继续搅拌。从氢氧化钠溶液开始注入起每隔一定时间从反应釜中取出微量混合物,经氢氧化钠中和(分解硫酸二甲酯)后调整pH至4.0左右,再通过气相色谱分析并计算间甲基苯甲醚收率,如式(6)所示。

式中,nPhOH为样品中间甲酚的物质的量,mol;nPhOMe为样品中间甲基苯甲醚的物质的量,mol。
实验结果如图3所示,可见在反应温度为10℃时间甲酚的氧烷基化反应速率较低,这与图2所示的结果一致。但不同上述使用过量氢氧化钠完成的实验,氢氧化钠溶液加料结束后仍保存了部分未水解的硫酸二甲酯,可以继续形成间甲基苯甲醚,但此时反应已经非常缓慢,即使反应时间延长至90min,间甲酚仍然未能够完全反应。然而,当选择较为合理的80℃反应时,反应可在加料后即完成,间甲基苯甲醚的收率达到98%以上,并且大幅缩短了反应时间。该结果再次证明了高温对氧烷基化反应的强化作用,并且由于体系大多数时间处于酸性条件,因此水解反应也并未大规模发生,此结果也说明通过微反应器改造现有常规搅拌反应装置有望提高反应的效率和产能。
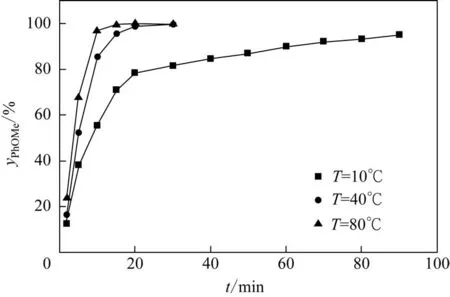
图3 不同温度下间甲基苯甲醚收率与反应时间t的关系
3.3.2 反应溶液流量比的影响
为了深入理解微混合过程对于间甲酚氧烷基化反应的影响,进一步改变微反应器的操作条件进行实验,以等摩尔的间甲酚与硫酸二甲酯形成的混合溶液(110mL)作为循环液,设定其流量VRE分别为5mL/min、20mL/min、35mL/min 和40mL/min。将质量分数为30%的氢氧化钠溶液通过计量泵加入微反应器,设定其流量VNaOH为5mL/min。控制反应温度在60℃,氢氧化钠与间甲酚的摩尔比为1,实验结果如表1所示。可以看出,随着油水流量比(VRE/VNaOH)的增大,间甲基苯甲醚的收率也逐渐增大。此时,微反应器内氢氧化钠与间甲酚的摩尔比逐渐减小,体系中碱浓度低,降低了硫酸二甲酯发生水解反应的机率。同时,通过外循环将反应物料在微反应器中进行油水两相的多次混合,也可以促进水相中间甲酚钠的传质与反应。当流量比达到7时,间甲基苯甲醚的收率变化已经不明显,表明反应已达到相对优化的条件。
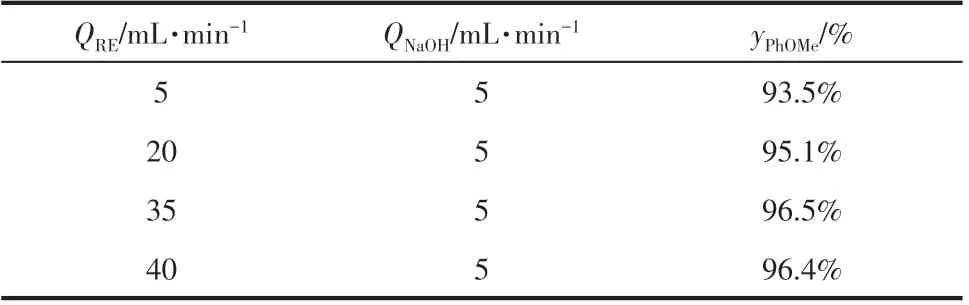
表1 流量比对间甲基苯甲醚收率的影响
3.3.3 氢氧化钠浓度的影响
本实验进一步以等物质的量的间甲酚和硫酸二甲酯形成的混合溶液(110mL)作为循环液,在循环流量40mL/min、氢氧化钠溶液流量5mL/min、氢氧化钠与间甲酚的摩尔比等于1、反应温度60℃的条件下,考察了氢氧化钠浓度对间甲基苯甲醚收率的影响,结果如图4所示。从30%出发,随着氢氧化钠浓度的降低,体系中的水含量显著增加,减小了间甲酚钠与硫酸二甲酯分子接触的概率,而硫酸二甲酯的水解反应则相应加强,导致间甲基苯甲醚的收率降低。当氢氧化钠溶液浓度提高至45%时,间甲基苯甲醚收率略微下降,同时观察到反应后期系统中产生硫酸甲酯钠的固体沉淀。说明此时已经达到该体系反应物溶解度的极限。综上所述,采用30%氢氧化钠溶液能够获得较为理想的反应效果。
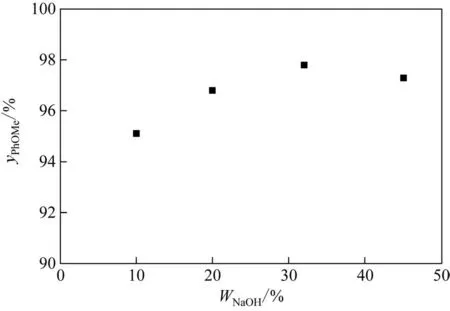
图4 间甲基苯甲醚收率与氢氧化钠溶液浓度的关系
3.3.4 反应计量比的影响
考虑到水解反应消耗部分硫酸二甲酯,因此按照化学计量比进行该反应难以达到更高的收率。为此,本实验进一步改变硫酸二甲酯、氢氧化钠和间甲酚的摩尔比(n0,PhOH/n0,DMS/n0,NaOH)进行反应,在循环液流量40mL/min、氢氧化钠溶液流量5mL/min、反应温度60℃的条件下,结果如表2所示。可以看出,随着硫酸二甲酯用量的增加,间甲基苯甲醚的收率增加。氢氧化钠用量同样影响间甲酚的反应,表现在当氢氧化钠与间甲酚摩尔比为1时,二甲酯的用量即使增加至1.1 倍,间甲基苯甲醚的收率也仅由95.6%提高至96.4%,随着氢氧化钠用量的增加间甲基苯甲醚的收率才进一步提高,这主要是因为氢氧化钠维持了间甲酚不断转化为间甲酚钠。因此在过量氢氧化钠的辅助下,硫酸二甲酯和间甲酚摩尔比大于1.05,间甲基苯甲醚产率可达99%以上。本实验中当间甲酚/硫酸二甲酯/氢氧化钠的摩尔比为1.0/1.15/1.2 时,间甲基苯甲醚的收率接近100%。
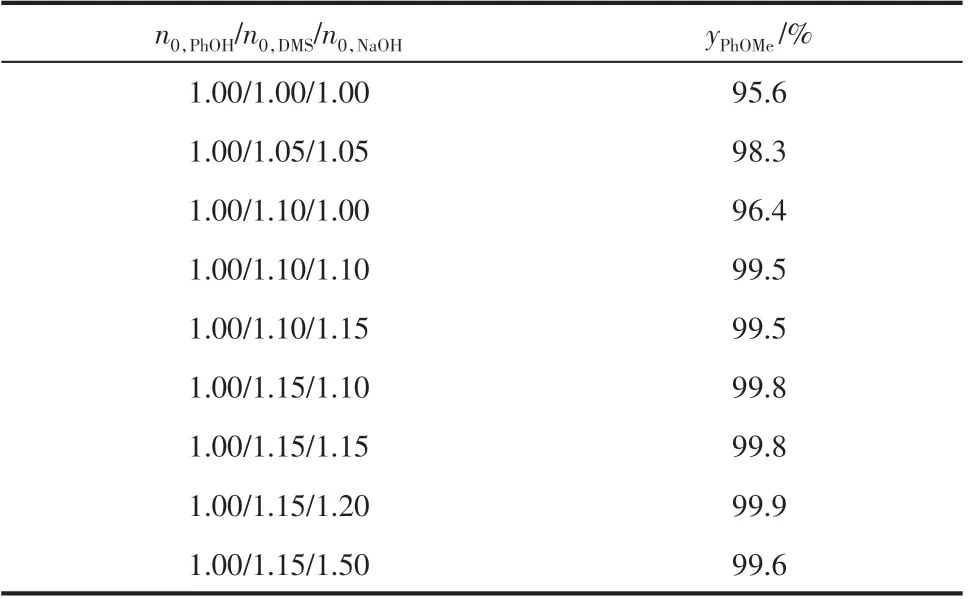
表2 不同物料配比对间甲酚的转化率影响
4 结论
针对间甲酚和硫酸二甲酯之间的氧烷基化反应开展了微反应实验研究。以往工业生产经验普遍认为该反应适宜在<10℃的条件下进行,通过微反应器强化物料的混合,发现该反应适宜在60~80℃的条件下进行,主要原因在于高温强化了氧烷基化反应与水解反应的竞争,提高了间甲基苯甲醚的收率。系统考察了反应温度、物料浓度、配比等因素对于间甲基苯甲醚收率的影响,实验结果表明:通过微反应器实施间甲酚和硫酸二甲酯在30%氢氧化钠水溶液作用下的反应,可在硫酸二甲酯与间甲酚的摩尔比大于1.05 的条件下获得99%以上的间甲基苯甲醚收率。

