去小胶质细胞化对糖尿病小鼠视网膜光感受器细胞的影响△
刘然 晏颖 陈晓
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病常见的并发症,也是工作年龄人群最主要的致盲原因。据统计,全球约三分之一的糖尿病患者会出现由DR所引起的视功能下降,进而影响生活质量[1]。目前,DR影响视力的机制尚未完全明确。既往研究认为,DR是一种微血管疾病,以血-视网膜屏障破坏所致的血管渗透性增加为主要特征[2]。然而近年来越来越多的学者发现,在部分糖尿病患者的视网膜中出现了以视网膜神经细胞凋亡和活化胶质细胞增生为标志的神经变性改变,且神经变性早于DR的微循环异常[3]。已有研究表明,DR中活化的小胶质细胞可加重视网膜神经节细胞的损伤[4],但是作为视网膜的第一级神经元的光感受器细胞,在DR的早期阶段是否也会受到活化的小胶质细胞的影响尚未完全明了。本研究拟使用新发现的小胶质细胞标记物P2ry12[5]来探索在糖尿病状态下小胶质细胞在视网膜中的分布变化情况,即是否会存在小胶质细胞由视网膜内层向外层的迁移,如果存在,这种迁移是否会对光感受器细胞造成损害呢?此外,本研究还拟用AIN-76A(标准饮食配制的啮齿类实验动物纯化饲料),其中含有290 mg·kg-1PLX3397[一种穿透血-脑屏障并选择性抑制集落刺激因子1受体(colony-stimulating factor 1 receptor,CSF1R)的酪氨酸激酶活性的小分子]喂养耗竭小胶质细胞的方法[6],进一步探究糖尿病状态下去除小胶质细胞后能否减弱小胶质细胞对光感受器细胞的损害。
1 材料与方法
1.1 材料
1.1.1 实验动物SPF级6~8周龄健康雄性C57BL/6J小鼠15只(购于北京斯贝福生物技术有限公司,动物合格证号:420089000035),体质量23~25 g,实验动物(SPF级)由华中科技大学同济医学院实验动物中心分笼饲养:环境温度(22±2) ℃,空气湿度(60±5)%,每天光照12 h,自由摄食、饮水。所有实验动物的操作管理方法均通过华中科技大学同济医学院实验动物中心的伦理审查委员会审核。
1.1.2 主要试剂及仪器链脲佐菌素(STZ,美国Sigma公司),TBS缓冲液(0.01 mmol·L-1,pH=7.4,自行配制),Harris苏木素染色液、醇溶性伊红溶液、山羊封闭血清、TUNEL反应液(瑞士Roche 公司),P2ry12抗体、含DAPI抗荧光淬灭封片剂、石蜡切片机(美国Thermo公司),BH-2光学显微镜、倒置荧光显微镜(日本Olympus公司)等。
1.2 方法
1.2.1 动物模型建立采取腹腔注射STZ溶液制作糖尿病动物模型。10只小鼠禁食12 h后,给予一次性腹腔注射10 g·L-1STZ溶液(以 0.1 mmol·L-1、pH 4.4 柠檬酸缓冲液配置)160 mg·kg-1。3 d后测定空腹血糖,血糖浓度≥16.7 mmol·L-1视为造模成功。造模成功的小鼠进入下一步实验。在普通饲料喂养1周后,随机选择5只糖尿病小鼠改用PLX3397(CSF1R 激酶抑制剂)290 mg·kg-1以AIN-76A连续喂养3周以耗竭小胶质细胞。分为空白对照组(A组,正常小鼠普通饲料喂养4周)、糖尿病阴性对照组(B组,糖尿病小鼠普通饲料喂养4周)、糖尿病去小胶质细胞组(C组,糖尿病小鼠普通饲料喂养1周+AIN-76A纯化饲料连续喂养3周),每组各5只小鼠。
1.2.2 制作小鼠视网膜石蜡切片及HE染色用100 g·L-1水合氯醛麻醉小鼠,取出单眼眼球,眼球固定液(80 mL 体积分数80%酒精+10 mL体积分数35%甲醛+8 mL体积分数99%冰醋酸)固定24 h,常规脱水,浸蜡,石蜡包埋。常规脱蜡后制作厚度为5 μm的小鼠眼球石蜡切片,取经视盘的视网膜切片,连续切片分置于5张不同载玻片,使每张载玻片保留2张标本。常规苏木精-伊红染色,中性树胶封固,显微镜下观察HE染色情况。
1.2.3 TUNEL法检测细胞凋亡将石蜡切片水化脱蜡后PBS清洗,滴加蛋白酶K溶液50 μL,置于37 ℃湿盒中孵育15 min,PBS清洗;滴加体积分数0.3% 的甲醇双氧水溶液进行阻断,室温15 min,PBS清洗;滴加TUNEL反应液50 μL(A液B液按19混匀)置于37 ℃湿盒中孵育45 min,阴性对照用PBS代替反应液孵育,PBS清洗;然后用驴血清封闭 20 min,滴加C液植物过氧化物酶(POD)转换剂50 μL,37 ℃湿盒中孵育15 min,PBS清洗;最后DAB显色,镜下控制时间;苏木素复染,梯度酒精脱水,透明,封片。荧光显微镜下观察小鼠视网膜上外核层(outer nuclear layer,ONL)细胞凋亡情况,凋亡细胞呈绿色点状荧光。对ONL的TUNEL阳性细胞进行计数。每个样本取5张切片进行计数,每一张切片将各区同一位点所得数值相加求和取平均值,求该样本各位点的TUNEL阳性细胞数。
1.2.4 免疫荧光标记小胶质细胞将石蜡切片脱蜡后置于EDTA 缓冲液中微波修复,修复完成后置于体积分数3%过氧化氢溶液中,室温避光孵育10 min,PBS清洗3次;随后用驴血清封闭20 min,去除封闭液后,再加入50 μL稀释P2ry12一抗(1400),4 ℃孵育过夜;清洗后加入二抗,37 ℃孵育 30 min,DAPI染色后清洗,滴加适量抗荧光淬灭剂于组织上,封片,荧光显微镜下观察小鼠视网膜上小胶质细胞的染色情况,小胶质细胞呈绿色点状荧光。
1.3 图像分析及统计学处理在同一光线强度、放大倍数(×400)条件下,每张切片中距视盘3 mm范围内随机选5个高倍镜视野进行拍照,应用Image-Pro Plus 6.0图像分析软件对免疫荧光图片进行半定量分析,检测P2ry12抗体的平均吸光度(D)值,并以免疫阳性染色D值来表示抗原表达量,D值越高则阳性表达越强。采用SPSS 25.0统计学软件进行统计分析。两样本均数比较采用独立样本t检验。多组样本均数比较采用One-Way ANOVA(单因素方差分析)方法,然后采用最小显著差(LSD)检验进行多重比较,检验水准:α=0.05。
2 结果
2.1 HE染色A组:小鼠视网膜切片见各层层次清晰,由内向外依次可见3层界限分明的核层,分别为神经节细胞层(ganglion cell layer,GCL)、内核层(inner nuclear layer,INL)、ONL。B组:视网膜各层结构较清晰,由内向外依次可见3层界限分明的核层,GCL水肿,内丛状层(inner plexiform layer,IPL)、INL、ONL排列疏松,视网膜厚度较A组增加。C组:视网膜各层结构清晰,视网膜厚度与A组相比无明显变化,GCL较B组视网膜水肿减轻,IPL、INL、ONL排列较B组紧密(图1)。

图1 光学显微镜下观察各组小鼠视网膜结构 A:视网膜石蜡切片;B:A组;C:B组;D:C组。红框代表小鼠视网膜的HE染色图取自距视盘3 mm范围内的清晰视野照
2.2 免疫荧光半定量分析结果A组小鼠视网膜上仅有少量小胶质细胞分布于视网膜内层;B组小鼠视网膜上小胶质细胞增生,并出现在视网膜外层;C组小鼠视网膜各层均未见小胶质细胞。各组小鼠视网膜中P2ry12的D值分别为:A组:0.012 3±0.000 6,B组: 0.018 8±0.005 6,C组:0.003 5±0.000 6,整体比较P2ry12 荧光强度差异有统计学意义(F=49.72,P<0.001)。B组视网膜中P2ry12的D值较A组和C组明显升高,差异均有统计学意义(t=3.478、8.166,均为P<0.05)。C组视网膜中P2ry12的D值较A组明显降低(t=30.409,P<0.001)(见图2)。
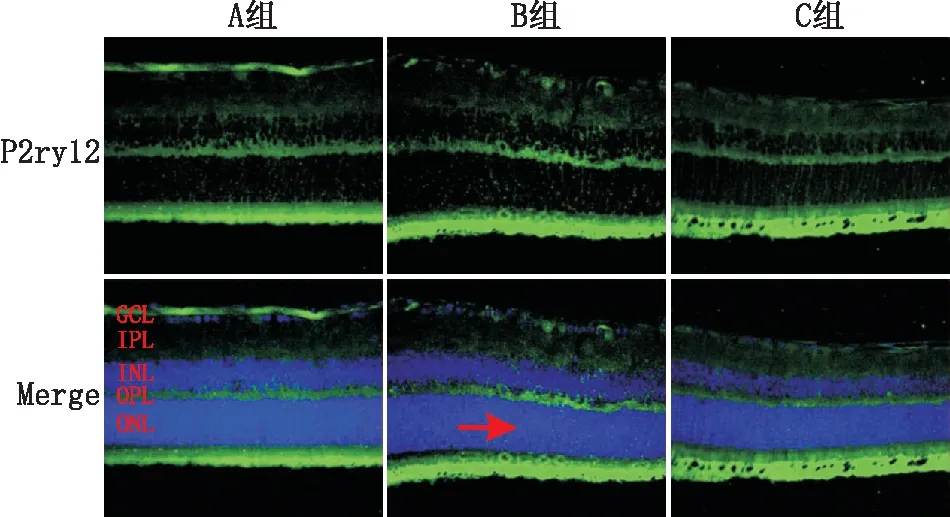
图2 各组小鼠视网膜P2ry12的表达(免疫荧光染色,×400) 红箭头示处于视网膜ONL中的小胶质细胞
2.3 TUNEL凋亡检测结果A组小鼠视网膜ONL无TUNEL阳性细胞;B组视网膜ONL中出现TUNEL阳性细胞;C组视网膜ONL中出现少许TUNEL阳性细胞(见图3)。A组、B组、C组视网膜ONL中每高倍视野TUNEL阳性细胞数分别为:(0.67±0.87)个、(9.22±1.56)个和(2.22±0.97)个。与A组相比,B组视网膜ONL凋亡细胞数增多(t=14.360,P<0.001);C组ONL凋亡细胞数较B组减少(t=11.408,P<0.001);A组ONL凋亡细胞数较C组减少(t=-3.585,P=0.02),差异均有统计学意义。

图3 各组小鼠视网膜TUNEL染色结果(×400) 红箭头示ONL中TUNEL阳性细胞
3 讨论
小胶质细胞作为包括视网膜在内的中枢神经系统的常驻免疫细胞,在维持神经视网膜微环境的动态平衡方面发挥重要作用[7]。小胶质细胞在不同的病理条件(包括轴索损伤、缺血、肿瘤、外伤以及中枢神经系统变性疾病等)下被激活,活化的小胶质细胞不仅会发生形态学改变,还会合成和释放多种细胞因子、趋化因子、神经营养因子和神经递质,使它们能够与多种细胞类型相互作用,并根据组织环境发挥细胞毒性或细胞保护作用[8-9]。小胶质细胞不仅参与了中枢神经退行性疾病的病理过程,还与遗传性视网膜疾病、创伤性神经变性、青光眼、葡萄膜视网膜炎、增生性玻璃体视网膜病变、黄斑变性和DR等视网膜疾病的发病过程相关[9-10]。在正常成人视网膜中,小胶质细胞主要分布在CGL、IPL,偶见发育中的INL[11]。小胶质细胞的激活伴随着细胞形态改变的表型变化,促炎作用的M1型或起抗炎作用的M2型。因此,分析视网膜小胶质细胞的特性有助于我们了解这些细胞的生理功能及其在视网膜疾病中的作用。
本研究观察在早期糖尿病小鼠的视网膜中小胶质细胞增生、活化以及向视网膜外层迁移的情况。本研究采用抗P2ry12抗体荧光标记小胶质细胞[12],发现在空白对照组中P2ry12低表达,而糖尿病早期P2ry12表达增加,在视网膜ONL中也有表达,证实了小胶质细胞在糖尿病早期就已经开始活化增殖。Zeng等[11]分析了13例不同阶段DR(死后或手术摘除眼球)患者视网膜小胶质细胞的特征,结果发现在DR早期(非增生期和增生前期),在血管周围间隙包括微动脉瘤周围间隙及视神经软膜间隔内也可见小胶质细胞浸润,且小胶质细胞数量增多,体积增大;在增殖期,观察到小胶质细胞聚集在受新生血管影响的视网膜区域。Vujosevic等[13]使用光学相干断层扫描发现了糖尿病视网膜中的高反射点,他们认为这些高反射点对应于聚集的小胶质细胞,虽然这些高反射点在DR早期仅局限于视网膜内层,但随着疾病的进展,这些高反射点的数量增加,并出现在视网膜外层结构中。
本研究结果显示在糖尿病早期,ONL在出现增殖活化的小胶质细胞的同时,凋亡细胞也增多。随着病程的进展,凋亡细胞增多就会导致视网膜外层厚度显著变薄[14]。但本研究中ONL厚度并未变薄,推测可能是观察时间不够长,光感受器细胞的形态退化尚不是太明显而以功能性改变为主[15]。有文献报道早期糖尿病患者中,仅仅出现有限的视杆细胞丢失,但有比较明显的对比敏感度下降和异常的视网膜电图[16-17],也印证了我们的推测。此外,视网膜外层结构的延迟变化,可能也与视网膜内外层血供来源不同有关:外层视网膜由脉络膜的毛细血管供应,内层视网膜由视网膜的毛细血管供应[18]。由于视网膜血管系统的退行性改变在糖尿病病程中发生更早,因此更早受到影响的是内层视网膜,位于外层的光感受器受到的影响相对轻微[19]。
本研究使用PLX3397对糖尿病模型小鼠予以去小胶质细胞化处理,PLX3397被称为Pexidartinib,可系统地耗尽中枢神经系统内包括小胶质细胞和巨噬细胞在内的所有免疫细胞。PLX3397是一种穿透血-脑屏障并选择性抑制CSF1R的酪氨酸激酶活性的小分子(CSF1调节巨噬细胞的增殖、分化和存活)[20]。既往研究发现,正常小鼠在连续使用特异性 CSF1R 激酶抑制剂(PLX3397)3 d、7 d后,脑内小胶质细胞数量分别减少大约 50%、90%,在所有实验的区域中,中枢神经系统内小胶质细胞在连续使用3周后消失[6,21]。本研究中连续喂养21 d含290 mg·kg-1AIN-76A的标准饮食配制的纯化饲料后,视网膜中的小胶质细胞被清除。在去除小胶质细胞后,糖尿病早期小鼠视网膜的ONL凋亡细胞显著减少。
因此,我们认为,通过对糖尿病小鼠进行去除小胶质细胞处理可减少小胶质细胞的活化和迁移对光感受器细胞的损伤。虽然本研究并未探明小胶质细胞是如何在早期糖尿病状态下迁移、活化、分化并对视细胞产生损伤作用的,但是本研究至少能说明小胶质细胞在糖尿病状态下分布和活化状态发生了变化,且对应了光感受器细胞的损伤,说明小胶质细胞参与了糖尿病视细胞的退行性改变,通过清除或者调节小胶质细胞的方法使得视细胞免受损害会为将来DR的早期防控提供一种新的途径。

