Livin基因沉默对视网膜母细胞瘤细胞侵袭性的影响及其机制研究
邓姿峰 罗瑜琳 汤文权
视网膜母细胞瘤是一种好发于视网膜的眼内恶性肿瘤,严重威胁着人类的生命健康。侵袭和转移是恶性肿瘤最明显的生物学特性,也是肿瘤难以治愈的根本原因[1]。抑制恶性肿瘤的侵袭和转移对延缓肿瘤进展和改善患者预后具有重要的意义。Livin是凋亡抑制蛋白家族成员之一,与恶性肿瘤细胞的增殖、侵袭及血管形成密切相关[2-3]。研究显示,Livin在视网膜母细胞瘤组织中的蛋白阳性表达率显著升高,与肿瘤分期、病理学分型及伴视神经浸润有关,可作为判断视网膜母细胞瘤恶性程度和预后的生物学指标[4]。然而,目前Livin在视网膜母细胞瘤细胞中的表达及其对细胞侵袭性的影响还不清楚。本研究以视网膜母细胞瘤细胞Y79为研究对象,观察沉默Livin表达对Y79细胞侵袭性及血管形成相关因子表达的影响,以期为视网膜母细胞瘤的治疗提供分子靶点。
1 材料与方法
1.1 主要实验试剂视网膜母细胞瘤细胞Y79和视网膜色素上皮细胞ARPE-19购自美国ATCC菌种库,胎牛血清(fetal bovine serum,FBS)购自美国Hycolne公司,RPMI 1640培养基、胰蛋白酶、LipofectamineTM2000试剂盒和二喹啉甲酸(bicinchoninicacid,BCA)蛋白检测试剂盒均购自北京索莱宝科技有限公司,Trizol试剂购自美国Invitrogen公司,逆转录试剂盒和PCR试剂盒购自美国Promega公司,PCR引物购自上海生工生物工程有限公司,Livin的小干扰RNA(si-Livin)和乱序无意义阴性序列(si-NC)购自上海吉玛制药有限公司,血管内皮生长因子(vascular endothelial growth factor,VEGF)、血管生成素-2(angiopoietin-2,Ang-2)、基质金属蛋白酶-2(matrix metalloproteinase 2,MMP-2)和基质金属蛋白酶-9(matrix metalloproteinase 9,MMP-9)抗体均购自北京中杉金桥生物试剂公司。
1.2 方法
1.2.1 细胞培养复苏ARPE-19和Y79细胞,均用含体积分数10%FBS的RPMI 1640培养基置于37 ℃、含体积分数5%CO2、湿度97%的培养箱中培养,每2~3 d更换一次新鲜的培养基。待细胞生长密度达80%时,吸弃培养基,加入适量预冷的磷酸盐缓冲液(PBS)清洗细胞。吸弃PBS,加入2.5 g·L-1胰蛋白酶溶液消化,按照13的比例进行传代培养。对数生长期的ARPE-19和Y79细胞,以每孔25×103个细胞接种于24孔板中,培养箱中培养24 h后,利用胰蛋白酶消化并收集细胞,采用实时荧光定量PCR(RT-qPCR)和蛋白印迹(Western blot)分别检测2种细胞中Livin的mRNA和蛋白表达水平。
1.2.2 RT-qPCR检测细胞中Livin的mRNA表达Trizol试剂提取细胞中总RNA,微量核算仪检测RNA的纯度和浓度。取RNA溶液,参照逆转录试剂盒将其逆转录为cDNA。以cDNA为模板,进行PCR扩增。扩增程序:95 ℃ 5 min,95 ℃ 10 s,60 ℃ 30 s,72 ℃ 30 s,共35个循环。Livin正向引物:5’-CCATCAGGACAAGG TGAGGT-3’,反向引物:5’-AGCTGGGAGTGAGTCTCCTG-3’;GAPDH正向引物:5’-TCGATA TCCACGGGAAAAAG-3’,反向引物:5’-TTGAGCATGTAGGCCTGTGA-3’。以GAPDH为内参,2-△△Ct法计算2种细胞内Livin的mRNA相对表达水平。
1.2.3 Western blot检测细胞中Livin蛋白表达RIPA细胞裂解液提取细胞中总蛋白,采用BCA试剂盒测定蛋白浓度。取适量蛋白溶液,加入1×上样缓冲液,混合均匀,100 ℃煮沸5 min。蛋白变性后,按每孔30 μg蛋白行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白。电泳后,湿转至PVDF膜上,于50 g·L-1脱脂奶粉中封闭1 h。分别加入Livin(1600稀释)和GAPDH(11000稀释)抗体,4 ℃孵育过夜。TBST洗膜后,加入山羊抗兔二抗(11000稀释)37 ℃孵育1 h。TBST洗膜后,加入ECL化学发光试剂,避光显影。凝胶成像系统曝光拍照,Image J软件分析蛋白条带灰度值。
1.2.4 细胞转染实验取对数生长期的Y79细胞,以每孔100×103个细胞接种于6孔板中,待细胞生长密度达60%时,更换不含FBS的RPMI 1640培养基。参照LipofectamineTM2000试剂盒操作说明书,分别将Livin的小干扰RNA(si-Livin组)和乱序无意义阴性序列(si-NC组)转染至Y79细胞。转染6 h后,更换含体积分数10%FBS的RPMI 1640培养基。继续培养至48 h后,胰蛋白酶消化收集细胞。同时设置对照组,不进行转染操作,细胞正常培养。RT-qPCR和Western blot分别检测各组细胞中Livin的mRNA和蛋白表达水平验证转染效果,方法同1.2.2和1.2.3。
1.2.5 CCK-8法检测细胞存活率对照组、si-NC组和si-Livin组细胞以2500个接种于96孔板中。每组设置3个复孔。培养箱中培养24 h后,每孔加入10 μL CCK-8试剂,继续孵育2 h后于酶标仪450 nm处测定吸光度(D)值,计算细胞存活率。细胞存活率(%)=D实验组/D对照组×100%。
1.2.6 Transwell检测细胞迁移和侵袭能力对照组、si-NC组和si-Livin组细胞用不含FBS的RPMI 1640培养基调整浓度为50×103个·mL-1。细胞迁移实验:Transwell上室加入100 μL细胞悬液,下室加入500 μL含体积分数10% FBS的RPMI 1640培养基。培养24 h后,吸弃培养基,取出小室。40 g·L-1多聚甲醛固定30 min、4 g·L-1结晶紫染色15 min,PBS冲洗后晾干,显微镜下观察,随机选取5个视野,计数穿膜细胞。细胞侵袭实验:Transwell上室铺设Matrigel基质胶,自然晾干后加入100 μL细胞悬液,后续操作同细胞迁移实验。
1.2.7 Western blot检测细胞中VEGF、Ang-2、MMP-2和MMP-9蛋白表达对照组、si-NC组和si-Livin组细胞以每孔25×103个细胞接种于24孔板中,培养箱中培养24 h后,胰蛋白酶消化收集细胞。Western blot检测各组细胞中VEGF、Ang-2、MMP-2和MMP-9的蛋白表达水平,方法同1.2.3,其中VEGF抗体稀释度11000,Ang-2抗体稀释度11000,MMP-2抗体稀释度1800,MMP-9抗体稀释度1800。

2 结果
2.1 Livin在视网膜母细胞瘤细胞Y79中的表达与ARPE-19细胞比较,Y79细胞中Livin的mRNA和蛋白表达水平均显著升高(均为P<0.05)(见图1和表1)。

图1 ARPE-19细胞和Y79细胞中Livin蛋白表达
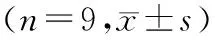
表1 ARPE-19细胞和Y79细胞中Livin的mRNA和蛋白相对表达水平
2.2 Livin基因沉默效果验证与对照组或si-NC组比较,si-Livin组Y79细胞中Livin的mRNA和蛋白表达水平均显著降低(均为P<0.05)。si-NC组与对照组Y79细胞中Livin的mRNA和蛋白表达水平比较,差异均无统计学意义(均为P>0.05)(见图2和表2)。
2.3 Livin基因沉默对Y79细胞活性的影响对照组、si-NC组和si-Livin组Y79细胞存活率分别为(99.87±1.36)%、(98.43±1.22)%、(46.27±1.73)%。与对照组或si-NC组比较,si-Livin组Y79细胞存活率均显著降低(均为P<0.05)。si-NC组与对照组Y79细胞存活率比较,差异无统计学意义(P>0.05)。

图2 Livin小干扰RNA转染Y79细胞后Livin蛋白表达
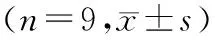
表2 Livin小干扰RNA转染Y79细胞后Livin的mRNA和蛋白表达水平
2.4 Livin基因沉默对Y79细胞迁移和侵袭能力的影响与对照组或si-NC组比较,si-Livin组Y79细胞迁移和侵袭细胞数均显著降低(均为P<0.05)。si-NC组与对照组Y79细胞迁移和侵袭细胞数比较,差异均无统计学意义(P>0.05)(见图3和表3)。

图3 Livin基因沉默后不同组别Y79细胞的迁移和侵袭(×200)
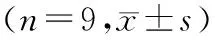
表3 Livin基因沉默对Y79细胞迁移和侵袭的影响
2.5 Livin基因沉默对Y79细胞中血管形成相关因子表达的影响与对照组或si-NC组比较,si-Livin组Y79细胞中VEGF、Ang-2、MMP-2和MMP-9的蛋白表达水平均显著降低(均为P<0.05)。si-NC组与对照组Y79细胞中VEGF、Ang-2、MMP-2和MMP-9的蛋白表达水平比较,差异均无统计学意义(均为P>0.05)(见表4和图4)。

图4 Livin基因沉默后不同组别Y79细胞中VEGF、Ang-2、MMP-2和MMP-9的蛋白表达
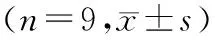
表4 Livin基因沉默后Y79细胞中VEGF、Ang-2、MMP-2和MMP-9蛋白表达
3 讨论
视网膜母细胞瘤是一种原发性眼内恶性肿瘤,其典型临床表现为白瞳症和斜视。视网膜母细胞瘤约占儿童癌症的3%,易发生颅内及远处转移,严重威胁儿童生命健康[5]。目前,视网膜母细胞瘤的治疗方法虽多,但是死亡率和复发率仍然较高,预后较差[6]。基因治疗的出现为视网膜母细胞瘤的治疗提供了新的途径。
Livin基因是一种凋亡蛋白抑制因子,定位于人染色体20q13.3,参与多种肿瘤的发生发展。研究显示,Livin在结肠癌细胞中表达升高,靶向抑制其表达可降低结肠癌细胞的迁移和侵袭能力及上皮-间质转化过程[7];放射抵抗的鼻咽癌细胞中Livin表达升高,抑制其表达可增强鼻咽癌细胞对放射线敏感性[8];miR-512-3p靶向下调Livin表达抑制乳腺癌增殖和迁移,并增强细胞对吉西他滨、多西他赛等化疗药物的敏感性[9]。Livin在视网膜母细胞瘤患者血清中呈高表达,与癌组织分化程度和临床分期密切相关,诊断视网膜母细胞瘤的敏感度和特异度分别为80.0%和70.0%,对该疾病的诊断具有一定价值[10]。目前,Livin对视网膜母细胞瘤细胞迁移和侵袭的影响还未知。本研究以视网膜色素上皮细胞ARPE-19为对照,首先检测了视网膜母细胞瘤细胞Y79中Livin的mRNA和蛋白表达,结果显示,与ARPE-19细胞相比,Y79细胞中Livin的mRNA和蛋白表达水平均显著升高,提示Livin可能参与视网膜母细胞瘤的发生发展。通过转染Livin小干扰RNA沉默Y79细胞中Livin表达后,细胞存活率及迁移和侵袭细胞数显著降低,说明沉默Livin表达可有效降低Y79细胞的侵袭性,提示Livin可能是视网膜母细胞瘤治疗的分子靶点。
肿瘤新生血管生成是肿瘤生长和发生侵袭、转移的基础[11]。VEGF是刺激新生血管生成的细胞因子,可通过促进受体介导的毛细血管内皮细胞增殖,诱导毛细血管管腔形成,还可通过自分泌及旁分泌途径引起血管通透性增加,在肿瘤的迁移和侵袭中发挥重要作用。VEGF还可通过激活ERK信号通路上调MMP-2和MMP-9蛋白表达,促进细胞的增殖和侵袭[12]。MMPs可促降解细胞外基质和基底膜,促进新生血管的形成,在肿瘤细胞的迁移和侵袭过程中发挥重要作用[13]。Ang-2是血管生成素家族成员,目前主要认为其通过与Tie-2受体结合拮抗Ang-1 的功能,促进肿瘤血管新生[14]。也有学者认为Ang-2对血管形成的促进作用是通过上调MMP-2表达实现的。既往研究表明,抑制肿瘤细胞中VEGF、MMP-2和MMP-9等因子的表达可抑制肿瘤细胞的侵袭和迁移[15-16]。Lin等[17]研究显示,沉默Livin基因通过阻断肺癌细胞VEGF和MMPs途径抑制细胞生长和侵袭。本研究结果显示,Livin基因沉默后Y79细胞中VEGF、Ang-2、MMP-2和MMP-9蛋白表达水平均显著降低,提示Livin通过调节血管形成相关因子的表达抑制肿瘤新生血管的形成,进而降低视网膜母细胞瘤的侵袭。
综上所述,Livin在视网膜母细胞瘤细胞Y79中呈高表达,沉默Livin表达可降低Y79细胞的侵袭性,其作用机制可能与下调VEGF、Ang-2、MMP-2和MMP-9等血管形成相关因子的表达有关。

