宽鳍鱲胰岛素样生长因子-Ⅰ的克隆及繁殖期前后表达分析
沈铭浩 朱迦玥 吴 涛 任天惠 张哲盼 熊 黎 刘芳玲 郑善坚
(1. 浙江师范大学生化学院, 金华 321004; 2. 浙江师范大学野生动物生物技术与保护利用浙江省重点实验室, 金华 321004)
胰岛素样生长因子-Ⅰ(Insulin like growth factor-Ⅰ, IGF-Ⅰ)是一种功能近似胰岛素类似物的单链多肽, 其mRNA检测结果表明其在鱼类各组织中均有表达, 其中肝脏内的表达尤为显著。自虹鳟(Oncorhynchus mykiss)鳃软骨组织的体外研究发现IGF-Ⅰ基因[1], 现阶段研究发现IGF-Ⅰ基因具有调控细胞代谢、促进细胞增殖、保护肠道黏膜屏障、促进动物生长发育等多种生物学功能[2]。鱼类营养状况可影响IGF-Ⅰ基因表达水平, 从而影响其氮代谢[3], 尼罗罗非鱼(Oreochromis niloticus)的IGF-Ⅰ基因表达与其生长速率呈现明显正相关性[4], 外源IGF-Ⅰ蛋白对半滑舌鳎(Cynoglossus semilaevis)幼鱼的生长有积极的促进作用[5]。近年来, 鱼类IGF-Ⅰ基因的生理功能, 表达调控越来越受关注。
宽鳍鱲(Zacco platypus)为南方山区一种溪流性小型鱼类, 其肉质鲜美, 营养丰富, 深受大家喜爱,形成了一定养殖规模[6]。在养殖过程中发现其在生长速度上存在明显的雌雄差异, 雄性成体普遍大于同批孵化的雌性个体。但目前仅局限于养殖技术和遗传多样性研究[7,8]。本研究首次克隆了宽鳍鱲IGF-Ⅰ基因, 利用荧光原位杂交技术(Fluorescencein situhybridization, FISH)对宽鳍鱲IGF-Ⅰ基因的表达模式进行了分析, 利用实时荧光定量PCR技术(Quantitative Real-time PCR, RT-qPCR)探究不同性别宽鳍鱲各时期不同组织中IGF-Ⅰ基因表达水平相对差异, 探究宽鳍鱲IGF-Ⅰ基因在其生长发育过程中对其性二态的现象所产生的影响。提高宽鳍鱲繁育效率有着巨大的经济效益, 分子标记技术是提高遗传育种效率的有效辅助手段, 本研究旨在为宽鳍鱲的育种和人工繁育提供一定理论依据。
1 材料与方法
1.1 试验材料
试验材料来自浙江省丽水市锋鱼养殖场分别取幼鱼期5月龄、7月龄和成鱼期12月龄、18月龄的雌雄鱼各5尾, 规格在2—30 g。记录体质量、体长等指标后, 取脑、脾、肾、性腺、肝和心脏组织置于1.5 mL冻存管中经液氮速冻后–80℃保存。剪取少量宽鳍鱲尾鳍组织, –20℃无水乙醇保存。
主要试剂: RNA提取试剂(TaKaRa)、TA克隆载体pMD19-T、SMARTTMRACE试剂盒购于宝日医生物技术有限公司, DNA提取试剂购自上海生工生物技术有限公司; PCR反应试剂、UltraSYBR Mixture、去基因组cDNA合成试剂盒均购于北京康为世纪生物科技有限公司, PCR引物的合成及测序委托上海生工生物技术有限公司完成。
1.2 宽鳍鱲IGF-Ⅰ基因的克隆
采用传统酚氯仿抽提法提取宽鳍鱲肝脏总RNA, 参照反转录试剂盒说明书进行反转录, 获得cDNA一链。Blast比对GenBank中与宽鳍鱲同属鲤科的草鱼(Ctenopharyngodon idella)和鲤(Cyprinus carpio)等近缘物种IGF-Ⅰ基因cDNA序列, 根据其保守区域设计引物IGF-Ⅰ-C, 以宽鳍鱲cDNA为模板进行同源片段的扩增。25 μL反应体系; 94℃5min; 94℃ 30s、55℃ 30s、72℃ 2min, 30个循环;72℃延伸5min。得到单一条带后回收PCR产物直接进行正反向测序。根据测序结果Primer Premier 5设计RACE引物, 以宽鳍鱲cDNA为模板, 利用引物IGF-Ⅰ-A-F1/R1, 进行高保真PCR扩增, 电泳后将得到的单一条带进行切胶回收, 以pMD19-T为载体进行TA克隆, 选取阳性转化子送生工生物工程(上海)股份有限公司进行测序。DNAMAN 6.0软件拼接得到宽鳍鱲IGF-Ⅰ基因的cDNA全长, 利用ORFfinder查找完整的开放阅读框(ORF), 根据拼接的序列设计包含起始密码子的上游引物IGF-Ⅰ-ORF-F和包含终止密码子的下游引物IGF-Ⅰ-ORFR, 以宽鳍鱲cDNA为模板扩增基因的完整开放阅读框进行验证。
根据测序所得宽鳍鱲IGF-Ⅰ基因的cDNA序列设计8对特异性引物(表 1), 克隆宽鳍鱲IGF-Ⅰ基因全序列, PCR反应体系为25 μL体系, 最佳退火温度通过温度梯度PCR得出, 延伸时间根据产物长度变化, 每1000 pb延伸1min。PCR产物送生工生物工程(上海)股份有限公司进行测序。
1.3 宽鳍鱲IGF-Ⅰ基因的生物学分析
DNASTAR 7.0进行序列拼接获得全长; DNA-MAN 6.0软件翻译碱基序列得到氨基酸序列; E×PASy在线protparam程序分析氨基酸的有关物理参数;bioinf程序结合predictprotein程序分析蛋白质二级结构; MEGA 6.0进行系统进化分析, 分别用ClustalX和MEGA 6.0进行多重序列比对和系统进化分析,采取邻位相接法, Boot-strap重复1000次计算各分枝的置信度, 构建宽鳍鱲与鳙(Aristichthys nobilis)、鳡(Elopichthys bambusa)等17种鱼类的NJ系统进化树。

表 1 IGF-Ⅰ基因引物序列Tab. 1 IGF-Ⅰ gene primer sequence
1.4 RT-qPCR分析
用RNAiso Plus(TaKaRa)分别提取宽鳍鱲肝、脾、肾、脑、心脏和性腺组织RNA, 用核酸定量仪和琼脂糖凝胶电泳检测RNA的质量和完整性。HiFiScript gDNA Removal cDNA Synthesis Kit试剂反转录合成cDNA。根据宽鳍鱲IGF-Ⅰ基因的开放阅读框cDNA序列, Primer Premier 5设计合成正反向特异荧光定量引物IGF-Ⅰ-Q, 并且以内参基因EF1α作为对照。
RT-qPCR分析用2×UltraSYBR Mixture(High ROX)进行。每样做3个重复, 采用2–ΔΔCt方法分析所得数据, 计算IGF-Ⅰ基因在各个组织中的相对表达水平。用SPSS 21软件进行SNK法进行多重比较检验, 以及基因相对表达水平与雌雄宽鳍鱲成鱼体长的偏相关关系。
1.5 组织切片HE染色
根据RT-qPCR结果, 取雌雄宽鳍鱲性腺与肝脏组织, 4%甲醛固定组织, 常规梯度乙醇脱水, 环保型生物透明剂透明, 石蜡包埋, 制作连续切片, 切片厚6—8 μm, HE染色。切片标本置OLYMPUS BX51显微镜(配冷光源数码相机OLYMPUS DPT0)下观察、拍照。
1.6 荧光原位杂交
取HE染色相同部位的连续切片, 二甲苯溶液脱蜡3次, 乙醇按梯度浸洗10次; 加入PBS, 切片置于空气中。试管中加入40 mL 2×SSC预热, 加K酶消化溶液后37℃水浴20min, 2×SSC漂洗3次;乙醇按梯度浸洗10次。载玻片上滴加70 μL杂交液,探针浓度10 μm, 序列为: 5′-CTCTCCCGTTCGCTA AATCTCACTTGGATTGATAGAACATGACCTA CATCCTGC-DIG-3′; 封片, 杂交仪上95℃反应5min, 37℃反应14h。撕封片胶, 按5×SSC溶液梯度洗片, 加1×PBS后甩干, 滴加封闭液后吸干, 用罗丹明抗—地高辛抗体孵育1h; 1×PBS洗3次; 滴加FITC-TSA试剂, 避光室温反应5min。后TBST洗3次×10min, PBS洗1次5min; 利用DAPI染液进行细胞核复染色, 避光孵育8min, 冲洗后滴加抗荧光淬灭封片剂封片。切片于荧光显微镜下观察并采集图像。
2 结果
2.1 IGF-Ⅰ基因的克隆、测序及鉴定
测序拼接获得全序列13707 bp, 其碱基组成为:A+T占61.13%, C+G占38.87%。与GenBank中鲤和草鱼IGF-Ⅰ基因的DNA序列进行比对分析, 相似度分别为83%和92%, 因此可认为所获得的序列为宽鳍鱲IGF-Ⅰ基因序列。将该序列提交GenBank数据库, 获得登录号MT364420。宽鳍鱲IGF-Ⅰ基因包含4个内含子、5个外显子。5个外显子长度分别为222、160、182、36和829 bp; mRNA序列长度为2036 bp, 其中ORF区长度486 bp, 5′-非翻译区250 bp,3′-非翻译区1300 bp。宽鳍鱲IGF-Ⅰ蛋白由161个氨基酸组成。
E×PASy在线protparam程序分析宽鳍鱲IGF-Ⅰ蛋白质相对分子质量为17.93 kD, 理论等电点(Isoelectric point, pI)为9.20, 分子式: C766H1217N237O229S16。其中, 丝氨酸(Ser)含量最高, 为9.9%。带负电荷氨基酸残基(Asp+Glu)12个, 带正电荷氨基酸残基(Arg+Lys) 22个。脂肪族氨基酸指数为57.52。经过蛋白质序列分析, 宽鳍鱲IGF-Ⅰ基因氨基酸预测无跨膜结构。
宽鳍鱲IGF-Ⅰ前体肽由信号肽、成熟肽、E肽三部分组成。其中信号肽44个氨基酸, 成熟肽70个氨基酸, E肽47个氨基酸; 成熟肽由B、C、A和D四个区域组成, 氨基酸个数分别为29、12、21和8。IGF-Ⅰ蛋白的各个结构域之间的相似性有较大的差异, 成熟肽中B结构域和A结构域的保守性最高,A结构域完全一致。宽鳍鱲成熟肽存在CysB6、CysB18、CysA6、CysA7、CysA11和CysA20六个半胱氨酸残基。其中B结构域与A结构域之间形成2个二硫键, 而A结构域的内部形成1个二硫键。在宽鳍鱲B区域也含有保守的IGF-Ⅰ受体识别序列(PheB23-TyrB24-PheB25残基)。C结构域和D结构域的保守性相对较差, 但C结构域在列举的5种鲤科鱼类(表 2)中完全一致。E肽的长度表明宽鳍鱲IGF-Ⅰ属Ea-2型。
2.2 IGF-Ⅰ基因外显子及其编码氨基酸序列的结构比较
Clustal X与Blast结果显示, 宽鳍鱲IGF-Ⅰ氨基酸序列与草鱼相似度为98%, 与牙鲆(Paralichthys olivaceus)同源性为67.5%, 与弹涂鱼(Boleophthalmus pectinirostris)同源性为64.17%, 与尖吻鲈(Lates calcarifer)同源性为66.49%, 与鲤科其他鱼类同源性在90%—98%。
将宽鳍鱲和草鱼两种鲤科鱼类的IGF-Ⅰ基因和另外3科的3种鱼类进行比较, 宽鳍鱲和草鱼IGF-Ⅰ基因编码区序列长度均为486 bp, 且4个外显子中编码氨基酸的碱基长度完全相同, 编码蛋白由161个氨基酸组成。鲤科和另外3科的IGF-Ⅰ基因差别主要集中在第三外显子, 其中弹涂鱼科、牙鲆科和尖吻鲈科鱼类的第三外显子比鲤科鱼类多69—75个碱基序列, 导致编码的氨基酸也有所增加。NJ树显示宽鳍鱲与鲤科其他鱼类聚为一支, 与鲶形目鮰科亲缘关系较近, 与鲈形目尖吻鲈科亲缘关系最远(图 1)。
2.3 宽鳍鱲IGF-Ⅰ基因表达分析
RT-qPCR检测表明,IGF-Ⅰ基因在宽鳍鱲肝、性腺、心、脾、脑和肾组织中均有表达, 肝中的表达水平显著高于其他组织(P<0.05), 其次为脾、精巢、卵巢、肾、心, 脑的表达水平最低。肝和脾组织IGF-Ⅰ mRNA在宽鳍鱲整个发育时期始终维持较高表达水平(图 2)。处于繁殖期的12月龄成鱼性腺中IGF-Ⅰ mRNA表达量显著高于5月龄和7月龄幼鱼和18月龄的成鱼, 且精巢中IGF-Ⅰ mRNA的表达水平显著高于卵巢(P<0.05, 图 3A)。繁殖期后雌雄性腺中IGF-Ⅰ mRNA表达水平快速回落至低水平。而肝组织IGF-Ⅰ mRNA表达水平基本不受繁殖期影响(图 3B)。
宽鳍鱲的个体生长存在雌雄差异, 从幼鱼期[5月龄, 雌鱼(52.144±0.58) mm, (2.51±0.34) g, 雄鱼(68.281±0.82) mm, (5.55±0.45) g]到成鱼期[12—18月龄, 雌鱼(131.352±0.54) mm, (13.76±0.42) g,雄鱼(150.235±0.61) mm, (17.41±0.51) g]时, 雄鱼个体均显著大于雌鱼(P<0.05)。这一现象与宽鳍鱲IGF-Ⅰ mRNA在雄鱼中表达水平显著高于雌鱼呈现关联性。IGF-Ⅰ mRNA表达水平与雌雄宽鳍鱲体长的偏相关系数为0.946(P<0.001)。
2.4 宽鳍鱲IGF-Ⅰ基因组织定位
荧光原位杂交显示, 宽鳍鱲肝脏IGF-Ⅰ基因融合的绿色荧光主要分布于细胞质中, 与细胞核的蓝色荧光位置分离, 这表明宽鳍鱲IGF-Ⅰ基因表达为胞浆阳性, 呈全胞质性分布, 少数为核阳性, 即蓝色荧光处基本无绿色荧光信号重叠(图 4)。
HE染色显示处于繁殖期的性成熟宽鳍鱲精巢,各小叶腔中充满精子(SP), 精核呈蓝紫色, 直径约1—2 μm。繁殖期后的性成熟宽鳍鱲精巢处于Ⅵ期性腺, 精巢萎缩, 小叶腔内精子已基本排空(图 5A、5C)。繁殖期的卵巢中主要由第Ⅴ时相卵母细胞组成, 但仍具有一定数量的第Ⅳ时相卵母细胞(图 5E),第Ⅴ时相卵母细胞游离于卵巢腔中, 卵膜外的二层卵泡膜(FT)脱落。繁殖期后的卵巢呈萎瘪的囊状,表面血管充血并能看见未产出的卵粒, 其中有的卵粒的卵黄已经被吸收。切片显示, 卵巢中主要由第Ⅱ、Ⅲ时相卵母细胞和空滤泡(EF)组成, 少量未排出卵正被吸收、退化(图 5G)。

表 2 宽鳍鱲与其他鱼类IGF-Ⅰ基因外显子和内含子的比较Tab. 2 The comparison of the exon and intron of IGF-Ⅰ gene among Zacco platypus and other fish species
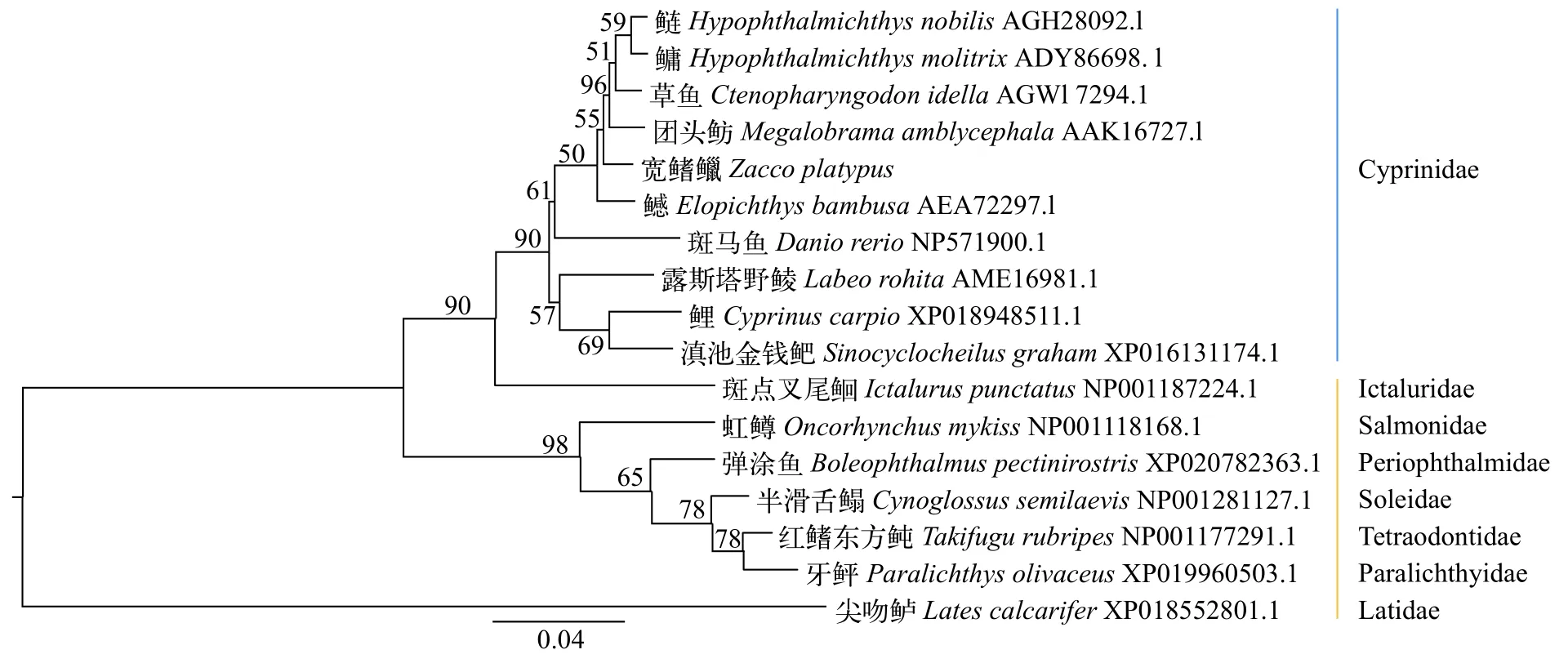
图 1 基于IGF-Ⅰ氨基酸序列构建的宽鳍鱲及其他鱼类系统发育树Fig. 1 Phylogenetic tree of Zacco platypus and other fish based on IGF-Ⅰ amino acid sequence
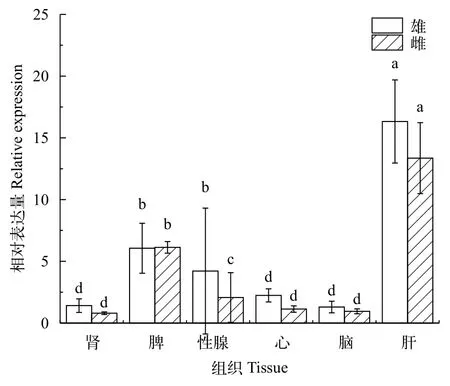
图 2 雌雄宽鳍鱲全时期IGF-Ⅰ基因相对表达水平比较Fig. 2 Relative expression of IGF-Ⅰ gene in male and female Zacco platypus
宽鳍鱲精巢组织中IGF-Ⅰ基因表达主要集中在精母细胞(SC), 间质细胞和精子中没有检测到阳性信号, 卵巢组织中IGF-Ⅰ基因表达主要集中在卵泡膜和卵泡液(FF)中(图 5E、5F), 繁殖期后精巢和卵巢IGF-Ⅰ基因阳性信号减弱(图 5B、5D), 肝脏胞浆中IGF-Ⅰ基因表达阳性信号比性腺更为强烈(图 4和图 5), 与RT-qPCR的结果相符。
3 讨论
3.1 宽鳍鱲IGF-Ⅰ基因序列分析
本研究克隆得到的宽鳍鱲IGF-Ⅰ基因全序列为13707 bp, 包含4个外显子, 5个内含子, 其编码蛋白由161个氨基酸组成, 与鲤科鱼类草鱼[9]、翘嘴鲌(Culter alburnus)[10]等同源性在90%—98%。
3.2 宽鳍鱲IGF-Ⅰ基因在繁殖期前后的表达
已有不少学者发现IGF-Ⅰ在肝脏组织的表达水平最高, 本研究的结果也佐证了肝脏是鱼类IGF-Ⅰ蛋白的主要分泌部位[11—16]。在其他鱼类的IGF-Ⅰ基因研究中,IGF-Ⅰ在性腺中表达水平较其他组织均比较低[10,11]。本研究发现12月龄恰好经历性成熟[17]的宽鳍鱲性腺中IGF-Ⅰ表达水平远远高于其他月龄。为了探究影响IGF-Ⅰ表达变化的因素,本研究分别在繁殖前期(5月龄和7月龄)、繁殖期(12月龄)、繁殖后(18月龄)不同组织中IGF-Ⅰ表达水平动态监测。结果显示处于繁殖期的性成熟宽鳍鱲性腺中IGF-Ⅰ表达水平显著上升, 繁殖期过后回落至最低值。肝组织IGF-Ⅰ的表达水平随着月龄增长的波动变化不大, 总体处于较高的水平。
荧光原位杂交和HE切片显示, 宽鳍鱲肝组织中IGF-Ⅰ基因杂交信号显示多为胞浆阳性, 呈全胞质性分布, 少数为核阳性。在精巢组织中, 精母细胞存在IGF-Ⅰ基因信号, 卵巢组织中IGF-Ⅰ基因表达主要集中在卵泡膜和卵泡液中。处于繁殖期的宽鳍鱲性腺处于Ⅴ期, 繁殖期后的性腺有明显的萎缩现象, 为Ⅵ期。有学者发现鱼类IGF-Ⅰ基因能调节卵母细胞的增殖活性及其分化[13]并促进精子发生[18—20], 调节类固醇的新陈代谢, 产生或活化生殖相关激素[21,22]。
3.3 鱼类生长激素(GH)与性激素的协同作用
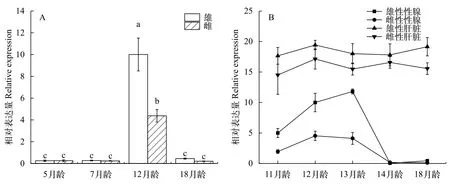
图 3 IGF-Ⅰ基因相对表达量Fig. 3 Relative expression level of IGF-Ⅰ gene
IGF-Ⅰ主要来源于肝脏, 其合成依赖于垂体GH的分泌和营养状况。GH是脑垂体前叶分泌的单一肽链蛋白质激素, 具有广泛的生理功能, 能影响几乎所有类型的组织和细胞。GH的大部分生物效应都是由肝脏、肾脏等组织依赖GH产生的IGF-Ⅰ所介导的。此外, 许多肝外组织IGF-Ⅰ的合成也受GH和其他组织特异性激素及营养因子的影响。GH、IGF-Ⅰ等基因组成的GH/IGF轴在鱼类个体生长中起着关键的作用[23]。
有研究表明IGF-Ⅰ基因表达水平与GH和性激素浓度之间存在高度相关性[24]。马苏大马哈鱼(Chum salmon)[25]在洄游时血液中的IGF-Ⅰ的含量呈上升趋势, 此时它同脑垂体性腺机制协同作用,促进了性腺的成熟, 从而促使其洄游到淡水中产卵,随后, 血液中的IGF-Ⅰ含量呈现下降趋势直到下一次洄游周期的开始。条纹鲈(Morone chrysops×Morone saxatile)[26]的性腺在每年的3月成熟, 同时血液中雌性激素和雄性激素达到一年中最高水平,GH和IGF-Ⅰ具有同样的变化。
3.4 宽鳍鱲性二态现象
雄性宽鳍鱲由于在繁殖期具有鲜艳的体色而被作为一种观赏鱼。性成熟的雄性个体臀鳍鳍条尤为发达; 尾鳍叉形, 下叶稍长; 体色鲜艳, 背部灰黑, 腹部银白, 体侧有10—13条蓝色的垂直条纹。处于繁殖期的雄性个体吻部、鳃盖骨、臀鳍鳍条上会出现锥状珠星[27]。因此, 宽鳍鱲繁殖期性腺组织中IGF-Ⅰ基因增量表达, 可能有调节生殖相关激素分泌和促进雄性体色和珠星等第二性征显现的作用, 以达到完成生殖行为, 适应种群繁衍的需要。
结合所测量形态学数据, 我们推测雄性宽鳍鱲性腺中IGF-Ⅰ在其发育过程中的高表达是雄性成体大于雌性成体的原因之一。同属溪流性鱼类的马口鱼也存在雄性成体大于雌性成体的性二态现象[28], 造成这种现象的原因可能是溪流性鱼类所属栖息环境的特殊性。雄大于雌有利于雄性在湍急的水流中追逐配偶, 提高受精和繁殖的成功率关,较大的雄性鱼存在明显的争斗优势, 因而获得较多的繁殖后代的机会及提供给后代较好的保护[29—31]。
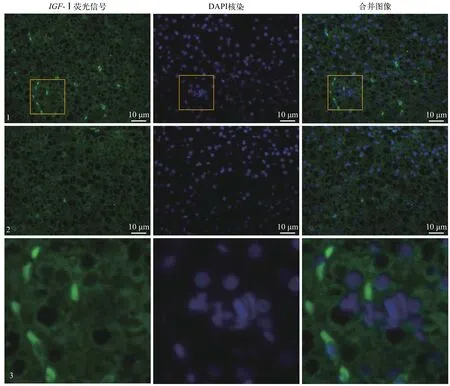
图 4 宽鳍鱲肝脏IGF-Ⅰ基因荧光原位杂交及DAPI核染色Fig. 4 Distribution of Zacco platypus IGF-Ⅰ gene in liver tissue and nuclear DAPI stain

图 5 宽鳍鱲性腺繁殖期前后对比Fig. 5 Comparison of Zacco platypus gonad before and after breeding
4 结论
综上所述, 本研究克隆了宽鳍鱲IGF-Ⅰ基因全序列, 发现其在肝脏中高表达, 同时发现繁殖期性腺中IGF-Ⅰ基因的高表达现象。荧光原位杂交技术定位显示IGF-Ⅰ基因在肝组织中呈全胞质性分布, 在性腺组织的精母细胞、卵泡膜及卵泡液中阳性表达。宽鳍鱲IGF-Ⅰ基因表达模式具有性别差异性, 推测精巢中IGF-Ⅰ在繁殖期的高表达是宽鳍鱲雄性成体大于雌性成体的原因之一, 为宽鳍鱲的性二态和人工繁育的研究提供参考资料。

