龙须菜在不同盐度胁迫下的琼胶积累及相关生理生化变化的研究
陈 月 蔡西栗 孙 雪 张小倩 徐年军
(1. 宁波大学应用海洋生物技术教育部重点实验室, 宁波 315211; 2. 宁波大学海洋学院, 浙江省海洋生物工程重点实验室,宁波 315211; 3. 浙江省平阳县海洋与渔业局, 平阳 325400)
琼胶是一种胶状的半乳聚糖生物大分子, 是由D型半乳糖与3,6-内醚-L-半乳糖以β-1,3和α-1,4糖苷键重复交联而成的中性多聚糖, 作为红藻细胞壁的组成成分, 与陆地植物的半纤维素的生物功能相似, 但其更强的柔韧性给予了大型海藻抵抗强烈波浪和水流的能力[1]。在红藻中琼胶还具有抵抗病原菌侵扰, 保持细胞内离子平衡, 提高海藻抵抗极端的盐度、pH、温度逆境等功能[2,3]。
琼胶生物合成开始于高尔基体中的半乳糖糖基化, 随后在转移到细胞壁之前进行早期的硫酸化,关于半乳糖转运体的研究还十分缺乏, 只知道它在高尔基体膜上, 之后琼胶大分子中C-6位硫酸化的L型半乳糖单位会脱水形成3,6-内醚-L-半乳糖, 3,6-内醚-L-半乳糖含量的多少决定了琼胶的凝胶性能,而半乳糖的硫化并非只发生在C-6位上, 在L-半乳糖的C-2和C-3位与D-半乳糖的C-2和C-4位也发现了硫化, 这些半乳糖硫化可能都需要特异的磺基转移酶与硫酸化酶[3]。
龙须菜(Gracilariopsis lemaneiformis)是红藻门(Rhodophyta)、江蓠科 (Gracilariaceae)、龙须菜属(Gracilariopsis) 的大型产琼胶海藻, 在中国沿海地区大面积养殖, 由于琼胶市场需求量的上升, 中国龙须菜产量从2004年的8.88×107kg, 增加到了2017的30.86×107kg, 并且仍在不断增加[4,5]。由于其生长速度快, 产量高, 琼胶品质好, 是生产琼胶的主要原料[6]。龙须菜的琼胶合成代谢通路一直都是研究的热点, 克隆出龙须菜中UDP-葡萄糖焦磷酸化酶基因、半乳糖-1-磷酸尿苷酰转移酶基因、葡萄糖磷酸变位酶基因, 并发现这些基因的表达对琼胶含量有一定影响[7—9], α-葡萄糖苷酶可以催化降解红藻淀粉生成葡萄糖, 也可能促进龙须菜琼胶含量的积累[10]。
研究发现部分产胶红藻在生长盐度变化时琼胶含量会出现上升, 推测其在抵抗细胞外部渗透压变化的过程中会合成更多的琼胶, 为细胞提供更强的支撑力, 其中合成琼胶所用半乳糖前体的来源可能是红藻糖苷和红藻淀粉的降解, 而促进红藻糖苷降解的正是α -半乳糖苷酶(GLA)[10—12]。与其他江蓠品种相比, 龙须菜对高温的耐受性更强, 但对盐度的耐受范围更窄, 在盐度25环境下生长状态最好[13]。不同盐度培养的龙须菜会出现琼胶含量的显著差异, 在低盐条件下培养2周, 琼胶含量显著升高[8]。本实验研究了不同盐度下龙须菜的生长速率、暗呼吸与光合放氧速率、琼胶含量和代表性糖类的相对含量以及琼胶合成过程中gla、gat、gst和gas基因的表达量变化, 揭示了不同盐度条件导致琼胶含量变化的规律, 旨在发现盐度逆境胁迫对龙须菜琼胶合成的影响, 探究其在琼胶合成通路中的作用。
1 材料与方法
1.1 实验材料处理
实验材料龙须菜为981品系, 采自福建霞浦海藻养殖场 (26°71′N, 119°99′E), 养殖海域内海水盐度接近25, 用消毒海水清洗, 刷除杂藻与泥沙, 截取健康侧枝于实验室恒温光照培养箱中驯化培养1个月。实验设置3个盐度, 分别为15(低盐)、25(正常海水盐度)、35(高盐), 培养温度为23℃, 光强40 μmol/(m2·s), 光暗周期为12L﹕12D, Provasoli培养基每3—4d更换1次, 分别在第3和第15天取样测定酶活和基因表达, 琼胶含量与糖含量测定只在第15天取样。
1.2 相对生长速率 (RGR) 的测定
通过测定龙须菜在培养周期内的藻体鲜重变化, 计算龙须菜的相对生长速率(Relative growth rate,RGR), 测定时用吸水纸包裹藻体4000 r/min离心30s, 去除藻体表面水分后称重。
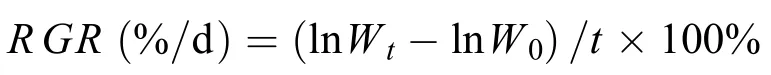
式中,W0为实验开始时藻体的鲜重(g),Wt为实验结束时藻体的鲜重(g),t为实验天数(d)。
1.3 暗呼吸和光合放氧速率的测定
采用液相氧电极 (Hansatech, 英国)测定龙须菜的暗呼吸与光合放氧速率, 先使用耗氧剂连二亚硫酸钠对培养液氧含量曲线进行调零校准, 然后称取0.01 g龙须菜放入2 mL的氧饱和新鲜培养液中, 严格控制温度在23℃, 遮罩避光测定暗呼吸速率, 然后在培养光强下测定光合放氧速率。
1.4 α -半乳糖苷酶酶活性的测定
α -半乳糖苷酶(GLA)活力的测定参照Ekman等的方法并加以修改[12], 利用GLA能将对硝基酚-α-吡喃半乳糖降解成对硝基酚的特性, 通过在405 nm比色测定对硝基苯酚的生成量, 可以计算反应液中GLA的活力。
1.5 琼胶的提取与含量测定
龙须菜中琼胶的提取方法参照薛志欣等[14], 具体操作略有改动。先取一定量的藻体, 用清水冲洗干净藻体表面的盐分后在65℃烘干至恒重, 称量干重, 并按每100 mg干重藻体加入4 mL 4% NaOH溶液, 在85℃ 水浴中处理2h, 用2层300目筛绢网过滤并洗涤藻体至中性, 然后每100 mg干重藻体添加6 mL蒸馏水, 于120—125℃的高压锅中加热煮沸提取琼胶2h。用8层300目筛绢网挤压过滤并收集滤液, 待滤液在室温下冷却并凝固后放入–20℃冷冻过夜, 常温解冻后用蒸馏水浸泡冲洗去除杂质, 最后冷冻干燥获得琼胶干重。计算琼胶含量(%)。
1.6 目的基因的克隆及定量
目的基因片段的获得根据龙须菜基因组组装结果[15]设计引物(表 1), PCR扩增得到编码993个氨基酸的gla基因(MF988355)、编码706个氨基酸的gat基因(MF988358)、编码352个氨基酸的gst基因 (MF988360) 及编码627个氨基酸的gas基因(MF988361.1)。
总RNA的提取及反转录称取新鲜龙须菜藻体100 mg, 按照OMEGA公司的Plant RNA Kit 试剂盒说明书方法提取总RNA, 经过电泳检测, Nanodrop 测定纯度和浓度后, 使用 TaKaRa去基因组DNA反转录试剂盒得到各个样本相同浓度的 cDNA模板, –20℃冷冻保存。
目的基因的相对定量与表达分析根据目的基因的序列信息使用primer5.0设计定量专用的特异引物, 首先进行预实验对引物的熔解曲线进行分析, 确定引物的特异性, 选用β-actin基因作为内参进行上样误差校正和标准化, 内参定量PCR引物参考朱招波等[16]并进行验证。使用Eppendorf 实时荧光定量PCR仪, 以反转录合成的cDNA为模板进行实时荧光定量PCR, 反应采用 20 μL体系: SYBR Green I Master (Roche) 10 μL, 正向和反向引物(10 μmol/L)各 0. 4 μL, cDNA模板2 μL, ddH2O 7.2 μL。每组处理进行两次完全独立实验, 每个独立实验进行三次生物学重复。反应结束后进行Ct值分析, 采用2–ΔΔCt法确定各目的基因的mRNA相对含量[17]。

表 1 所用引物及其用途Tab. 1 The primers and purpose
1.7 单糖含量的GC-MS分析
将龙须菜干样品研磨成粉后取20 mg, 加入700 μL的甲醇涡旋浑匀15s, 14000 r/min离心10min后取上清500 μL, 加入300 μL三氯甲烷混匀, 待溶液完全混匀后再加入750 μL的纯水, 混匀15s后14000 r/min离心10min, 取100 μL上清液在旋转蒸发仪中抽干水分。加入40 μL的甲氧基胺盐酸盐(20 mg/mL吡啶溶解), 在37oC下震荡反应2h, 然后混匀并短暂离心, 加入70 μL N-甲基-N-(三甲基硅烷)三氟乙酰胺(MSTFA), 在37oC下震荡反应30min, 混匀并短暂离心后转移100 μL至样品瓶待测[18]。
使用1300/ITQ 900 GC-MS系统 (Thermo Fisher Scientific, USA) 进行检测分析。GC-MS条件如下:Restek TR-5ms (30 m×0.25 mm×0.25 mm) 色谱柱,进样口温度为 250℃, EI离子源230℃, 使用高纯氦气作为载气, 进样量1 μL, 不分流进样。初始温度60℃, 2min后以10℃/min的速度升高到150℃, 保留10min后继续以15℃/min的升温速度达到250℃, 质谱m/z范围在50—550。通过National Institute of Standards and Technology(NIST) 和MassBank website(http://www.massbank.jp) 的质荷比及相对丰度比对化合物进行鉴定分析。
1.8 数据处理
采用SPSS 22软件进行数据处理和统计分析,用one-way ANOVA(Tukey) 进行差异显著性检验,设显著性水平为P<0.05。
2 结果
2.1 不同盐度处理下龙须菜的生长速率及光合特性变化
盐度25时龙须菜的生长速度最快, 高盐和低盐条件下的龙须菜生长速率都有不同程度的降低(图 1)。在高盐条件下龙须菜生长受到了显著的抑制, 与正常盐度相比, 相对生长速率降低了50.21%(P<0.05);在低盐条件下龙须菜的生长也受到了一定的抑制,相对生长速率降低了12.53%。
在盐度25的培养条件下, 龙须菜暗呼吸和光合放氧速率较为平稳, 生长的第3和第15天没有明显变化(图 2), 呼吸速率约为13 μmol O2/(h·g), 光合放氧速率约为18 μmol O2/(h·g)。与盐度25相比, 低盐和高盐下生长3d后, 呼吸速率显著升高(P<0.05), 在低盐下升高了82.57%, 在高盐下升高了53.40%, 在生长到达第15天时, 在低盐下的呼吸速率与正常盐度没有显著差异(P>0.05), 而在高盐下的龙须菜呼吸速率仍然比正常盐度要高18.20%(P<0.05)。龙须菜光合放氧速率在低盐和高盐条件下3d后与正常盐度龙须菜相比显著降低 (P<0.05), 分别降低了49.62%和24.84%, 经过15d的适应之后, 在低盐和高盐下龙须菜的光合放氧速率恢复到与正常盐度没有显著性差异(P>0.05)。
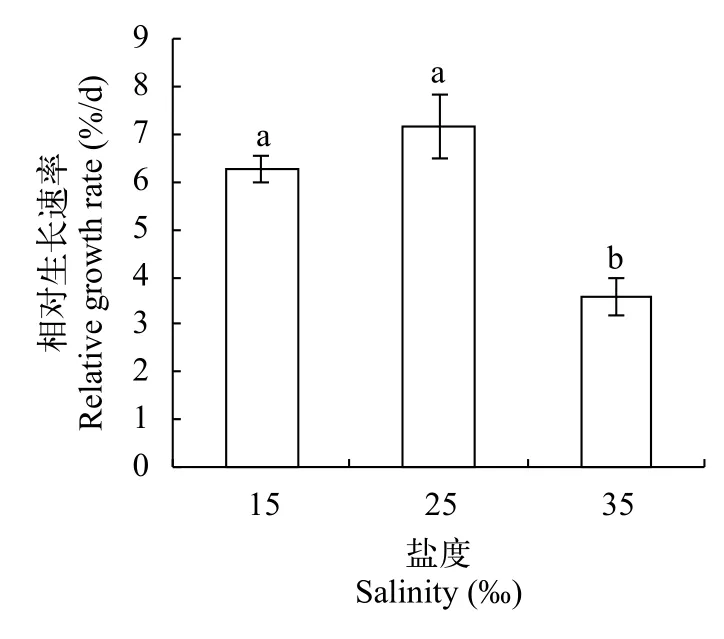
图 1 不同盐度处理下龙须菜的相对生长速率Fig. 1 The relative growth rate (RGR) of G. lemaneiformis in different salinities

图 2 在不同盐度处理下龙须菜生长3d及15d后的暗呼吸速率(A)和光合放氧速率(B)Fig. 2 Dark respiration rate (A) and photosynthetic oxygen evolution rate (B) of G. lemaneiformis in different salinities after 3d and 15d
2.2 不同盐度条件对龙须菜琼胶含量的影响
在培养15d后, 盐度15、25和35条件龙须菜琼胶含量分别为9.27%、6.91%和8.09%(图 3), 在低盐和高盐条件下龙须菜的琼胶含量都显著高于盐度25条件下的琼胶含量(P<0.05), 在不同盐度下龙须菜琼胶含量盐度15>盐度35>盐度25。
2.3 不同盐度对龙须菜基因表达的影响
图 4显示, 在处理第3和第15天时, 在低盐和高盐条件下龙须菜中的gla基因表达均高于正常盐度,在第3天, 分别达到正常盐度的1.58倍(P<0.05)和1.16倍(P>0.05), 在第15天时分别为正常盐度的1.34倍(P<0.05)和1.63倍(P>0.05)。在低盐条件下gat基因的表达在短期内受到了一定的抑制, 相对正常盐度降低了48%, 在高盐条件下为正常盐度1.53倍; 在第15天时在低盐下表达量回升到正常盐度的1.38倍, 在高盐下表达量升高到正常盐度的3.03倍, 都表现显著差异(P<0.05)。
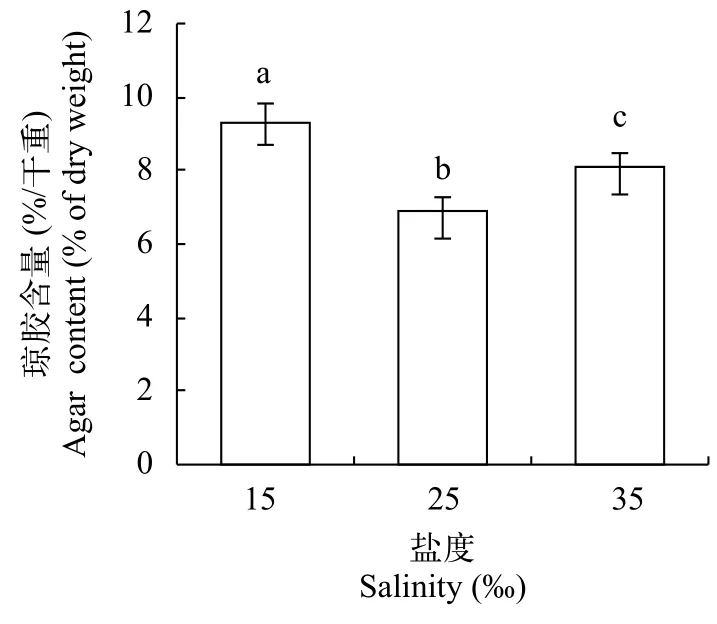
图 3 龙须菜在不同盐度下培养15天后的琼胶含量Fig. 3 The agar content of G. lemaneiformis in different salinities after 15 days
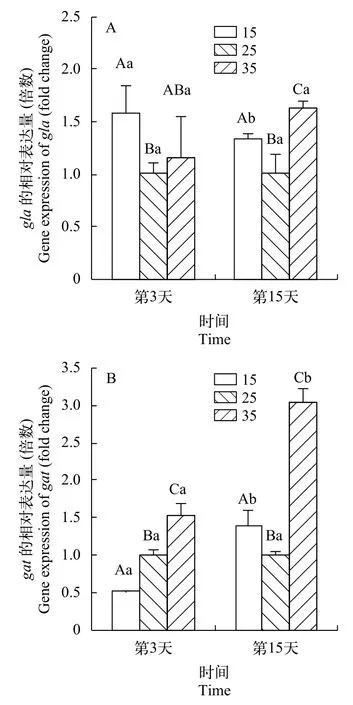
图 4 不同盐度对龙须菜gla(A)和gat(B)基因表达的影响Fig. 4 Effects of different salinity on gla (A) and gat (B) gene expression of G. lemaneiformis
相对于盐度25, 在低盐条件下龙须菜gas基因的相对表达量在处理的第3天显著下降了52.59%(P<0.05), 高盐下无显著差异; 第15天时3个盐度下的表达量无显著差异(图 5)。在处理第3天时, 在高盐和低盐条件下龙须菜gst基因的表达量相对盐度25分别显著下降50%和45%(P<0.05), 在高盐和低盐条件下的表达量无显著差异(P>0.05), 在第15天时都与盐度25无显著差异(P>0.05)。
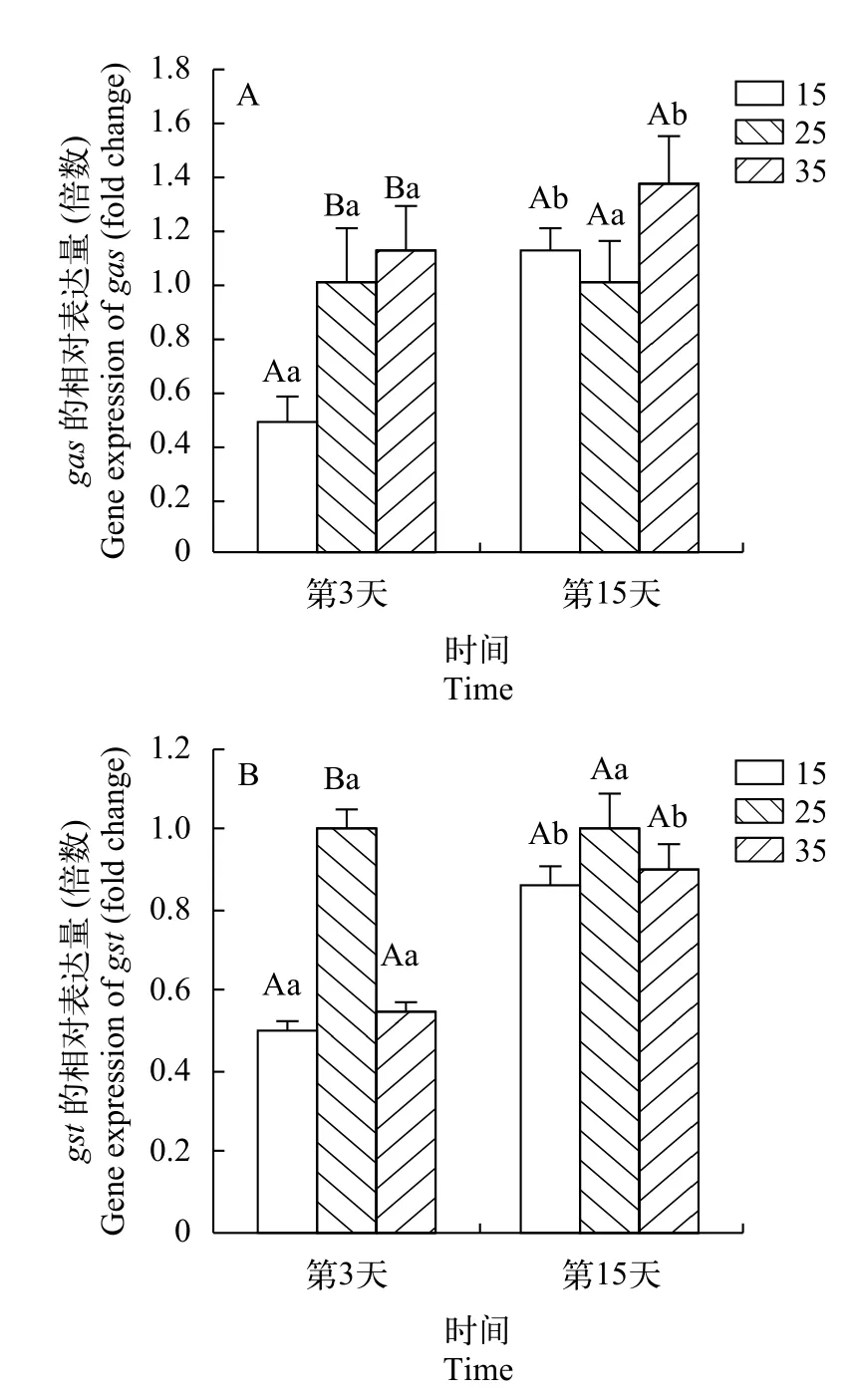
图 5 不同盐度对龙须菜gas(A)和gst(B)基因表达的影响Fig. 5 Effects of different salinity on gas (A) and gst (B) gene expression of G. lemaneiformis
2.4 不同盐度对龙须菜GLA酶活性的影响
在处理第3天时, 在不同盐度条件下龙须菜中的GLA酶活发生显著变化(图 6), 在低盐和高盐条件下酶活分别达到正常盐度的1.63倍和2.53倍(P<0.05), 不同盐度之间差异显著(P<0.05), 当培养15d时在不同盐度下龙须菜的GLA酶活性已无明显差异。
2.5 不同盐度下龙须菜中代表性糖类的相对含量变化
龙须菜在3种不同盐度下生长15d后, 使用MSTFA对样品进行糖的衍生化处理, 对其进行GCMS分析, 检测到的代谢产物主要有核糖醇、果糖、甘露糖、葡萄糖、半乳糖和海藻糖等(图 7)。
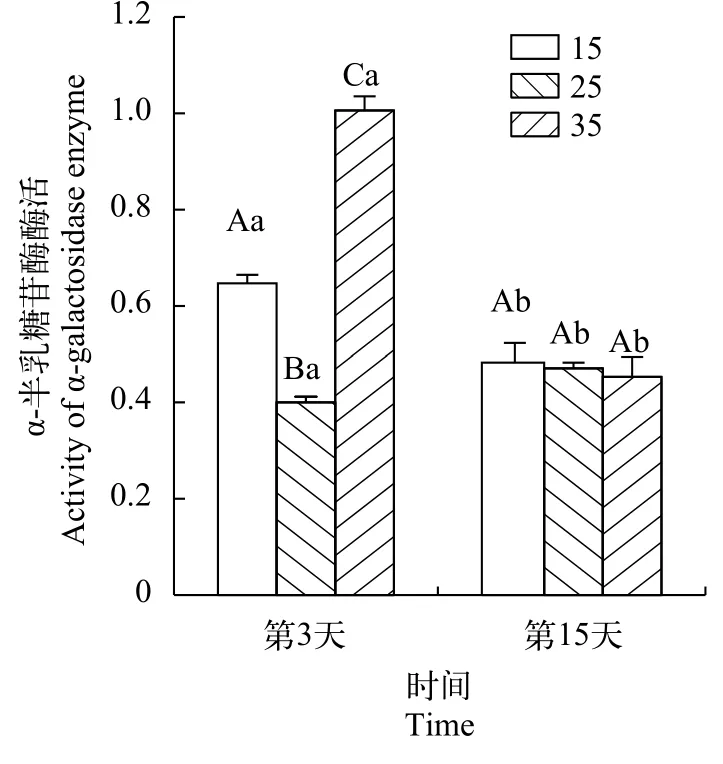
图 6 不同盐度对龙须菜GLA酶活性的影响Fig. 6 The activities of GLA of G. lemaneiformis under different salinity

图 7 不同盐度处理15天后龙须菜中糖类相对含量变化Fig. 7 Changes of sugar content of G. lemaneiformis after 15d of different salinity treatments
在高盐条件下半乳糖和海藻糖的含量显著升高, 分别为盐度25的3.27倍和6.00倍, 其他糖类与正常盐度无显著差异。
3 讨论
盐度是影响海洋藻类生长繁殖的重要环境因子, 具有明显的地理与季节性变化。盐度对各种红藻琼胶的产量和质量的影响有较大差异, 研究表明红藻在盐度变化时, 生长速度下降, 光合作用、碳固定及氮磷的吸收受到抑制, 同时会消耗更多的能量来维持细胞的离子平衡, 从而导致琼胶含量的下降[19—21]。也有研究证明红藻在环境盐度变化时, 因为要抵抗外部渗透压的变化, 细胞需要补充和修饰细胞壁间的琼胶, 从而为细胞提供更强的支撑力,引起琼胶含量的上升, 其中琼胶前体的来源可能是红藻糖苷与红藻淀粉的降解[10—12]。
3.1 盐度对龙须菜生长、形态结构和呼吸的影响
在盐度25条件下龙须菜的生长速度最快, 其次为盐度15, 盐度35最慢。在不同盐度下龙须菜在15d后形态特征也有了一定的区别, 在低盐条件下侧枝分化较少, 在高盐条件下生长受到明显抑制,枝干最短。在盐度15条件下的龙须菜细胞色素体板层结构明显肿胀且细胞间孔状联系部分被破坏,胞内红藻淀粉颗粒变少; 在盐度35条件下的藻体细胞内出现大量白色盐粒, 色素体板层结构模糊肿胀且细胞间孔状联系扭曲变形[22]。低盐与高盐处理后的龙须菜在短期内暗呼吸速率都显著升高且光合放氧速率下降, 但是在经过半个月的适应之后,盐度对光合及呼吸的影响明显降低。
3.2 龙须菜琼胶合成单体和前体聚合通路的酶
琼胶的合成可以分为琼胶单体的生物合成和琼胶前体形成聚合两部分, 其中关于琼胶单体的合成研究比较多, 迄今为止已经找到了一些与琼胶单体合成有关的酶, 如UDP-葡萄糖焦磷酸化酶、半乳糖-1-磷酸尿苷转移酶、GDP-甘露糖-3′,5′-表异构酶和GDP-甘露糖焦磷酸化酶等, 逐渐完善出了琼胶单体合成的通路[7,23,24], 但目前琼胶单体的聚合及其半乳糖骨架上各种取代基支链的形成还不够了解。半乳糖苷转移酶、磺基转移酶、硫酸酯酶、甲基转移酶和丙酮酰转移酶作为琼胶合成第二阶段的关键酶类, 它们的变化与琼胶的含量及质量都具有相关性。
3.3 盐度对龙须菜琼胶合成相关酶和基因表达的影响
GLA可以催化降解红藻糖苷来生成琼胶合成前体UDP -D-半乳糖[25], 研究对龙须菜在3种不同盐度下gla、gat、gst和gas基因的表达进行了分析, 在高盐条件下龙须菜中GLA酶活和基因表达量都最高, 半乳糖的含量也显著高于其他两组, 但是酶活和基因相对表达量的变化与琼胶含量并不呈现完全的线性相关, 说明虽然细胞中红藻糖苷降解生成了半乳糖, 但是产生的半乳糖并没有被充分利用,反而随之积累而含量升高, 并通过反馈调节使gat基因过量表达。在低盐条件下龙须菜中GLA酶活升高, 但半乳糖的含量却明显降低, 说明发生了活跃的半乳糖转化, 红藻糖苷降解生成的半乳糖进入了合成琼胶的通路。在低盐条件下红藻淀粉也会降解生成葡萄糖, 但实验显示葡萄糖含量也显著下降。Hu等[26]发现在低盐条件下培养2周后龙须菜中不仅淀粉含量下降, 其淀粉合成酶的基因表达也会受到抑制, 说明在低盐条件下龙须菜会消耗其他的多糖来合成更多的琼胶来保护自己, 同时也发现合成GDP-L-半乳糖的通路会受到抑制, 表明此时UDP-D-半乳糖的升高才是琼胶含量增长的原因,增长的琼胶几乎都源自红藻淀粉与红藻糖苷的转化而不是由卡尔文循环提供原料。
GST是将糖脂硫化的关键酶, 在细胞膜上起到抗菌抗氧化的作用, 这也是藻类细胞中半乳糖和硫酸基重要流向之一。实验中发现它在逆境盐度下表达受到抑制, 显示流向细胞膜合成的半乳糖与硫酸基的减少[27]。藻类中多糖需要在高尔基体中硫化之后才能转运到胞外生成琼胶[3]。我们发现在低盐条件下gas基因的相对表达量会下降, 这可能导致了6-硫酸根-L-半乳糖的生成量减少, 进入细胞壁间的C-3和C-4位硫酸化的半乳糖相对含量升高后,正常生成琼胶所需的3,6 -内醚-L-半乳糖含量减少,而硫酸酯基取代基含量上升, 长期过程中导致琼脂胶的含量上升而琼脂糖的含量下降, 凝胶强度下降但含量上升。单纯减少硫元素的输入在短时间内会让龙须菜中琼胶含量和凝胶强度都有轻微的上升, 长时间内又会引起琼胶含量的下降[28], 很有可能就与GAS的作用有关。影响龙须菜琼胶含量的因素复杂多样, 这些因素往往还会对琼胶的凝胶质量产生影响, 想要分别完全揭示这些因素的作用模式是比较困难的[29]。
本结果表明, 在低盐条件下, 龙须菜中红藻淀粉和红藻糖苷降解后生成的单糖大量的进入到琼胶合成的途径中, 在GAS的作用下, 琼胶中的硫酸酯基含量上升, 导致了凝胶强度下降但琼胶含量上升。在高盐条件下, 虽然也有红藻淀粉和红藻糖苷降解, 但降解后形成的单糖没有去合成琼胶, 推测在高盐条件下琼胶合成通路中有关键酶活性被抑制, 引起了半乳糖的积累及其向海藻糖的转化。

